人教化学选修4第四章第一节 原 电 池(共20张PPT)
文档属性
| 名称 | 人教化学选修4第四章第一节 原 电 池(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 14:38:23 | ||
图片预览








文档简介
(共20张PPT)
电化学基础
第一节 原电池
电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。日常生活中使用的手提电脑、手机、相机、Mp3……这一切都依赖于电池的应用。我们这节课将继续深入学习一下原电池的相关内容。
某化学兴趣小组为了体验水果电池电流的存在进行了下列实验。用橘子一个,铝片和锌片各一片,电灯泡一个,按图连接好。在实验前,先用砂纸擦去金属表面的氧化膜,实验时保持两金属插在橘子上不能直接接触。
原电池的构造及工作原理
1、原电池的定义:
将化学能转化学能为电能的装置叫做原电池。
3、原电池的电极:
负极:
发生氧化反应,电子流出(流向正极)的一极。
正极:
发生还原反应,电子流入(来自负极)的一极。
2、实质:
将氧化还原反应的电子转移变成电子的定向
移动,即将化学能转化的电能的形式释放。
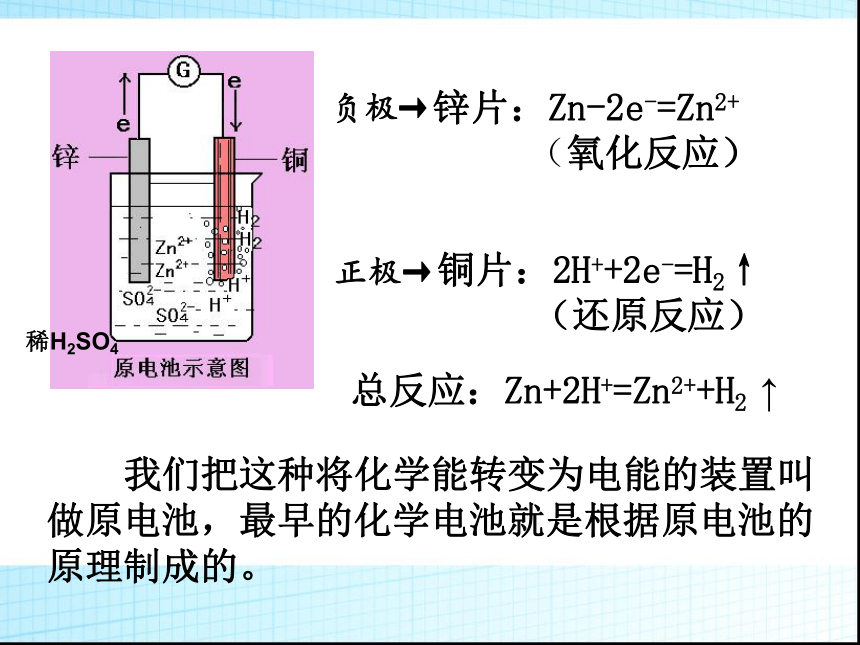
稀H2SO4
锌片:Zn-2e-=Zn2+
(氧化反应)
铜片:2H++2e-=H2↑
(还原反应)
我们把这种将化学能转变为电能的装置叫
做原电池,最早的化学电池就是根据原电池的
原理制成的。
正极→
负极→
总反应:Zn+2H+=Zn2++H2
↑
实验探究——铜锌原电池
观看实验视频分组讨论:
1、锌片和铜片分别插入稀硫酸中有什么现象?
2、锌片和铜片用导线连接后插入稀硫酸中现象又怎样?为什么?
3、锌片的质量有无变化?
4、溶液中c(H+)如何变化?
5、锌片和铜片上变化的反应方程式如何书写?
6、电子流动方向如何?电流方向如何?
3、锌片的质量有无变化?溶液中c(H+)如何变
化?
1、锌片和铜片分别插入稀硫酸中有什么现象?
2、锌片和铜片用导线连接后插入稀硫酸中现象
又怎样?为什么?
答:锌片表面产生气泡,铜片表面没有气泡产生。
答:铜片表面产生气泡,因为H+在铜片表面
被还原,产生了氢气。
答:锌片逐渐溶解,质量减小;
H+被还成H2,
c(H+)减小。
6、电子流动方向如何?电流方向如何?
5、锌片和铜片上变化的反应方程式如何书写?
4、锌铜原电池中哪种物质失去电子,哪种物质
得到电子?
答:活泼金属锌失去电子,氢离子得到电子。
答:(锌片)Zn-2e-
=
Zn2+
(铜片)2H++2e-
=
H2
↑
答:电子从锌片通过导线流向用电器,从铜
留回原电池,电流从铜片通过导线流向用电
器,从锌片留回原电池。
A.NaOH+HCl═NaCl+H2O
B.2CH3OH+3O2→2CO2+4H2O
C.Zn+2HCl═ZnCl2+H2↑
D.4Al+3O2+6H2O═4Al(OH)3
下列反应不可用于设计原电池的是:
(
A
)
对于锌、铜和稀硫酸组成的原电池,
A.Zn是负极????????????????????
B.电子由Zn经外电路流向Cu?
C.溶液中H+向负极移动?????????
D.Zn电极反应:Zn?-2e-==Zn2+
下列有关说法中,不正确的是(
)
C
解析:锌比铜活泼,锌做负极,失电子,经外电路流向Cu,溶液中H+?向正极移动。
答案:C
分组讨论:判断下列装置是否能形成原电池?
√
√
√
x
x
x
原电池的构成条件
构成原电池的条件:
(1)电极材料均插入电解质溶液中。
(2)有两种活动性不同的金属(或一种非金属导
体)作电极
(3)两极相连形成闭合回路。
(4)自发发生氧化还原反应(本质条件)。
【解析】 原电池构成的三个条件是:活泼性不同的两个电极,A错误;电解质溶液,B错误;构成闭合回路,D错误;C满足这三个条件。
【答案】 C
原电池的设计
请根据反应:Zn
+
CuSO4
=
ZnSO4
+
Cu设计
一个原电池,思考为什么有电流产生?
CuSO4溶液
Cu
Zn
Zn-2e-=Zn2+
Cu2++2e-
=Cu
正极
负极
装置图
电解质溶液
电极材料
电极反应
氧化反应
还原反应
(–)
(+)
e-
A
原电池的工作原理
锌片失去电子,铜离子得到电子,两极
之间溶液离子的定向移动和外部导线中电子
的定向移动,构成闭合回路,使两个电极反
应不断进行,发生有序的电子转移过程,产
生电流。
课堂小结:
2.两个电极相连插入电解质溶液;
把化学能直接转化为电能的装置。
1.有两块金属(或非金属)导体作电极;
二、构成原电池的基本条件:
一、原电池:
3.中并形成闭合电路。
4.自发发生氧化还原反应(本质条件)。
电化学基础
第一节 原电池
电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。日常生活中使用的手提电脑、手机、相机、Mp3……这一切都依赖于电池的应用。我们这节课将继续深入学习一下原电池的相关内容。
某化学兴趣小组为了体验水果电池电流的存在进行了下列实验。用橘子一个,铝片和锌片各一片,电灯泡一个,按图连接好。在实验前,先用砂纸擦去金属表面的氧化膜,实验时保持两金属插在橘子上不能直接接触。
原电池的构造及工作原理
1、原电池的定义:
将化学能转化学能为电能的装置叫做原电池。
3、原电池的电极:
负极:
发生氧化反应,电子流出(流向正极)的一极。
正极:
发生还原反应,电子流入(来自负极)的一极。
2、实质:
将氧化还原反应的电子转移变成电子的定向
移动,即将化学能转化的电能的形式释放。
稀H2SO4
锌片:Zn-2e-=Zn2+
(氧化反应)
铜片:2H++2e-=H2↑
(还原反应)
我们把这种将化学能转变为电能的装置叫
做原电池,最早的化学电池就是根据原电池的
原理制成的。
正极→
负极→
总反应:Zn+2H+=Zn2++H2
↑
实验探究——铜锌原电池
观看实验视频分组讨论:
1、锌片和铜片分别插入稀硫酸中有什么现象?
2、锌片和铜片用导线连接后插入稀硫酸中现象又怎样?为什么?
3、锌片的质量有无变化?
4、溶液中c(H+)如何变化?
5、锌片和铜片上变化的反应方程式如何书写?
6、电子流动方向如何?电流方向如何?
3、锌片的质量有无变化?溶液中c(H+)如何变
化?
1、锌片和铜片分别插入稀硫酸中有什么现象?
2、锌片和铜片用导线连接后插入稀硫酸中现象
又怎样?为什么?
答:锌片表面产生气泡,铜片表面没有气泡产生。
答:铜片表面产生气泡,因为H+在铜片表面
被还原,产生了氢气。
答:锌片逐渐溶解,质量减小;
H+被还成H2,
c(H+)减小。
6、电子流动方向如何?电流方向如何?
5、锌片和铜片上变化的反应方程式如何书写?
4、锌铜原电池中哪种物质失去电子,哪种物质
得到电子?
答:活泼金属锌失去电子,氢离子得到电子。
答:(锌片)Zn-2e-
=
Zn2+
(铜片)2H++2e-
=
H2
↑
答:电子从锌片通过导线流向用电器,从铜
留回原电池,电流从铜片通过导线流向用电
器,从锌片留回原电池。
A.NaOH+HCl═NaCl+H2O
B.2CH3OH+3O2→2CO2+4H2O
C.Zn+2HCl═ZnCl2+H2↑
D.4Al+3O2+6H2O═4Al(OH)3
下列反应不可用于设计原电池的是:
(
A
)
对于锌、铜和稀硫酸组成的原电池,
A.Zn是负极????????????????????
B.电子由Zn经外电路流向Cu?
C.溶液中H+向负极移动?????????
D.Zn电极反应:Zn?-2e-==Zn2+
下列有关说法中,不正确的是(
)
C
解析:锌比铜活泼,锌做负极,失电子,经外电路流向Cu,溶液中H+?向正极移动。
答案:C
分组讨论:判断下列装置是否能形成原电池?
√
√
√
x
x
x
原电池的构成条件
构成原电池的条件:
(1)电极材料均插入电解质溶液中。
(2)有两种活动性不同的金属(或一种非金属导
体)作电极
(3)两极相连形成闭合回路。
(4)自发发生氧化还原反应(本质条件)。
【解析】 原电池构成的三个条件是:活泼性不同的两个电极,A错误;电解质溶液,B错误;构成闭合回路,D错误;C满足这三个条件。
【答案】 C
原电池的设计
请根据反应:Zn
+
CuSO4
=
ZnSO4
+
Cu设计
一个原电池,思考为什么有电流产生?
CuSO4溶液
Cu
Zn
Zn-2e-=Zn2+
Cu2++2e-
=Cu
正极
负极
装置图
电解质溶液
电极材料
电极反应
氧化反应
还原反应
(–)
(+)
e-
A
原电池的工作原理
锌片失去电子,铜离子得到电子,两极
之间溶液离子的定向移动和外部导线中电子
的定向移动,构成闭合回路,使两个电极反
应不断进行,发生有序的电子转移过程,产
生电流。
课堂小结:
2.两个电极相连插入电解质溶液;
把化学能直接转化为电能的装置。
1.有两块金属(或非金属)导体作电极;
二、构成原电池的基本条件:
一、原电池:
3.中并形成闭合电路。
4.自发发生氧化还原反应(本质条件)。
