2.3《化学平衡》课件73页
文档属性
| 名称 | 2.3《化学平衡》课件73页 |

|
|
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 00:00:00 | ||
图片预览











文档简介
(共76张PPT)
第三节
化学平衡
一、化学平衡状态
(第1课时)
复习总结:
浓
度:浓度增大,化学反应速率加快;
浓度减小,化学反应速率减慢。
温
度:升高温度,化学反应速率加快(如为可逆反应则正逆
反应速率均加快,加快的程度不同)
降低温度:化学反应速率减慢(如为可逆反应则正逆反应
速率均减慢,减慢的程度不同)
压
强:变化可以看成浓度变化。
催化剂:同等程度改变正逆反应速率。
一、可逆反应
定义:在相同条件下、既可以向正反应进行同时又
可以向逆反应进行化学反应。
特点:两
同:相同条件;同时进行。
一不能:反应不能进行到底。
表示:在方程式中用“
”表示。
三、反应是否达到平衡的判定。
1、本质依据:等——V正=
V逆。
(1)、V
表示同一种物质的正逆反应速率时:
V正=
V逆
(2)、V
表示不同种物质的正逆反应速率时:v正
≠
v逆
2、特征依据:定——变量不变
方法:关键看给出的量在平衡前是否是变化的量(简称变量),变量不变则平衡。
变量不变
V正
≠
V逆
三、反应是否达到平衡的判定。
3、特殊标志:
①、对于有有色物质参加反应,如果体系颜色不变,反应达到平衡
②、对于吸热或放热反应,如果体系温度
不变,反应达到平衡(绝热容器)
变量不变
混合体系中各组成成分的物质的量、质量,物质的量浓度,转化率,等不随时间变化而变化。
从反应混合气体的平均相对分子质量M考虑
(I)若各物质均为气体
(I)
对于非等摩反应,如2SO2+O2
2SO3,M一定可做为平衡标志。
对于等摩反应,H2+l2=2Hl,M一定不能做为平衡标志。
(II)若有非气体参与,无论等摩非等摩反应,如C(s)+O2(g)
CO2(g),
CO2(g)+C(s)
2CO(g),M一定可标志达到平衡。
(2)从气体密度考虑
(I)当反应前后各成分均为气体时
恒容:ρ总为恒值,不能做平衡标志。
恒压:等摩反应,ρ总为恒值,不能作平衡标志。
非等摩反应,ρ为一定值时,可做为平衡标志。
(II)当有非气体物质参与反应时
恒容:ρ为一定值时,可作平衡标志。
恒压:ρ为一定值时,可作平衡标志。
反应前后当Δn(g)=0,即等摩反应则p为恒值,不能作平衡标志。
反应前后Δn(g)≠0,则当p一定时,可做平衡标志。
当化学平衡尚未建立成平衡发生移动时,反应总要放出或吸收热量,若为绝热体系,当体系内温度一定时,则标志达到平衡。
(3)从体系内部压强考虑:
(4)从体系内部温度考虑:
20℃时,蔗糖的溶解度是203.9g,其含义是_____时_____水中最多能溶解__
___蔗糖;或表示:_____时,______水中溶解_____蔗糖,溶液达__________.
20
℃
100g
203.9g
20
℃
100g
203.9g
饱和
饱和溶液中溶质的溶解过程完全停止了吗?
固体
溶质
溶液中
的溶质
溶解
结晶
即:溶解速率
=
结晶速率
达到了溶解的平衡状态,
溶解平衡状态是一种动态平衡
一、可逆反应
在同一条件下,既能向正反应方向进
行,同时又能向逆反应方向进行的反应,叫
做可逆反应.
注意:可逆反应总是不能进行到底,
得到的总是反应物与生成物的混合物
正反应速率
逆反应速率
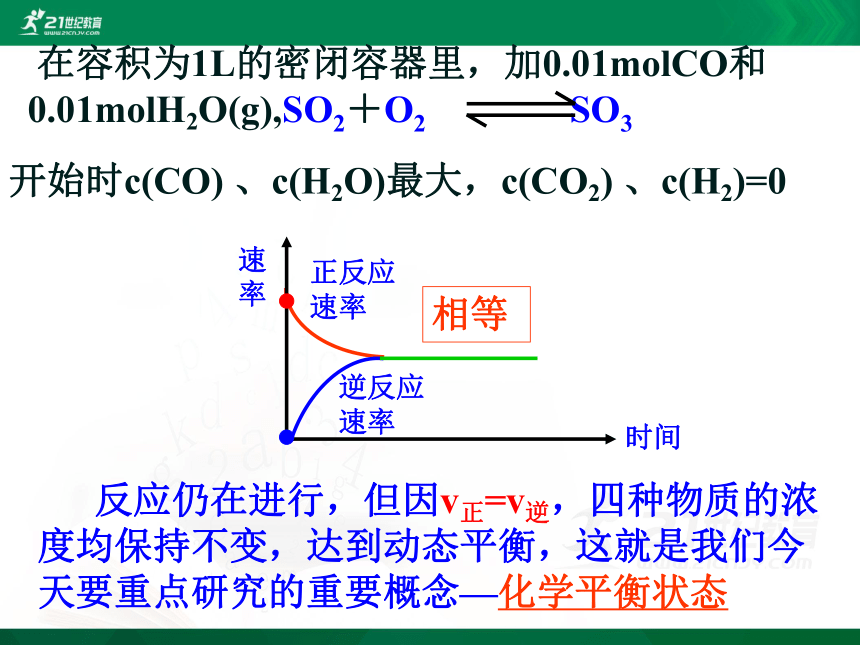
相等
反应仍在进行,但因v正=v逆,四种物质的浓度均保持不变,达到动态平衡,这就是我们今天要重点研究的重要概念—化学平衡状态
开始时c(CO)
、c(H2O)最大,c(CO2)
、c(H2)=0
在容积为1L的密闭容器里,加0.01molCO和0.01molH2O(g),SO2+O2
SO3
二、化学平衡状态
化学平衡状态:就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
强调三点
前提条件:可逆反应
实质:正反应速率=逆反应速率
标志:反应混合物中各组分的
浓度保持不变
1、化学平衡状态的定义
2、化学平衡状态的特征
(3)动:动态平衡(正逆反应仍在进行)
(5)变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。
(2)等:正反应速率=逆反应速率
(4)定:反应混合物中各组分的浓度保持不
变,各组分的含量一定。
(1)逆:可逆反应;
(6)同:条件相同,某一可逆反应无论是从正反应开始还是从逆反应开始,最终均可达到同一平衡状态。
即等效平衡,稍后讨论
如何判断可逆反应达到平衡状态?
3、可逆反应达到化学平衡状态的标志
(2)间接标志:
①各成分的百分组成不随时间改变而改变
②各物质的物质的量不随时间改变而改变
③反应混合物的颜色不随时间改变而改变
④气体压强不随时间改变而改变
⑤气体的密度或平均相对分子质量不随时
间改变而改变
对于不同类型的可逆反应,某
一物理量不变是否可作为平衡已到达
的标志,取决于该物理量在平衡到达
前(反应过程中)是否发生变化。若
是则可;否则,不行。
注意!
如:
(1)对于反应前后的气体物质的分子总数不相等的可逆反应:
(2SO2+O2
2SO3)
来说,可利用混合气体的总压、总体积、总物质的量是否随着时间的改变而改变来判断是否达到平衡。
(2)对于反应前后气体物质的分子数相等的可逆反应:
H2(g)+I2(g)
2HI(g)
不能用此标志判断平衡是否到达,因为在此反应过程中,气体的总压、总体积、总物质的量都不随时间的改变而改变。
【例1】
在一定温度下,可逆反应A(g)+3B(g)
2C(g)达到平衡的标志是( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
AC
重要题型:
【例2】
下列说法中可以充分说明反应:
P(g)+Q(g)
R(g)+S(g)
,
在恒温下已达平衡状态的是( )
反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而
变化
B
【例3】下列说法可以证明反应N2
(g)
+3H2
(g)
2NH3
(g)已达平衡状态的是(
)
AC
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
【例4】在一定温度下的恒容容器中,当
下列物理量不再发生变化时,表明反应:
A(固)+3B(气)
2C(气)+D(气)
已达平衡状态的是
(
)
A.
混合气体的压强
B.
混合气体的密度
C.
B的物质的量浓度
D.
气体的总物质的量
B
C
课堂
练
习
(1)混合气体的颜色不再改变
(
)
(2)混合气体的平均相对分子质量不变(
)
(3)混合气体的密度不变
(
)
(4)混合气体的压强不变
(
)
(5)单位时间内消耗2molNO2的同时
生成1molO2
(
)
(6)
O2气体的物质的量浓度不变
(
)
(1)容器内N2、H2、NH3三者共存
(2)容器内N2、H2、NH3三者浓度相等
(3)
容器内N2、H2、NH3的浓度比恰为
1:3:2
(4)混合物质量不随时间的变化而变化
(5)容器内压强不随时间的变化而变化
(6)容器内密度不再发生变化
(7)容器内的平均摩尔质量不再发生变化
2.能够说明
N2
(g)
+3H2
(g)
2NH3
(g)反应在密闭容器中已达到平衡状态的是
:
B
【复习巩固】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)
2C(气)+2D(固)达到平衡的标志的是(
)
①C的生成
速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A的分解速率是C的分解速率的一半
④A、B、C的质量分数不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成
3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
②⑧
第三节
化学平衡
(第2课时)
【复习】化学平衡状态的定义(化学反应的限度)
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡的特征:
逆
等
动
定
变
——可逆反应(或可逆过程)
——V正
=V逆(不同的平衡对应不同的速率)
——动态平衡。达平衡后,正逆反应仍在进行(V正=V逆≠0)
——平衡时,各组分浓度、含量保持不变(恒定)
——条件改变,平衡发生改变
定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。
V正≠V逆
V正=V逆≠0
条件改变
平衡1
不平衡
平衡2
建立新平衡
破坏旧平衡
V正=V逆≠0
′
′
一定时间
化学平衡的移动
′
′
【思考与交流】有哪些条件能改变化学平衡呢?
影响化学平衡状态的因素:实验2-5
滴加3~10滴浓硫酸
滴加10~20滴NaOH
Cr2O72-(橙色)+H2O
CrO42-(黄色)+2H+
1、浓度对化学平衡的影响(P27)
溶液橙色加深
溶液黄色加深
实验探究(P27实验2-6)
FeCl3+3KSCN
Fe(SCN)3+3KCl
(血红色)
A.加少量FeCl3,红色加深;
B.加少量KSCN,红色加深;
(无色)
(黄色)
(无色)
C.加少量KCl固体呢?
注:对于离子反应,只能改变实际参加反应的离子的浓度才能改变平衡。
增加Fe3+
或
SCN-的浓度,平衡向生成Fe(SCN)3的方向移动,故红色加深。
Fe3+
+
3OH-
?
Fe(OH)3↓
思考——加少量NaOH,溶液颜色有何变化。
有红褐色沉淀生成,溶液红色变浅
浓度对化学平衡的影响结论:
在其他条件不变时,
增大反应物或减小生成物的浓度
化学平衡向正反应方向移动
减小反应物或增大生成物的浓度
化学平衡向逆反应方向移动
平衡向右移动
平衡向左移动
原因分析:
运用浓度对化学反应速率的影响以及化学平衡的建立等知识,解释浓度对化学平衡的影响
t2
V”正
=
V”逆
V’逆
V,正
t3
V正=
V逆
V正
V逆
t1
V(molL-1S-1)
0
平衡状态Ⅰ
平衡状态Ⅱ
增大反应物浓度
速率-时间关系图:
增加反应物的浓度,
V正
>
V逆,平衡向正反应方向移动;
速率-时间关系图
注意:
⑴改变浓度一般针对溶液或气体参加的反应,而改变固体物质和纯液体的量,不影响平衡。
⑵对于离子反应,只能改变实际参加反应的离子的浓度才能改变平衡。
⑶对于一般的可逆反应(有两种反应物),增大一种反应物的浓度,会提高另一种反应物的转化率,而本身的转化率降低。
⑷在生产上,往往采用增大容易取得或成本较低的反应物浓度的方法,使成本较高的原料得到充分的利用。
1、已知在氨水中存在下列平衡:
NH3
+
H2O
NH3·
H2O
NH4+
+
OH-
(1)向氨水中加入MgCl2固体,平衡向
移动,
OH-浓度
,NH4+浓度
。
(2)向氨水中加入浓盐酸,平衡向
移动,
此时溶液中浓度减小的粒子有
。
(3)向氨水中加入少量NaOH固体,平衡向
.移动,此时发生的现象是
。
正反应方向
减小
增大
正反应方向
OH-、NH3·H2O、NH3
逆反应方向
有气体放出
2、可逆反应C(s)
+
H2O(g)
CO(g)
+
H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度
②加入更多的碳
③增加H2浓度
平衡正向移动,CO浓度增大
平衡不移动,CO浓度不变
平衡逆向移动,CO浓度减小
解析:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以V(正)仍等于V(逆),平衡不移动。
3、已知氯水中存在如下平衡:
Cl2+H2O
HCl+HClO。常温下,在一个体积为50mL的针筒内吸入40mL氯气后,再吸入10mL的水。写出针筒中可能观察到的现象。若将此针筒长时间放置,又可以看到何种变化?试用平衡的观点加以解释。
材料分析:
结论:
在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。
2、压强对化学平衡的影响:
1体积
3体积
2体积
二、压强对化学平衡的影响:
NH3%随着压强的增大而增大,即平衡向正反应的方向移动。
实验数据:
解释:
说明:增大压强,正逆反应速率均增大,但增大倍数
不一样,平衡向着体积缩小的方向移动
加压
→体积缩小
→浓度增大
→正反应速率增大
逆反应速率增大
→
V正>V逆
→平衡向正反应方向移动。
先决条件:
结论:
反应体系中有气体参加且反应
前后总体积发生改变。
aA(g)+bB(g)
cC(g)+dD(g)
a+b≠c+d
对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动,减小压强,会使化学平衡向着气体体积增大的方向移动。
体积缩小:平衡向气体分子数目减少的方向
体积增大:平衡向气体分子数目增多的方向
说明:
V(molL-1S-1)
0
t2
V”正
=
V”逆
V’逆
V‘正
增大压强
速率-时间关系图:
aA(g)+bB(g)
cC(g)+dD(g)
a+b
>
c+d
压强对化学平衡的影响
aA(g)+bB(g)
cC(g)
思考:对于反应
H2O+CO
H2+CO2
如果增大压强,反应速率是否改变,平衡是否移动?
高温
催化剂
速率-时间关系图:
V’正=
V’逆
增大压强,正逆反应速率均增大,但增大倍数一样,
V’正=
V’逆,平衡不移动。
t2
增大压强,体积减小,浓度同等程度增大,颜色变深,但平衡不移动.
2、压强对化学平衡的影响
[注意]
①对于反应前后气体总体积相等的反应,改变压强对平衡无影响;
②平衡混合物都是固体或液体的,改变压强不能使平衡移动;
③压强的变化必须改变混合物浓度(即容器体积有变化)才能使平衡移动。
2、压强对化学平衡的影响
判断压强引起平衡移动的思路:
压强如何改变?压强变化是否引起体积变化?
若体积变化则浓度发生改变
浓度改变则引起速率的变化
速率变化后,若导致V正
≠V逆时平衡移动
若V正
=
V逆时,则平衡不移动
增大压强对下列两个化学平衡的影响图象分析
t1
t2
t3
t2
大的大增、小的小增;大的大减、小的小减
t1
2NO2(g)
N2O4(g)
(2体积,红棕色)
(1体积,无色)
[讨论1]①当加压气体体积缩小时,混合气体颜色先变深是由于
,
后又逐渐变浅是由于
;
②当减压气体体积增大时,混合气体颜色先变浅是由于
,
后又逐渐变深是由于
。
NO2浓度增大
NO2浓度减小
平衡向正反应方向移动
平衡向逆反应方向移动
2NO2(g)
N2O4(g)
(2体积,红棕色)
(1体积,无色)
P2
>
P3
>
P1
P1
>
P3
>
P2
[讨论2]
试比较以下三种状态下的压强关系:
①改变压强前混合气体压强P1;
②改变压强后瞬时气体压强P2;
③改变压强达新平衡后混合气体压强P3。
加压:
;
减压:
。
正向移动
不移动
逆向移动
逆向移动
不移动
思考:对于反应②和⑤,增大压强时,平衡没有移动,但正逆反应速率有无变化?如何变化?
5、一定量的混合气体在密闭容器中发生反应:
m
A
(g)
+
n
B
(g)
p
C
(g)
达到平衡后,温度不变,将气体体积缩小到原来
的1/2,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是(
)
A、m
+
n
>
p
B、A
的转化率降低
C、平衡向正反应方向移动
D、C的体积分数增加
B
不移动
逆向移动
3、温度对化学平衡的影响(P30)
实验探究(实验2-7)
2NO2(g)
N2O4(g)
△H=-56.9kJ/mol
(红棕色)
(无色)
结论:在其它条件不变的情况下,升高温度,平衡向着吸热反应方向移动;降低温度,平衡向着放热反应方向移动。
(红棕色)
(无色)
[讨论]A:混和气体受热颜色变深,说明①
;
②
。
B:混和气体遇冷颜色变浅,说明①
;
②
。
NO2浓度增大
平衡向逆反应方向移动
NO2浓度减小
平衡向正反应方向移动
[分析]
A:混和物受热,速率均增大,但V(吸)>
V(放)
,
故平衡向吸热反应方向移动;
B:混和物遇冷,速率均减少,但V(吸)<
V(放)
,
故平衡向放热反应方向移动;
2NO2
N2O4
△H=-56.9kJ/mol
t2
V”正
=
V”逆
V’逆
V‘正
升高温度
速率
|
时间关系图
温度对化学平衡的影响
升温对吸热反应有利、降温对放热反应有利
(红棕色)
(无色)
[讨论]
试比较以下三种状态下的温度关系:
①改变温度前混合气体温度T1;
②改变温度后瞬时气体温度T2;
③改变温度达新平衡后混合气体温度T3。
升温:
;
降温:
。
T2
>
T3
>
T1
T1
>
T3
>
T2
练习
在高温下,反应
(正反应为吸热反应)要使混合气体颜色加深,可采取的方法是
A、减小压强
B、缩小体积
C、升高温度
D、增大H2浓度
(
B
C
)
2HBr(g)
H2(g)
+
Br2(g)
4、催化剂对化学平衡的影响:
催化剂同等程度改变化学反应速率,V’正=
V’逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。
例:对如下平衡
A(气)
+
B
(气)
2C
(气)
+
D
(固)
V正
V逆
0
t1
t2
V正′=
V逆′
t3
正催化剂对化学平衡的影响
V正
V逆
0
t1
t2
V正′=
V逆′
t3
负催化剂对化学平衡的影响
练习
对任何一个平衡体系,采取下列措施一定引起平衡移动的是
A、加入一种反应物
B、增加体系的压强
C、升高温度
D、使用催化剂
(
C
)
向正反应方向移动
向逆反应方向移动
向体积缩小方向移动
向体积增大方向移动
向吸热方向移动
向放热方向移动
向减弱这种改变的方向移动
反应物浓度减小
反应物浓度增大
体系压强减小
体系压强增大
体系温度减小
体系温度增大
减弱这种改变
规
律
改变一个条件
[总结]改变反应条件时平衡移动的方向
催化剂对化学平衡无影响,能缩短平衡到达的时间。
条件的改变
平衡移动方向
新平衡建立时
具
体
增大反应物浓度
减小反应物浓度
增大体系压强
减小体系压强
升高温度
降低温度
化学平衡移动:
化学平衡状态1
V正
=V逆
各物质组成一定
化学平衡状态2
V正’
=V逆’
各物质组分含
量达新值
平衡被破坏
V正≠V逆
各物质组分变化
新的平衡状态与旧的平衡状态不同在于:
1]
V和V′数值不同,可能大也可能小。
2]平衡混合物中各物质含量一定发生变化
可见,要引起化学平衡的移动,必须是由于外界条件的改变而引起V正≠
V逆。
平衡移动的本质:
化学平衡为动态平衡,条件改变造成
V正≠
V逆
平衡移动原理(勒沙特列原理):
如果改变影响平衡的条件(如浓度、压强、或温度)等,平衡就向能减弱这种改变的方向移动。
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
(1)适用范围
适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析。
(2)适用条件
一个能影响化学平衡的外界条件的变化
(3)平衡移动的结果是“减弱”外界条件的影响,而不能消除外界条件的影响。
勒夏特列原理(平衡移动原理)
7、对任何一个平衡体系,采取下列措施一定引起平衡移动的是(
)
A、加入一种反应物
B、增加体系的压强
C、升高温度
D、使用催化剂
C
CD
DE
BC
A.υ正增大、υ逆减少
B.υ正、υ逆均不变
D.平衡向右移动
E.υ正、υ逆均增大
C.平衡不发生移动
10、下列不能用勒夏特列原理解释的是(
)
①棕红色NO2加压后颜色先变深后变浅
②Fe(SCN)3溶液中加入固体KSCN后颜色变深
③氯水宜保存在低温、避光条件下
④SO2催化氧化成SO3的反应,往往加入过量的空气
⑤打开易拉罐有大量气泡冒出
⑥加催化剂,使氮气和氢气在一定条件下转化为氨气
⑥
1、某一温度下,在一带有活塞的体积可变的密闭容器中,可逆反应:N2+3H2
2NH3达到平衡,若向活塞施加一定的压力,使容器体积减小,则下列叙述正确的是(
)
;若保持该容器的体积不变,向该平衡体系中充入氩气,则下列叙述正确的是(
)
DE
BC
A.υ正增大、υ逆减少
B.υ正、υ逆均不变
D.平衡向右移动
E.υ正、υ逆均增大
C.平衡不发生移动
【综合练习】
2、对某一可逆反应来说,使用催化剂的作用是(
)
A.?
提高反应物的平衡转化率
B.?
以同样程度改变正逆反应的速率
C.?
增大正反应速率,降低逆反应速率
D.?
改变平衡混合物的组成
B
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第三节
化学平衡
一、化学平衡状态
(第1课时)
复习总结:
浓
度:浓度增大,化学反应速率加快;
浓度减小,化学反应速率减慢。
温
度:升高温度,化学反应速率加快(如为可逆反应则正逆
反应速率均加快,加快的程度不同)
降低温度:化学反应速率减慢(如为可逆反应则正逆反应
速率均减慢,减慢的程度不同)
压
强:变化可以看成浓度变化。
催化剂:同等程度改变正逆反应速率。
一、可逆反应
定义:在相同条件下、既可以向正反应进行同时又
可以向逆反应进行化学反应。
特点:两
同:相同条件;同时进行。
一不能:反应不能进行到底。
表示:在方程式中用“
”表示。
三、反应是否达到平衡的判定。
1、本质依据:等——V正=
V逆。
(1)、V
表示同一种物质的正逆反应速率时:
V正=
V逆
(2)、V
表示不同种物质的正逆反应速率时:v正
≠
v逆
2、特征依据:定——变量不变
方法:关键看给出的量在平衡前是否是变化的量(简称变量),变量不变则平衡。
变量不变
V正
≠
V逆
三、反应是否达到平衡的判定。
3、特殊标志:
①、对于有有色物质参加反应,如果体系颜色不变,反应达到平衡
②、对于吸热或放热反应,如果体系温度
不变,反应达到平衡(绝热容器)
变量不变
混合体系中各组成成分的物质的量、质量,物质的量浓度,转化率,等不随时间变化而变化。
从反应混合气体的平均相对分子质量M考虑
(I)若各物质均为气体
(I)
对于非等摩反应,如2SO2+O2
2SO3,M一定可做为平衡标志。
对于等摩反应,H2+l2=2Hl,M一定不能做为平衡标志。
(II)若有非气体参与,无论等摩非等摩反应,如C(s)+O2(g)
CO2(g),
CO2(g)+C(s)
2CO(g),M一定可标志达到平衡。
(2)从气体密度考虑
(I)当反应前后各成分均为气体时
恒容:ρ总为恒值,不能做平衡标志。
恒压:等摩反应,ρ总为恒值,不能作平衡标志。
非等摩反应,ρ为一定值时,可做为平衡标志。
(II)当有非气体物质参与反应时
恒容:ρ为一定值时,可作平衡标志。
恒压:ρ为一定值时,可作平衡标志。
反应前后当Δn(g)=0,即等摩反应则p为恒值,不能作平衡标志。
反应前后Δn(g)≠0,则当p一定时,可做平衡标志。
当化学平衡尚未建立成平衡发生移动时,反应总要放出或吸收热量,若为绝热体系,当体系内温度一定时,则标志达到平衡。
(3)从体系内部压强考虑:
(4)从体系内部温度考虑:
20℃时,蔗糖的溶解度是203.9g,其含义是_____时_____水中最多能溶解__
___蔗糖;或表示:_____时,______水中溶解_____蔗糖,溶液达__________.
20
℃
100g
203.9g
20
℃
100g
203.9g
饱和
饱和溶液中溶质的溶解过程完全停止了吗?
固体
溶质
溶液中
的溶质
溶解
结晶
即:溶解速率
=
结晶速率
达到了溶解的平衡状态,
溶解平衡状态是一种动态平衡
一、可逆反应
在同一条件下,既能向正反应方向进
行,同时又能向逆反应方向进行的反应,叫
做可逆反应.
注意:可逆反应总是不能进行到底,
得到的总是反应物与生成物的混合物
正反应速率
逆反应速率
相等
反应仍在进行,但因v正=v逆,四种物质的浓度均保持不变,达到动态平衡,这就是我们今天要重点研究的重要概念—化学平衡状态
开始时c(CO)
、c(H2O)最大,c(CO2)
、c(H2)=0
在容积为1L的密闭容器里,加0.01molCO和0.01molH2O(g),SO2+O2
SO3
二、化学平衡状态
化学平衡状态:就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
强调三点
前提条件:可逆反应
实质:正反应速率=逆反应速率
标志:反应混合物中各组分的
浓度保持不变
1、化学平衡状态的定义
2、化学平衡状态的特征
(3)动:动态平衡(正逆反应仍在进行)
(5)变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。
(2)等:正反应速率=逆反应速率
(4)定:反应混合物中各组分的浓度保持不
变,各组分的含量一定。
(1)逆:可逆反应;
(6)同:条件相同,某一可逆反应无论是从正反应开始还是从逆反应开始,最终均可达到同一平衡状态。
即等效平衡,稍后讨论
如何判断可逆反应达到平衡状态?
3、可逆反应达到化学平衡状态的标志
(2)间接标志:
①各成分的百分组成不随时间改变而改变
②各物质的物质的量不随时间改变而改变
③反应混合物的颜色不随时间改变而改变
④气体压强不随时间改变而改变
⑤气体的密度或平均相对分子质量不随时
间改变而改变
对于不同类型的可逆反应,某
一物理量不变是否可作为平衡已到达
的标志,取决于该物理量在平衡到达
前(反应过程中)是否发生变化。若
是则可;否则,不行。
注意!
如:
(1)对于反应前后的气体物质的分子总数不相等的可逆反应:
(2SO2+O2
2SO3)
来说,可利用混合气体的总压、总体积、总物质的量是否随着时间的改变而改变来判断是否达到平衡。
(2)对于反应前后气体物质的分子数相等的可逆反应:
H2(g)+I2(g)
2HI(g)
不能用此标志判断平衡是否到达,因为在此反应过程中,气体的总压、总体积、总物质的量都不随时间的改变而改变。
【例1】
在一定温度下,可逆反应A(g)+3B(g)
2C(g)达到平衡的标志是( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
AC
重要题型:
【例2】
下列说法中可以充分说明反应:
P(g)+Q(g)
R(g)+S(g)
,
在恒温下已达平衡状态的是( )
反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而
变化
B
【例3】下列说法可以证明反应N2
(g)
+3H2
(g)
2NH3
(g)已达平衡状态的是(
)
AC
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
【例4】在一定温度下的恒容容器中,当
下列物理量不再发生变化时,表明反应:
A(固)+3B(气)
2C(气)+D(气)
已达平衡状态的是
(
)
A.
混合气体的压强
B.
混合气体的密度
C.
B的物质的量浓度
D.
气体的总物质的量
B
C
课堂
练
习
(1)混合气体的颜色不再改变
(
)
(2)混合气体的平均相对分子质量不变(
)
(3)混合气体的密度不变
(
)
(4)混合气体的压强不变
(
)
(5)单位时间内消耗2molNO2的同时
生成1molO2
(
)
(6)
O2气体的物质的量浓度不变
(
)
(1)容器内N2、H2、NH3三者共存
(2)容器内N2、H2、NH3三者浓度相等
(3)
容器内N2、H2、NH3的浓度比恰为
1:3:2
(4)混合物质量不随时间的变化而变化
(5)容器内压强不随时间的变化而变化
(6)容器内密度不再发生变化
(7)容器内的平均摩尔质量不再发生变化
2.能够说明
N2
(g)
+3H2
(g)
2NH3
(g)反应在密闭容器中已达到平衡状态的是
:
B
【复习巩固】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)
2C(气)+2D(固)达到平衡的标志的是(
)
①C的生成
速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A的分解速率是C的分解速率的一半
④A、B、C的质量分数不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成
3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
②⑧
第三节
化学平衡
(第2课时)
【复习】化学平衡状态的定义(化学反应的限度)
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡的特征:
逆
等
动
定
变
——可逆反应(或可逆过程)
——V正
=V逆(不同的平衡对应不同的速率)
——动态平衡。达平衡后,正逆反应仍在进行(V正=V逆≠0)
——平衡时,各组分浓度、含量保持不变(恒定)
——条件改变,平衡发生改变
定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。
V正≠V逆
V正=V逆≠0
条件改变
平衡1
不平衡
平衡2
建立新平衡
破坏旧平衡
V正=V逆≠0
′
′
一定时间
化学平衡的移动
′
′
【思考与交流】有哪些条件能改变化学平衡呢?
影响化学平衡状态的因素:实验2-5
滴加3~10滴浓硫酸
滴加10~20滴NaOH
Cr2O72-(橙色)+H2O
CrO42-(黄色)+2H+
1、浓度对化学平衡的影响(P27)
溶液橙色加深
溶液黄色加深
实验探究(P27实验2-6)
FeCl3+3KSCN
Fe(SCN)3+3KCl
(血红色)
A.加少量FeCl3,红色加深;
B.加少量KSCN,红色加深;
(无色)
(黄色)
(无色)
C.加少量KCl固体呢?
注:对于离子反应,只能改变实际参加反应的离子的浓度才能改变平衡。
增加Fe3+
或
SCN-的浓度,平衡向生成Fe(SCN)3的方向移动,故红色加深。
Fe3+
+
3OH-
?
Fe(OH)3↓
思考——加少量NaOH,溶液颜色有何变化。
有红褐色沉淀生成,溶液红色变浅
浓度对化学平衡的影响结论:
在其他条件不变时,
增大反应物或减小生成物的浓度
化学平衡向正反应方向移动
减小反应物或增大生成物的浓度
化学平衡向逆反应方向移动
平衡向右移动
平衡向左移动
原因分析:
运用浓度对化学反应速率的影响以及化学平衡的建立等知识,解释浓度对化学平衡的影响
t2
V”正
=
V”逆
V’逆
V,正
t3
V正=
V逆
V正
V逆
t1
V(molL-1S-1)
0
平衡状态Ⅰ
平衡状态Ⅱ
增大反应物浓度
速率-时间关系图:
增加反应物的浓度,
V正
>
V逆,平衡向正反应方向移动;
速率-时间关系图
注意:
⑴改变浓度一般针对溶液或气体参加的反应,而改变固体物质和纯液体的量,不影响平衡。
⑵对于离子反应,只能改变实际参加反应的离子的浓度才能改变平衡。
⑶对于一般的可逆反应(有两种反应物),增大一种反应物的浓度,会提高另一种反应物的转化率,而本身的转化率降低。
⑷在生产上,往往采用增大容易取得或成本较低的反应物浓度的方法,使成本较高的原料得到充分的利用。
1、已知在氨水中存在下列平衡:
NH3
+
H2O
NH3·
H2O
NH4+
+
OH-
(1)向氨水中加入MgCl2固体,平衡向
移动,
OH-浓度
,NH4+浓度
。
(2)向氨水中加入浓盐酸,平衡向
移动,
此时溶液中浓度减小的粒子有
。
(3)向氨水中加入少量NaOH固体,平衡向
.移动,此时发生的现象是
。
正反应方向
减小
增大
正反应方向
OH-、NH3·H2O、NH3
逆反应方向
有气体放出
2、可逆反应C(s)
+
H2O(g)
CO(g)
+
H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度
②加入更多的碳
③增加H2浓度
平衡正向移动,CO浓度增大
平衡不移动,CO浓度不变
平衡逆向移动,CO浓度减小
解析:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以V(正)仍等于V(逆),平衡不移动。
3、已知氯水中存在如下平衡:
Cl2+H2O
HCl+HClO。常温下,在一个体积为50mL的针筒内吸入40mL氯气后,再吸入10mL的水。写出针筒中可能观察到的现象。若将此针筒长时间放置,又可以看到何种变化?试用平衡的观点加以解释。
材料分析:
结论:
在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。
2、压强对化学平衡的影响:
1体积
3体积
2体积
二、压强对化学平衡的影响:
NH3%随着压强的增大而增大,即平衡向正反应的方向移动。
实验数据:
解释:
说明:增大压强,正逆反应速率均增大,但增大倍数
不一样,平衡向着体积缩小的方向移动
加压
→体积缩小
→浓度增大
→正反应速率增大
逆反应速率增大
→
V正>V逆
→平衡向正反应方向移动。
先决条件:
结论:
反应体系中有气体参加且反应
前后总体积发生改变。
aA(g)+bB(g)
cC(g)+dD(g)
a+b≠c+d
对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动,减小压强,会使化学平衡向着气体体积增大的方向移动。
体积缩小:平衡向气体分子数目减少的方向
体积增大:平衡向气体分子数目增多的方向
说明:
V(molL-1S-1)
0
t2
V”正
=
V”逆
V’逆
V‘正
增大压强
速率-时间关系图:
aA(g)+bB(g)
cC(g)+dD(g)
a+b
>
c+d
压强对化学平衡的影响
aA(g)+bB(g)
cC(g)
思考:对于反应
H2O+CO
H2+CO2
如果增大压强,反应速率是否改变,平衡是否移动?
高温
催化剂
速率-时间关系图:
V’正=
V’逆
增大压强,正逆反应速率均增大,但增大倍数一样,
V’正=
V’逆,平衡不移动。
t2
增大压强,体积减小,浓度同等程度增大,颜色变深,但平衡不移动.
2、压强对化学平衡的影响
[注意]
①对于反应前后气体总体积相等的反应,改变压强对平衡无影响;
②平衡混合物都是固体或液体的,改变压强不能使平衡移动;
③压强的变化必须改变混合物浓度(即容器体积有变化)才能使平衡移动。
2、压强对化学平衡的影响
判断压强引起平衡移动的思路:
压强如何改变?压强变化是否引起体积变化?
若体积变化则浓度发生改变
浓度改变则引起速率的变化
速率变化后,若导致V正
≠V逆时平衡移动
若V正
=
V逆时,则平衡不移动
增大压强对下列两个化学平衡的影响图象分析
t1
t2
t3
t2
大的大增、小的小增;大的大减、小的小减
t1
2NO2(g)
N2O4(g)
(2体积,红棕色)
(1体积,无色)
[讨论1]①当加压气体体积缩小时,混合气体颜色先变深是由于
,
后又逐渐变浅是由于
;
②当减压气体体积增大时,混合气体颜色先变浅是由于
,
后又逐渐变深是由于
。
NO2浓度增大
NO2浓度减小
平衡向正反应方向移动
平衡向逆反应方向移动
2NO2(g)
N2O4(g)
(2体积,红棕色)
(1体积,无色)
P2
>
P3
>
P1
P1
>
P3
>
P2
[讨论2]
试比较以下三种状态下的压强关系:
①改变压强前混合气体压强P1;
②改变压强后瞬时气体压强P2;
③改变压强达新平衡后混合气体压强P3。
加压:
;
减压:
。
正向移动
不移动
逆向移动
逆向移动
不移动
思考:对于反应②和⑤,增大压强时,平衡没有移动,但正逆反应速率有无变化?如何变化?
5、一定量的混合气体在密闭容器中发生反应:
m
A
(g)
+
n
B
(g)
p
C
(g)
达到平衡后,温度不变,将气体体积缩小到原来
的1/2,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是(
)
A、m
+
n
>
p
B、A
的转化率降低
C、平衡向正反应方向移动
D、C的体积分数增加
B
不移动
逆向移动
3、温度对化学平衡的影响(P30)
实验探究(实验2-7)
2NO2(g)
N2O4(g)
△H=-56.9kJ/mol
(红棕色)
(无色)
结论:在其它条件不变的情况下,升高温度,平衡向着吸热反应方向移动;降低温度,平衡向着放热反应方向移动。
(红棕色)
(无色)
[讨论]A:混和气体受热颜色变深,说明①
;
②
。
B:混和气体遇冷颜色变浅,说明①
;
②
。
NO2浓度增大
平衡向逆反应方向移动
NO2浓度减小
平衡向正反应方向移动
[分析]
A:混和物受热,速率均增大,但V(吸)>
V(放)
,
故平衡向吸热反应方向移动;
B:混和物遇冷,速率均减少,但V(吸)<
V(放)
,
故平衡向放热反应方向移动;
2NO2
N2O4
△H=-56.9kJ/mol
t2
V”正
=
V”逆
V’逆
V‘正
升高温度
速率
|
时间关系图
温度对化学平衡的影响
升温对吸热反应有利、降温对放热反应有利
(红棕色)
(无色)
[讨论]
试比较以下三种状态下的温度关系:
①改变温度前混合气体温度T1;
②改变温度后瞬时气体温度T2;
③改变温度达新平衡后混合气体温度T3。
升温:
;
降温:
。
T2
>
T3
>
T1
T1
>
T3
>
T2
练习
在高温下,反应
(正反应为吸热反应)要使混合气体颜色加深,可采取的方法是
A、减小压强
B、缩小体积
C、升高温度
D、增大H2浓度
(
B
C
)
2HBr(g)
H2(g)
+
Br2(g)
4、催化剂对化学平衡的影响:
催化剂同等程度改变化学反应速率,V’正=
V’逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。
例:对如下平衡
A(气)
+
B
(气)
2C
(气)
+
D
(固)
V正
V逆
0
t1
t2
V正′=
V逆′
t3
正催化剂对化学平衡的影响
V正
V逆
0
t1
t2
V正′=
V逆′
t3
负催化剂对化学平衡的影响
练习
对任何一个平衡体系,采取下列措施一定引起平衡移动的是
A、加入一种反应物
B、增加体系的压强
C、升高温度
D、使用催化剂
(
C
)
向正反应方向移动
向逆反应方向移动
向体积缩小方向移动
向体积增大方向移动
向吸热方向移动
向放热方向移动
向减弱这种改变的方向移动
反应物浓度减小
反应物浓度增大
体系压强减小
体系压强增大
体系温度减小
体系温度增大
减弱这种改变
规
律
改变一个条件
[总结]改变反应条件时平衡移动的方向
催化剂对化学平衡无影响,能缩短平衡到达的时间。
条件的改变
平衡移动方向
新平衡建立时
具
体
增大反应物浓度
减小反应物浓度
增大体系压强
减小体系压强
升高温度
降低温度
化学平衡移动:
化学平衡状态1
V正
=V逆
各物质组成一定
化学平衡状态2
V正’
=V逆’
各物质组分含
量达新值
平衡被破坏
V正≠V逆
各物质组分变化
新的平衡状态与旧的平衡状态不同在于:
1]
V和V′数值不同,可能大也可能小。
2]平衡混合物中各物质含量一定发生变化
可见,要引起化学平衡的移动,必须是由于外界条件的改变而引起V正≠
V逆。
平衡移动的本质:
化学平衡为动态平衡,条件改变造成
V正≠
V逆
平衡移动原理(勒沙特列原理):
如果改变影响平衡的条件(如浓度、压强、或温度)等,平衡就向能减弱这种改变的方向移动。
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
(1)适用范围
适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析。
(2)适用条件
一个能影响化学平衡的外界条件的变化
(3)平衡移动的结果是“减弱”外界条件的影响,而不能消除外界条件的影响。
勒夏特列原理(平衡移动原理)
7、对任何一个平衡体系,采取下列措施一定引起平衡移动的是(
)
A、加入一种反应物
B、增加体系的压强
C、升高温度
D、使用催化剂
C
CD
DE
BC
A.υ正增大、υ逆减少
B.υ正、υ逆均不变
D.平衡向右移动
E.υ正、υ逆均增大
C.平衡不发生移动
10、下列不能用勒夏特列原理解释的是(
)
①棕红色NO2加压后颜色先变深后变浅
②Fe(SCN)3溶液中加入固体KSCN后颜色变深
③氯水宜保存在低温、避光条件下
④SO2催化氧化成SO3的反应,往往加入过量的空气
⑤打开易拉罐有大量气泡冒出
⑥加催化剂,使氮气和氢气在一定条件下转化为氨气
⑥
1、某一温度下,在一带有活塞的体积可变的密闭容器中,可逆反应:N2+3H2
2NH3达到平衡,若向活塞施加一定的压力,使容器体积减小,则下列叙述正确的是(
)
;若保持该容器的体积不变,向该平衡体系中充入氩气,则下列叙述正确的是(
)
DE
BC
A.υ正增大、υ逆减少
B.υ正、υ逆均不变
D.平衡向右移动
E.υ正、υ逆均增大
C.平衡不发生移动
【综合练习】
2、对某一可逆反应来说,使用催化剂的作用是(
)
A.?
提高反应物的平衡转化率
B.?
以同样程度改变正逆反应的速率
C.?
增大正反应速率,降低逆反应速率
D.?
改变平衡混合物的组成
B
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
