3.3盐类水解 第一课时(课件30页)
文档属性
| 名称 | 3.3盐类水解 第一课时(课件30页) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 00:00:00 | ||
图片预览








文档简介
(共31张PPT)
第一课时
第三章
水溶液中的离子平衡
第三节
盐类水解
人教版
高二化学
选修四
第一课时
第三章
水溶液中的离子平衡
第三节
盐类水解
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸
+
碱
==
盐
+
水
(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1、强酸强碱盐
2、强酸弱碱盐
3、强碱弱酸盐
4、弱酸弱碱盐
NaCl、
K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
【知识回顾】
①日常生活中,我们可以用Na2CO3溶液洗涤餐具上的油污。
②古时候,人们可以用草木灰(主要成分K2CO3)的水浸液洗涤衣服上的油污。
(信息提示:油污在碱性条件下容易除去)
思考:难道Na2CO3、K2CO3溶液呈碱性?
【实验验证】25℃时Na2CO3、K2CO3溶液的酸碱性
【困惑】
Na2CO3溶液
K2CO3溶液
碱性
pH>7
pH>7
碱性
①Na2CO3、K2CO3溶液中的H+和OH-来于何处?
②为什么Na2CO3、K2CO3溶液会呈碱性?
Na2CO3
、K2CO3
本身既不会电离出H+,也不会电离出OH-。
【回忆思考】
Na2CO3俗称什么?分别往Na2CO3和NaHCO3的溶液中滴加酚酞,可观察到什么现象?
?
NaHCO3溶液
Na2CO3溶液
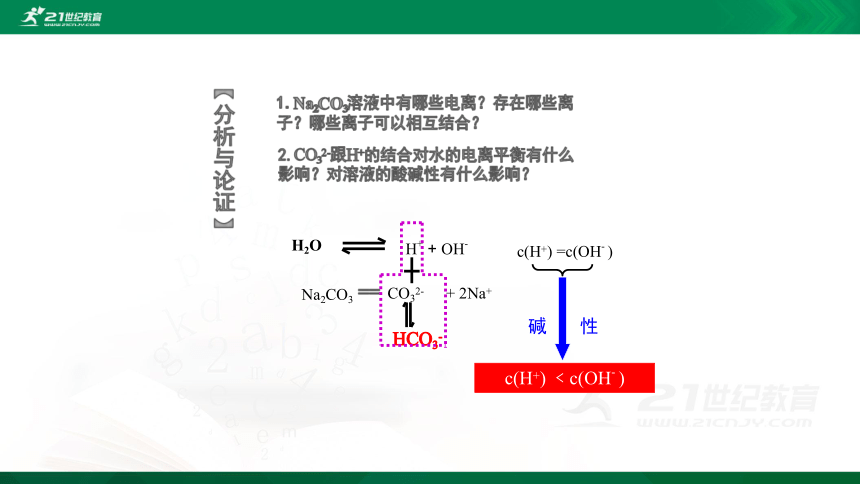
1.Na2CO3溶液中有哪些电离?存在哪些离子?哪些离子可以相互结合?
2.CO32-跟H+的结合对水的电离平衡有什么影响?对溶液的酸碱性有什么影响?
H2O
H+
+
OH-
c(H+)
=c(OH-
)
Na2CO3
==
CO32-
+
2Na+
HCO3-
c(H+)
﹤c(OH-
)
碱
性
【分析与论证】
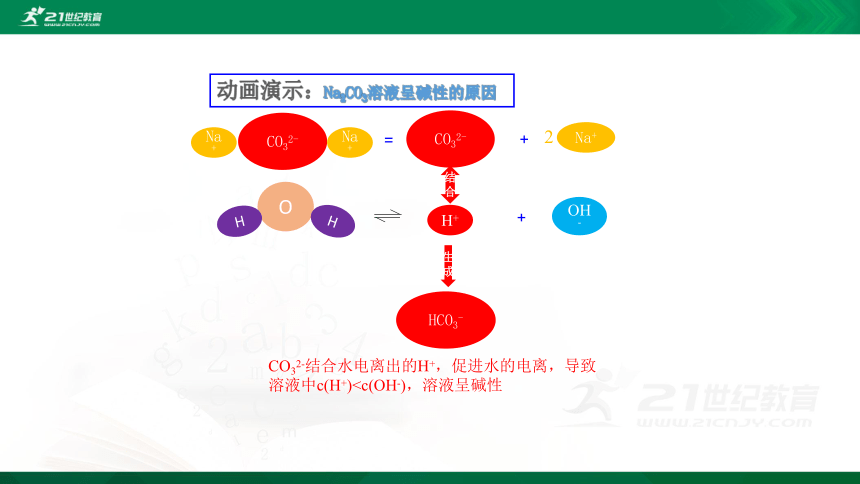
动画演示:Na2CO3溶液呈碱性的原因
=
+
H+
+
OH-
CO32-
Na+
O
H
H
结合
生成
HCO3-
CO32-结合水电离出的H+,促进水的电离,导致溶液中c(H+)CO32-
Na+
Na+
2
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
一、寻找规律
探究盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
碱性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
板书:一、盐的类型与盐溶液酸碱性的关系:
盐的类型
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
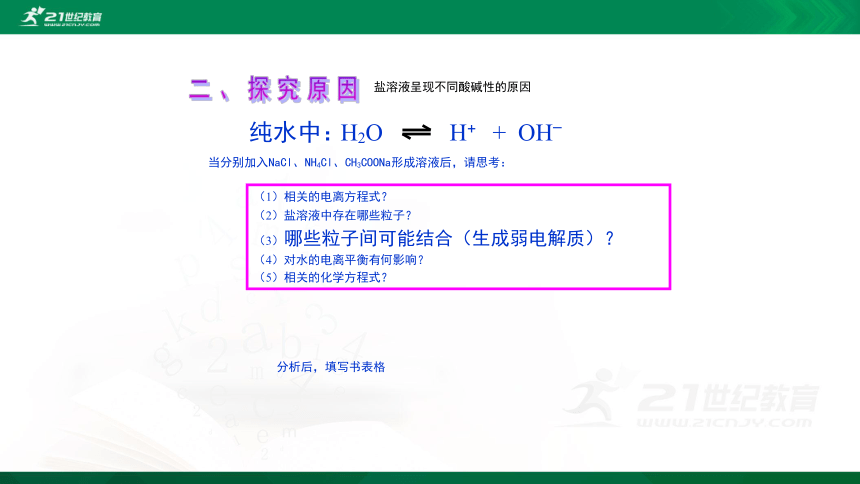
二、探究原因
盐溶液呈现不同酸碱性的原因
H2O
H+
+
OH–
纯水中:
当分别加入NaCl、NH4Cl、CH3COONa形成溶液后,请思考:
(1)相关的电离方程式?
(2)盐溶液中存在哪些粒子?
(3)哪些粒子间可能结合(生成弱电解质)?
(4)对水的电离平衡有何影响?
(5)相关的化学方程式?
分析后,填写书表格
【探究1】
往水中加NaCl形成溶液。
⑴
电离方程式
⑵
c(H+)和c(OH–)相对大小
⑶
盐溶液的酸碱性
⑷
盐溶液中的粒子
⑸
有无弱电解质生成
⑹
相关化学方程式
H2O
H+
+
OH–
NaCl
Cl–
+
Na+
Na+、Cl–、H+、OH–、H2O
无
c(H+)
c(OH–)
=
中性
无
(对水的电离平衡无影响)
⑴
电离方程式
⑵
c(H+)和c(OH–)相对大小
⑶
盐溶液的酸碱性
⑷
盐溶液中的粒子
⑸
有无弱电解质生成
⑹
相关化学方程式
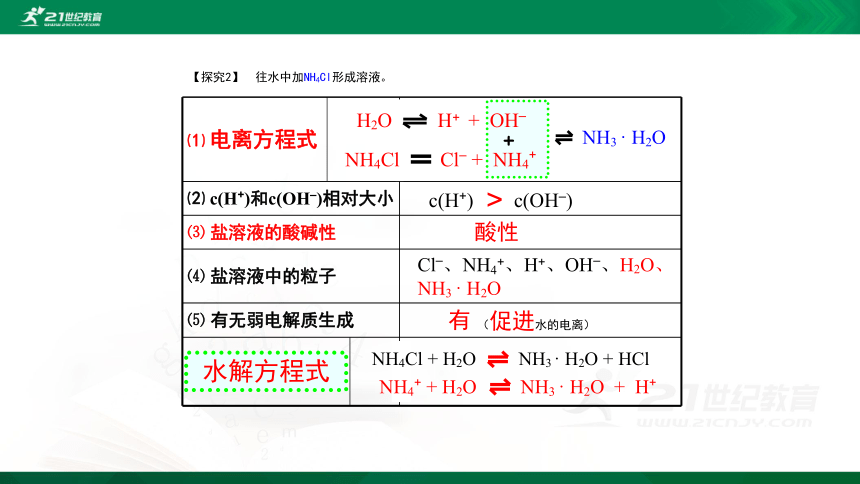
【探究2】
往水中加NH4Cl形成溶液。
H2O
H+
+
OH–
NH4Cl
Cl–
+
NH4+
+
有
(促进水的电离)
NH3
·
H2O
c(H+)
c(OH–)
>
酸性
Cl–、NH4+、H+、OH–、H2O、
NH3
·
H2O
NH4Cl
+
H2O
NH3
·
H2O
+
HCl
NH4+
+
H2O
NH3
·
H2O
+
H+
水解方程式
⑴
电离方程式
⑵
c(H+)和c(OH–)相对大小
⑶
盐溶液的酸碱性
⑷
盐溶液中的粒子
⑸
有无弱电解质生成
⑹
相关化学方程式
【探究3】
往水中加CH3COONa形成溶液。
H2O
OH–
+
H+
CH3COONa
Na+
+
CH3COO–
+
有
(促进水的电离)
CH3COOH
c(H+)
c(OH–)
<
碱性
Na+、CH3COO–、OH–、H+、H2O、CH3COOH
CH3COONa
+
H2O
CH3COOH
+
NaOH
CH3COO–
+
H2O
CH3COOH
+
OH–
水解方程式
H2O
H
+
+
OH
–
CH3COONa
==
Na+
+
CH3COO
–
NH4Cl
==
Cl
–
+
NH4+
板书:二、盐溶液呈不同酸碱性的原因:
盐类的水解
板书:三、盐类水解:
在溶液中盐电离出来的弱离子(弱酸根离子或弱碱阳离子)跟水所电离出来的H+
或OH–结合生成弱电解质(弱酸、弱碱)的反应,叫做盐类的水解。
以CH3COONa和NH4Cl的水溶液的酸碱性为例:
1、概念:
盐
+
水
酸
+
碱
2.实质:破坏了水的电离平衡,促进了水的电离
3.条件:
盐可溶于水
盐可电离出弱酸阴离子或弱碱阳离子。
常见的弱酸根阴离子:CO32-
HCO3-
CH3COO-
S2-
HS-
F-
ClO-
SO32-
HSO3-等都能水解
常见的弱碱阳离子:Fe3+
Fe2+
Al3+
Cu2+
NH4+等都能水解
4.特征:水解过程是可逆的、微弱的。
盐类
实例
能否水解
引起水解的离子
对水的电离
平衡的影响
溶液的
酸碱性
强碱
弱酸盐
强酸
弱碱盐
强酸
强碱盐
弱酸弱碱盐
CH3COONH4
能
弱酸阴离子
弱碱阳离子
促进水的电离
不一定
NaAc
能
弱酸阴离子
促进水的电离
碱性
NH4Cl
能
弱碱阳离子
促进水的电离
酸性
NaCl
不能
无
无
中性
分析:
5、水解的规律:
⑴
谁__谁水解;无__不水解;
⑵
越__越水解;都__双水解;
⑶
谁__显谁性;同强显__性。
弱
弱
弱
弱
强
中
记住啦!
补充:
1.强酸弱碱盐水解,溶液显酸性
2.强碱弱酸盐水解,溶液显碱性
3.强酸强碱盐不水解,溶液通常显中性
4.弱酸弱碱盐强烈水解(强烈是相对的)
5.弱酸酸式盐,取决于酸式酸根离子的电离程度和水解程度的相对大小(与电离及水解平衡常数有关)
【巩固运用,反馈验收】
例1.分析下列盐能否发生水解反应?能发生水解反应的请指出该溶液的酸碱性。
(1)CuCl2
Fe2(SO4)3
NH4NO3
(2)KNO2
NaCN
NaF
(3)K2SO4
KCl
NaBr
例2.已知25℃时,测得某溶液的pH=3,则该溶液中由水电离出的H+浓度是多少?
课后思考:
①根据成盐酸碱的强弱给例1中的盐进行分类,并试着分析盐类水解的规律有哪些?
②已知CH3COONH4溶液呈中性,它没有水解吗?
③Al3+和HCO3-为什么不能在溶液中共存?
答案:①加酸:抑制水的电离
c(H+)水=c(OH-)=1x10-11mol/L
②加水解呈酸性的盐:促进水的电离
c(H+)水=c(H+)=1x10-3mol/L
扩展:25℃时,若测得某溶液的pH=9,该溶液中由水电离出的
OH-浓度又如何计算?
课题检测
2.下列溶液能使酚酞指示剂显红色的是(
)
A.K2CO3
B.NaHSO4
C.Na2SO4
D.FeCl3
A
1.下列离子在水溶液中不会发生水解的是(
)
A.NH4+
B.
SO42_
C.Al3+
D.F-
B
3.
室温下,下列溶液pH小于7的是(
)
A.溴化钾
B.硫酸铜
C.硫化钠
D.硝酸钡
B
巩固练习:
盐
+
水
酸
+
碱
四、盐类水解方程式的书写(说明):
先找“弱”离子。
一般水解程度小,水解产物少。因此,常用“
”
;不写“
==
”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐的水解,常写成一步完成。
弱离子
+
水
弱酸(or弱碱)
+
OH–
(
or
H+
)
NH4Cl
=
Cl-
+
NH4+
H2O
H+
+
OH-
+
NH3·H2O
NH4+
+
H2O
NH3·H2O
+
H+
c(H+)
>
c(OH-)
NH4Cl
+
H2O
NH3·H2O
+
HCl
平衡向右移动
离子方程式:
化学方程式:
CH3COONa
CH3COO-
H2O
H+
+
CH3COOH
平衡向右移动
Na+
+
OH-
+
所以导致溶液中[OH-]>[H+],溶液显碱性。
CH3COONa+H2O
CH3COOH+NaOH
化学方程式:
CH3COO-+H2O
CH3COOH+OH-
弱碱阳离子水解:
强碱阳离子、强酸酸根离子不发生水解,
溶液
弱酸酸根离子水解:
M++H2O
A-+H2O
中性
碱性
酸性
溶液显酸性
MOH+H+
溶液显碱性
HA+OH-
显中性
综上:
盐类水解的实质是生成弱酸或弱碱,使水的电离平衡被破坏而建立起新的平衡。
四、盐类水解方程式的书写(举例):
(一)一元弱酸强碱盐
如:CH3COONa、NaF
化学方程式:
离子方程式:
CH3COONa
+
H2O
CH3COOH
+
NaOH
CH3COO–
+
H2O
CH3COOH
+
OH–
化学方程式:
离子方程式:
NaF
+
H2O
HF
+
NaOH
F–
+
H2O
HF
+
OH–
(二)多元弱酸强碱盐
如:Na2CO3、
Na3PO4
离子方程式:
HCO3
–
+
H2O
H2CO3
+
OH
–
CO3
2–
+
H2O
HCO3
–
+
OH
–
(主)
(次)
Na2CO3溶液中含有的粒子?
?
2种分子,5种离子
(三)弱碱强酸盐水解
如:NH4Cl、CuSO4、AlCl3
水解的离子方程式:
NH4+
+
H2O
NH3·H2O
+
H+
Cu2+
+
2H2O
Cu(OH)2
+
2H+
Al
3+
+
3H2O
Al(OH)3
+
3H+
(四)弱酸弱碱盐水解
1、一般双水解,如:CH3COONH4
CH3COO–
+
NH4+
+
H2O
CH3COOH
+
NH3·H2O
(NH4)2CO3
NH4HCO3
2、“完全双水解”的,用“
==
”、“↑”、“↓”。
Al
3+
+
3HCO3–
Al(OH)3
+
3CO2
举例:请书写下列物质水解的方程式:Al2S3、Mg3N2
Al3+与AlO2–、HCO3–、CO32–、S2–、HS–、ClO–
Fe3+与AlO2–、HCO3–、CO32–
NH4+与SiO32–
Al2S3
+
6H2O
2Al(OH)3
+
3H2S
Mg3N2
+
6H2O
3Mg(OH)2
+
2NH3
以上为“完全双水解”,进行得非常充分,故用“==”连接,
且标上“
”、“
”符号。
常见“完全双水解”的弱离子组合——
如:
(NH4)2CO3
、NH4HCO3、
CH3COONH4
但有些弱酸弱碱盐是进行“一般双水解”。
(五)多元弱酸酸式酸根的水解与电离的区别:
⑴
NaHCO3
HCO3
–
+
H2O
H2CO3
+
OH
–
①
②
HCO3
–
+
H2O
CO32–
+
H3O
+
①
水解
②
电离
程度:
>
∴溶液呈
性
碱
⑵
NaHSO3
HSO3
–
+
H2O
H2SO3
+
OH
–
①
②
HSO3
–
+
H2O
SO32–
+
H3O
+
①
水解
②
电离
程度:
<
∴溶液呈
性
酸
⑶
NaH2PO4
溶液呈弱酸性
⑷
Na2HPO4
溶液呈弱碱性
1.
下列溶液pH小于7的是
A、氯化钾
B、硫酸铜
C、硫化钠
D、硝酸钡
2.
下列溶液能使酚酞指示剂显红色的是
A.
碳酸钾
B.
硫酸氢钠
C.
碳酸氢钠
D.
氯化铁
3.
下列离子在水溶液中不会发生水解的是
A.
NH4+
B.
SO42–
C.
Al3+
D.
F
–
4.?氯化铵溶液中离子浓度从大到小排列正确的是
A.
NH4+
、H
+
、OH
–、Cl
–
B.
Cl
–
、
NH4+
、H
+
、OH
–
C.
H
+、
Cl
–
、
NH4+
、OH
–
D.
Cl
–
、
NH4+
、
OH
–
、H
+
【课堂练习】
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第一课时
第三章
水溶液中的离子平衡
第三节
盐类水解
人教版
高二化学
选修四
第一课时
第三章
水溶液中的离子平衡
第三节
盐类水解
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸
+
碱
==
盐
+
水
(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1、强酸强碱盐
2、强酸弱碱盐
3、强碱弱酸盐
4、弱酸弱碱盐
NaCl、
K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
【知识回顾】
①日常生活中,我们可以用Na2CO3溶液洗涤餐具上的油污。
②古时候,人们可以用草木灰(主要成分K2CO3)的水浸液洗涤衣服上的油污。
(信息提示:油污在碱性条件下容易除去)
思考:难道Na2CO3、K2CO3溶液呈碱性?
【实验验证】25℃时Na2CO3、K2CO3溶液的酸碱性
【困惑】
Na2CO3溶液
K2CO3溶液
碱性
pH>7
pH>7
碱性
①Na2CO3、K2CO3溶液中的H+和OH-来于何处?
②为什么Na2CO3、K2CO3溶液会呈碱性?
Na2CO3
、K2CO3
本身既不会电离出H+,也不会电离出OH-。
【回忆思考】
Na2CO3俗称什么?分别往Na2CO3和NaHCO3的溶液中滴加酚酞,可观察到什么现象?
?
NaHCO3溶液
Na2CO3溶液
1.Na2CO3溶液中有哪些电离?存在哪些离子?哪些离子可以相互结合?
2.CO32-跟H+的结合对水的电离平衡有什么影响?对溶液的酸碱性有什么影响?
H2O
H+
+
OH-
c(H+)
=c(OH-
)
Na2CO3
==
CO32-
+
2Na+
HCO3-
c(H+)
﹤c(OH-
)
碱
性
【分析与论证】
动画演示:Na2CO3溶液呈碱性的原因
=
+
H+
+
OH-
CO32-
Na+
O
H
H
结合
生成
HCO3-
CO32-结合水电离出的H+,促进水的电离,导致溶液中c(H+)
Na+
Na+
2
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
一、寻找规律
探究盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
碱性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
板书:一、盐的类型与盐溶液酸碱性的关系:
盐的类型
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
二、探究原因
盐溶液呈现不同酸碱性的原因
H2O
H+
+
OH–
纯水中:
当分别加入NaCl、NH4Cl、CH3COONa形成溶液后,请思考:
(1)相关的电离方程式?
(2)盐溶液中存在哪些粒子?
(3)哪些粒子间可能结合(生成弱电解质)?
(4)对水的电离平衡有何影响?
(5)相关的化学方程式?
分析后,填写书表格
【探究1】
往水中加NaCl形成溶液。
⑴
电离方程式
⑵
c(H+)和c(OH–)相对大小
⑶
盐溶液的酸碱性
⑷
盐溶液中的粒子
⑸
有无弱电解质生成
⑹
相关化学方程式
H2O
H+
+
OH–
NaCl
Cl–
+
Na+
Na+、Cl–、H+、OH–、H2O
无
c(H+)
c(OH–)
=
中性
无
(对水的电离平衡无影响)
⑴
电离方程式
⑵
c(H+)和c(OH–)相对大小
⑶
盐溶液的酸碱性
⑷
盐溶液中的粒子
⑸
有无弱电解质生成
⑹
相关化学方程式
【探究2】
往水中加NH4Cl形成溶液。
H2O
H+
+
OH–
NH4Cl
Cl–
+
NH4+
+
有
(促进水的电离)
NH3
·
H2O
c(H+)
c(OH–)
>
酸性
Cl–、NH4+、H+、OH–、H2O、
NH3
·
H2O
NH4Cl
+
H2O
NH3
·
H2O
+
HCl
NH4+
+
H2O
NH3
·
H2O
+
H+
水解方程式
⑴
电离方程式
⑵
c(H+)和c(OH–)相对大小
⑶
盐溶液的酸碱性
⑷
盐溶液中的粒子
⑸
有无弱电解质生成
⑹
相关化学方程式
【探究3】
往水中加CH3COONa形成溶液。
H2O
OH–
+
H+
CH3COONa
Na+
+
CH3COO–
+
有
(促进水的电离)
CH3COOH
c(H+)
c(OH–)
<
碱性
Na+、CH3COO–、OH–、H+、H2O、CH3COOH
CH3COONa
+
H2O
CH3COOH
+
NaOH
CH3COO–
+
H2O
CH3COOH
+
OH–
水解方程式
H2O
H
+
+
OH
–
CH3COONa
==
Na+
+
CH3COO
–
NH4Cl
==
Cl
–
+
NH4+
板书:二、盐溶液呈不同酸碱性的原因:
盐类的水解
板书:三、盐类水解:
在溶液中盐电离出来的弱离子(弱酸根离子或弱碱阳离子)跟水所电离出来的H+
或OH–结合生成弱电解质(弱酸、弱碱)的反应,叫做盐类的水解。
以CH3COONa和NH4Cl的水溶液的酸碱性为例:
1、概念:
盐
+
水
酸
+
碱
2.实质:破坏了水的电离平衡,促进了水的电离
3.条件:
盐可溶于水
盐可电离出弱酸阴离子或弱碱阳离子。
常见的弱酸根阴离子:CO32-
HCO3-
CH3COO-
S2-
HS-
F-
ClO-
SO32-
HSO3-等都能水解
常见的弱碱阳离子:Fe3+
Fe2+
Al3+
Cu2+
NH4+等都能水解
4.特征:水解过程是可逆的、微弱的。
盐类
实例
能否水解
引起水解的离子
对水的电离
平衡的影响
溶液的
酸碱性
强碱
弱酸盐
强酸
弱碱盐
强酸
强碱盐
弱酸弱碱盐
CH3COONH4
能
弱酸阴离子
弱碱阳离子
促进水的电离
不一定
NaAc
能
弱酸阴离子
促进水的电离
碱性
NH4Cl
能
弱碱阳离子
促进水的电离
酸性
NaCl
不能
无
无
中性
分析:
5、水解的规律:
⑴
谁__谁水解;无__不水解;
⑵
越__越水解;都__双水解;
⑶
谁__显谁性;同强显__性。
弱
弱
弱
弱
强
中
记住啦!
补充:
1.强酸弱碱盐水解,溶液显酸性
2.强碱弱酸盐水解,溶液显碱性
3.强酸强碱盐不水解,溶液通常显中性
4.弱酸弱碱盐强烈水解(强烈是相对的)
5.弱酸酸式盐,取决于酸式酸根离子的电离程度和水解程度的相对大小(与电离及水解平衡常数有关)
【巩固运用,反馈验收】
例1.分析下列盐能否发生水解反应?能发生水解反应的请指出该溶液的酸碱性。
(1)CuCl2
Fe2(SO4)3
NH4NO3
(2)KNO2
NaCN
NaF
(3)K2SO4
KCl
NaBr
例2.已知25℃时,测得某溶液的pH=3,则该溶液中由水电离出的H+浓度是多少?
课后思考:
①根据成盐酸碱的强弱给例1中的盐进行分类,并试着分析盐类水解的规律有哪些?
②已知CH3COONH4溶液呈中性,它没有水解吗?
③Al3+和HCO3-为什么不能在溶液中共存?
答案:①加酸:抑制水的电离
c(H+)水=c(OH-)=1x10-11mol/L
②加水解呈酸性的盐:促进水的电离
c(H+)水=c(H+)=1x10-3mol/L
扩展:25℃时,若测得某溶液的pH=9,该溶液中由水电离出的
OH-浓度又如何计算?
课题检测
2.下列溶液能使酚酞指示剂显红色的是(
)
A.K2CO3
B.NaHSO4
C.Na2SO4
D.FeCl3
A
1.下列离子在水溶液中不会发生水解的是(
)
A.NH4+
B.
SO42_
C.Al3+
D.F-
B
3.
室温下,下列溶液pH小于7的是(
)
A.溴化钾
B.硫酸铜
C.硫化钠
D.硝酸钡
B
巩固练习:
盐
+
水
酸
+
碱
四、盐类水解方程式的书写(说明):
先找“弱”离子。
一般水解程度小,水解产物少。因此,常用“
”
;不写“
==
”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐的水解,常写成一步完成。
弱离子
+
水
弱酸(or弱碱)
+
OH–
(
or
H+
)
NH4Cl
=
Cl-
+
NH4+
H2O
H+
+
OH-
+
NH3·H2O
NH4+
+
H2O
NH3·H2O
+
H+
c(H+)
>
c(OH-)
NH4Cl
+
H2O
NH3·H2O
+
HCl
平衡向右移动
离子方程式:
化学方程式:
CH3COONa
CH3COO-
H2O
H+
+
CH3COOH
平衡向右移动
Na+
+
OH-
+
所以导致溶液中[OH-]>[H+],溶液显碱性。
CH3COONa+H2O
CH3COOH+NaOH
化学方程式:
CH3COO-+H2O
CH3COOH+OH-
弱碱阳离子水解:
强碱阳离子、强酸酸根离子不发生水解,
溶液
弱酸酸根离子水解:
M++H2O
A-+H2O
中性
碱性
酸性
溶液显酸性
MOH+H+
溶液显碱性
HA+OH-
显中性
综上:
盐类水解的实质是生成弱酸或弱碱,使水的电离平衡被破坏而建立起新的平衡。
四、盐类水解方程式的书写(举例):
(一)一元弱酸强碱盐
如:CH3COONa、NaF
化学方程式:
离子方程式:
CH3COONa
+
H2O
CH3COOH
+
NaOH
CH3COO–
+
H2O
CH3COOH
+
OH–
化学方程式:
离子方程式:
NaF
+
H2O
HF
+
NaOH
F–
+
H2O
HF
+
OH–
(二)多元弱酸强碱盐
如:Na2CO3、
Na3PO4
离子方程式:
HCO3
–
+
H2O
H2CO3
+
OH
–
CO3
2–
+
H2O
HCO3
–
+
OH
–
(主)
(次)
Na2CO3溶液中含有的粒子?
?
2种分子,5种离子
(三)弱碱强酸盐水解
如:NH4Cl、CuSO4、AlCl3
水解的离子方程式:
NH4+
+
H2O
NH3·H2O
+
H+
Cu2+
+
2H2O
Cu(OH)2
+
2H+
Al
3+
+
3H2O
Al(OH)3
+
3H+
(四)弱酸弱碱盐水解
1、一般双水解,如:CH3COONH4
CH3COO–
+
NH4+
+
H2O
CH3COOH
+
NH3·H2O
(NH4)2CO3
NH4HCO3
2、“完全双水解”的,用“
==
”、“↑”、“↓”。
Al
3+
+
3HCO3–
Al(OH)3
+
3CO2
举例:请书写下列物质水解的方程式:Al2S3、Mg3N2
Al3+与AlO2–、HCO3–、CO32–、S2–、HS–、ClO–
Fe3+与AlO2–、HCO3–、CO32–
NH4+与SiO32–
Al2S3
+
6H2O
2Al(OH)3
+
3H2S
Mg3N2
+
6H2O
3Mg(OH)2
+
2NH3
以上为“完全双水解”,进行得非常充分,故用“==”连接,
且标上“
”、“
”符号。
常见“完全双水解”的弱离子组合——
如:
(NH4)2CO3
、NH4HCO3、
CH3COONH4
但有些弱酸弱碱盐是进行“一般双水解”。
(五)多元弱酸酸式酸根的水解与电离的区别:
⑴
NaHCO3
HCO3
–
+
H2O
H2CO3
+
OH
–
①
②
HCO3
–
+
H2O
CO32–
+
H3O
+
①
水解
②
电离
程度:
>
∴溶液呈
性
碱
⑵
NaHSO3
HSO3
–
+
H2O
H2SO3
+
OH
–
①
②
HSO3
–
+
H2O
SO32–
+
H3O
+
①
水解
②
电离
程度:
<
∴溶液呈
性
酸
⑶
NaH2PO4
溶液呈弱酸性
⑷
Na2HPO4
溶液呈弱碱性
1.
下列溶液pH小于7的是
A、氯化钾
B、硫酸铜
C、硫化钠
D、硝酸钡
2.
下列溶液能使酚酞指示剂显红色的是
A.
碳酸钾
B.
硫酸氢钠
C.
碳酸氢钠
D.
氯化铁
3.
下列离子在水溶液中不会发生水解的是
A.
NH4+
B.
SO42–
C.
Al3+
D.
F
–
4.?氯化铵溶液中离子浓度从大到小排列正确的是
A.
NH4+
、H
+
、OH
–、Cl
–
B.
Cl
–
、
NH4+
、H
+
、OH
–
C.
H
+、
Cl
–
、
NH4+
、OH
–
D.
Cl
–
、
NH4+
、
OH
–
、H
+
【课堂练习】
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
