2.2影响化学反应速率的因素 课件55页
文档属性
| 名称 | 2.2影响化学反应速率的因素 课件55页 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 15:09:02 | ||
图片预览









文档简介
(共55张PPT)
人教版
高二化学
选修四
第二节
影响化学反应速率的因素
第二章化学反应速率和化学平衡
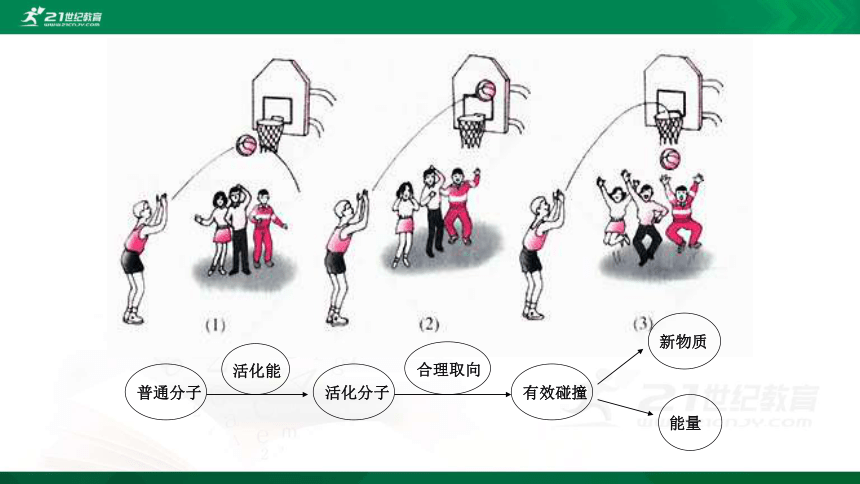
回忆:化学反应的碰撞理论:
(1)、化学反应的实质是:
旧的化学键断裂,新的化学键形成
(2)、化学反应发生的先决条件:
反应物分子相互接触和碰撞
注意:反应物分子之间的碰撞次数很多,但并不是每一次碰撞均可发生化学反应。
分子运动
相互碰撞
分子具有足够的能量
活化分子
有
合
适
的
取
向
有效碰撞
发生化学反应
化学反应发生的条件
化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。
一、化学反应速率模型-有效碰撞理论
1、有效碰撞
并不是每次碰撞都能发生化学反应,只有其中的部分气体的碰撞能发生化学反应
——有效碰撞
活化分子、正确取向
2、活化分子
具有较高能量,能够发生有效碰撞的分子
发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。
普通分子
活化能
活化分子
合理取向
有效碰撞
新物质
能量
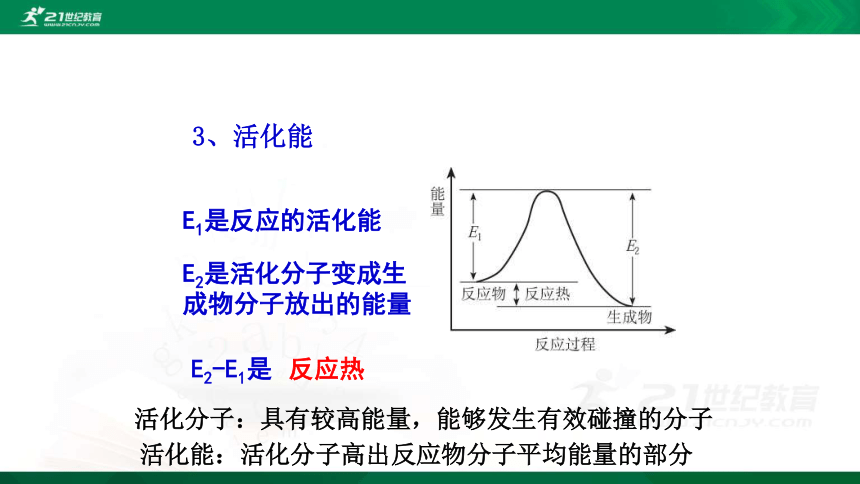
3、活化能
E1是反应的活化能
E2是活化分子变成生成物分子放出的能量
E2-E1是
反应热
活化分子:具有较高能量,能够发生有效碰撞的分子
活化能:活化分子高出反应物分子平均能量的部分
活化分子百分数:
(活化分子数/反应物分子数)×100%
化学反应速率主要取决于:
普通
分子
活化能
活化
分子
合理
取向碰撞
有效
碰撞
新物质
单位体积内活化分子数
有效碰撞的几率
反应历程
一个反应要发生需要经历哪些历程?
影响化学反应速率的因素有哪些呢?
Mg和Zn分别于相同浓度的盐酸反应会有什么现象?如何判断?
依据金属活动性判断也就是他们本身的性质---------内因
二、影响化学反应速率的因素
(一).内因:反应物本身的性质
如:Na、K与水的反应
外因也很重要,有哪些?他们是如何影响化学反应速率的?
(二)外因:①浓度:②压强:③温度:④催化剂:
⑤其他因素:光、颗粒大小、溶剂等。
想一想:
为什么铁丝在纯氧中燃烧火星四射,而在空气中不燃烧?
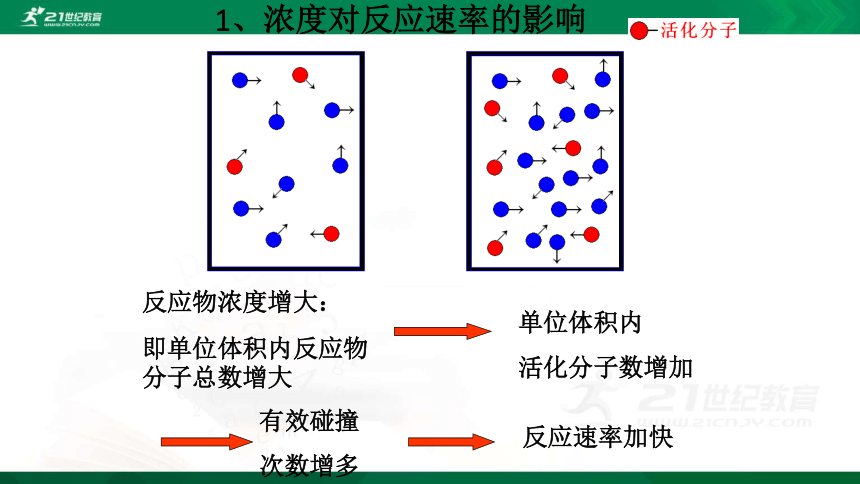
1、浓度对反应速率的影响
反应物浓度增大:
即单位体积内反应物分子总数增大
单位体积内
活化分子数增加
有效碰撞
次数增多
反应速率加快
浓度对化学反应速率的影响
【结论】其它条件不变,增大反应物浓度化学反应速率增
大,减小反应物浓度化学反应速率减小。
【原因】当反应物浓度增大时,单位体积内分子数增多,
活化分子数也相应增加,反应速率必然增大。
【注意】
a.反应物是纯液体或固体,其浓度是常数,因此改变它们的量反应速率不变。
b.
一般来说,固体反应物表面积越大,反应速率越大。
2、压强对反应速率的影响
结论:增大压强,相当于增大反应物浓度,反应速率加快。
压强对化学反应速率的影响
【原因】气体压强增大,体积减小,气体浓度增大,单位体积内分子数增多,活化分子数也相应增加,反应速率增大。
【结论】对于气体反应,其他条件
不变,压强增大化学反应
速率加快。
【注意】
a.
压强对固体和液体(溶液)间的反应无影响
b.
对于反应物和生成物都有气体的可逆反应,增大压强,正、逆反应速率都增大;减小压强,正、逆反应速率都减小
压强对于反应速率的影响是通过对浓度的影响实现的
P增大→C成比例增大,P减小→C成比例减小
压强只对于有气体参加的反应的速率有影响
理论延伸—解释压强对速率影响
改变压强的方法
减小体积
单位体积内活化分子数增多
有效碰撞几率增多
反应速率加快
有效增压
C活
v
理论延伸—解释压强对速率影响
改变压强的方法
体积不变,充入反应物气体
单位体积内活化分子数增多
有效碰撞几率增多
反应速率加快
C活
v
有效增压
改变压强的方法
理论延伸—解释压强对速率影响
体积不变,充入与反应无关的气体
单位体积内活化分子数不变
有效碰撞几率不变
反应速率不变
C活不变
v不变
无效增压
保持恒压的方法
理论延伸—解释压强对速率影响
充入与反应无关的气体保持恒压
单位体积内活化分子数不变
有效碰撞几率减小
反应速率不变
C活减小
v减小
假象“恒压”
对于气体有下列几种情况:
1、恒温时:增大压强→体积减少→C增大→反应速率增大
2、恒容时:
A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;
B、充入“无关气体”(如He)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变
3、恒压时:充入“无关气体”(如He)→引起体积增大,
→各反应物浓度减少→反应速率减慢。
3、温度对反应速率的影响
升高温度
活化分子的百分数
增大(分子运动速率加快,碰撞频率增加)
有效碰撞
次数增多
反应速率加快
温度对化学反应速率的影响
【原因】温度升高
(1)分子热运动加快,碰撞频率提高。
(2)分子获得能量,活化分子百分数提高。
【结论】其它条件不变,升高温度,化学反应速率
增大,降低温度,化学反应速率减小。
【注意】
(2)一般,温度每升高10℃,化学反应速率
增大2~4倍
(1)反应若是可逆反应,升高温度,正、
逆反应速率都加快,降低温度,正、逆
反应速率都减小。
4、
催化剂对化学反应速率的影响
【原因】加入催化剂改变反应的路径,降低反应
所需的活化能,反应体系中活化分子百
分数提高。
【结论】选用适当的催化剂是改变反应速率的常用
的方法之一。
(1)催化剂只能改变反应速率,不能改变反应方向。
【注意】
(2)对于可逆反应,同一催化剂能同等程度的改变
正、逆化学反应的速率。
(3)催化剂有一定的选择性和活化温度。
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。因而使反应速率加快。
C活
有效碰撞的几率
v
生成物总能量
活化分子具有能量
反应物总能量
能量
有效条件
能使活化能减小的外界条件有________________
能改变活化分子百分数增大的外界条件有______________
一定能改变化学反应速率的外界条件有______________
只有催化剂
温度和催化剂
温度和催化剂
讨论:
结论:
其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。
各条件对速率的影响大小是:
催化剂
>>温度>浓度=压强(体积变化引起的)。
各种影响都有其局限性,要针对具体反应具体分析。
总结:
影响因素
影响化学反应速率的因素
1、内因(主要)
物质本身的结构和性质
2、外因
浓度
压强
温度
催化剂
其它
小结
小结:影响化学反应速率的外因
影响
外因
单位体积内
有效碰撞次数
化学反应速率
分子总数
活化分子数
活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
比较下列情况混合时,开始时反应速率的大小。
A.10mL2mol/LNa2S2O3和10mL1mol/LHCl
B.10mL4mol/LNa2S2O3和30mL2mol/LHCl
C.10mL1mol/LNa2S2O3和30mL0.5mol/LHCl
【解析】浓度是指反应时(混合物中)的浓度,而不是所取试剂的浓度。故A=B>C。
练习巩固
选择:
(1)增大反应物的浓度使反应速率加快的主要原因(
)
(2)对于有气体参与的体系,压缩体积增大压强使反应速率加快的主要原因是(
)
(3)升高温度使反应速率加快的主要原因是(
)
(4)使用催化剂使反应速率加快的主要原因是(
)
A.活化分子百分数不变,但提高单位体积内活化分
子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
练习巩固
设C+CO2
2CO(正反应吸热)反应速率为v1;
N2+3H2
2NH3(正反应放热)反应速率为v2。
对于前述反应,当温度升高时,
V
1和V
2变化情况为(
)
A.同时增大
B.
同时减小
C.V
1减少,
V
2增大
D.
V
1增大,
V
2减小
A
反应C(s)+H2O(g)
CO(g)+H2(g)在一容积可变的
闭容器中进行,分析下列条件改变,反应速率如何改变?
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变充入N2
D.保持压强不变,充入N2
E.保持体积不变,充入CO
F.保持体积不变,充入H2O
不变
不变
第二章化学反应速率和化学平衡
第一节
化学反应速率
举出几例你在生活中所遇到与化学反应快慢有关的事例。
溶洞的形成
牛奶变质
你知道下列化学变化进行得快还是慢?
爆炸
有些反应可以瞬间完成,例如酸碱中和反应、炸弹爆炸
有些反应进行得很慢,例如牛奶变质、铁桥生锈等
溶洞的形成需要几百年甚至上千年
我们应如何衡量化学反应的快慢呢?
常见的描述快慢的例子:
1.运动的快慢通常用速度描述
2.速度变化的快慢通常用加速度描述
化学反应速率
一、化学反应速率
1、化学反应速率的含义:
化学反应速率是用来衡量化学反应进行快慢的尺度。它与两个因素有关:一个是反应的时间;另一个是反应物或生成物的浓度。反应物浓度随着反应的进行而不断减小,生成物浓度随着反应的不断进行而增大。
2、化学反应速率的表示:
化学反应速率用单位时间(如每秒,每分,每小时)内反应物浓度的减小或生成物浓度的增大来表示。
某一物质的化学反应速率的计算式为:
v
=
——
试根据以上计算式推出v的单位是什么?
⊿c
⊿
t
△c
3.
数学表达式
v
=
———
=
———
△
t
△n/V
△
t
3.
数学表达式
v
=
———
=
———
△
t
△n/V
△
t
4.
单位:mol/(L·min)
或
mol·L-1·min-1
mol/(L·s)
或
mol·L-1·s-1
null
1.某反应的反应物浓度在5
min内由6
mol/L变成了2
mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率?
ν=
C
t
=
5min
6mol/L
-2
mol/L
=0.8
mol/(L·min)
解:
答:用该物质表示的该反应在这段时间内的平
均反应速率为0.8
mol/(L·min)
练习一
1、指的是某一时间段内平均反应速率,只为正值,不是瞬时速率
即v>0
。
3、要注意是单位时间内物质的量浓度的变化量,而不是物质的量的变化量。
2、表示气体或溶液反应速率,不能表示固体或纯液体的反应速率。
5、比较同一个反应的速率大小时,应选用同一种物质,单位要相同。
4、同一化学反应中各物质的反应速率之比等于反应方程式中化学计量数之比。
注意:
6、0-2s内,c物质增加2mol,求v。
8、2SO2(g)+O2=2SO3(g)
2v(SO2)=v(O2)
7、2s时,v=……
易错点:“串比”
瞬时速率不可求。
易错点:忽略体积。
⑤求经历的时间
△t
△
C
ひ
——
=
②求浓度的变化
△t
△
C
ひ·
=
③求物质的量的变化
△
n
V
=
ひ·
△t·
④根据不同物质的反应速率的大小判断反应进行的快慢。
有关化学反应速率计算类型:
①求某一反应物或生成物的反应速率
ひ=△C/△t
⑥
求化学反应方程式
①求某一反应物或生成物的反应速率
V=△C/△t
[练习1]反应A(g)
+
3B(g)=2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol,有关反应速率正确的是(
)
A、
V(A)
=
0.005mol/(L·s)
B、
V(C)
=
0.002mol/(L·s)
C、
V(B)
=
V(A)/3
D、
V(A)
=
0.001mol/(L·s)
A
[练习3]
反应A+3B==2C+2D在四种不同的情况下
的反应速率分别为:
①ひ(A)=0.15mol/(L·S)
②ひ(B)=
0.6mol/(L·S)
③ひ(C)=
0.4mol/(L·S)
④ひ(D)=
0.45mol/(L·S)
该反应在四种情况下的快慢顺序为___________.
④>③=②>①
分析
:
1、根据反应速率之比等于物质的计量数之比来判断。
2、将不同物质表示的反应速率换算成同一物质表示的反应速率来判断。
④根据不同物质的反应速率的大小判断反应进行的快慢
返回
对于反应:Fe+2HCl=FeCl2+H2↑,已知5min内v(FeCl2)=1mol/(L·s),则下列说法中正确的是
(
)
A、v(Fe)=1mol/(L·s)
B、v(HCl)=2mol/(L·s)
C、v(H2)=1mol/(L·s)
D、以上均不对
练一练
固体/纯液体无浓度可言,不可用它们表示反应速率。
BC
⑤求经历的时间
△t
△
C
ひ
——
=
[练习4]在N2
+
3H2
===
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol·L-1.在此时间内用H2表示的平均速率为0.45mol
·(L·s)-1,则此段时间值为_____________.
2s
高温高压
催化剂
[练习6]
在一定条件下,mA
+
nB
=
pC的反应中,各物质的化学反应速率为v(A)=amol/(L·s),
v(B)=0.5amol/(L·s),v(C)=amol/(L·s),则该反应的化学方程式为:______________________.
2A
+
B
=
2C
⑥
求化学反应方程式
各物质的速率之比等于方程式计量数之比
实验步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中
加入稀硫酸
4、使稀硫酸滴入锥形瓶与锌粒反应
5、记录8.7mLH2所用的时间
二、化学反应速率的实验测定
结论:
4mol/L的硫酸与锌反应比1mol/L的硫酸与锌反应快。
秒表
二、化学反应速率的测定
分液漏斗不能改为长颈漏斗
二、化学反应速率的测定
1、如何检查装置的气密性?
液面差法:连接好装置,从顶部漏斗
口注水,当漏斗下端被水封闭后再注水,
水面不下降,表明装置气密性好;如果
水面下降,表明装置气密性差。
2、稀硫酸怎么滴加?
使稀硫酸快速滴入锥形瓶与锌粒反应,
滴完后迅速关闭分液漏斗活塞。
3、你还能根据反应速率相关的哪些变化来测定该反应的反应速率?
氢离子浓度,锌粒质量等等
1、m
A
+
n
B
p
C的反应中,m、n、p为各物质的计量数。现测得C每分钟增加a
mol/L,B每分钟减少1.5a
mol/L,A每分钟减少0.5a
mol/L,则m:n:p为
A、2:3:2
B、2:3:3
C、1:3:2
D、3:1:2
2、在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6
mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是
A、0.02
mol/(L?min)
B、1.8mol/(L?min)
C、1.2
mol/(L?min)
D、0.18
mol/(L?min)
3.(03年上海高考)可逆反应N2+3H2
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A、3v正(N2)=v正(H2)
B、v正(N2)=v逆(NH3)
C、2v正(H2)=3v逆(NH3D、v正(N2)=3v逆(H2)
课堂练习
课堂小结
1、化学反应速率:
化学反应速率是用来衡量化学反应进行快慢的一个物理量。
2、化学反应速率常用的单位:
mol/(L·min)或mol/(L·s)
3、化学反应速率计算公式:
4、化学反应速率与反应式中对应剂量数的关系:
化学反应速率之比等于它们的剂量数之比
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
人教版
高二化学
选修四
第二节
影响化学反应速率的因素
第二章化学反应速率和化学平衡
回忆:化学反应的碰撞理论:
(1)、化学反应的实质是:
旧的化学键断裂,新的化学键形成
(2)、化学反应发生的先决条件:
反应物分子相互接触和碰撞
注意:反应物分子之间的碰撞次数很多,但并不是每一次碰撞均可发生化学反应。
分子运动
相互碰撞
分子具有足够的能量
活化分子
有
合
适
的
取
向
有效碰撞
发生化学反应
化学反应发生的条件
化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。
一、化学反应速率模型-有效碰撞理论
1、有效碰撞
并不是每次碰撞都能发生化学反应,只有其中的部分气体的碰撞能发生化学反应
——有效碰撞
活化分子、正确取向
2、活化分子
具有较高能量,能够发生有效碰撞的分子
发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。
普通分子
活化能
活化分子
合理取向
有效碰撞
新物质
能量
3、活化能
E1是反应的活化能
E2是活化分子变成生成物分子放出的能量
E2-E1是
反应热
活化分子:具有较高能量,能够发生有效碰撞的分子
活化能:活化分子高出反应物分子平均能量的部分
活化分子百分数:
(活化分子数/反应物分子数)×100%
化学反应速率主要取决于:
普通
分子
活化能
活化
分子
合理
取向碰撞
有效
碰撞
新物质
单位体积内活化分子数
有效碰撞的几率
反应历程
一个反应要发生需要经历哪些历程?
影响化学反应速率的因素有哪些呢?
Mg和Zn分别于相同浓度的盐酸反应会有什么现象?如何判断?
依据金属活动性判断也就是他们本身的性质---------内因
二、影响化学反应速率的因素
(一).内因:反应物本身的性质
如:Na、K与水的反应
外因也很重要,有哪些?他们是如何影响化学反应速率的?
(二)外因:①浓度:②压强:③温度:④催化剂:
⑤其他因素:光、颗粒大小、溶剂等。
想一想:
为什么铁丝在纯氧中燃烧火星四射,而在空气中不燃烧?
1、浓度对反应速率的影响
反应物浓度增大:
即单位体积内反应物分子总数增大
单位体积内
活化分子数增加
有效碰撞
次数增多
反应速率加快
浓度对化学反应速率的影响
【结论】其它条件不变,增大反应物浓度化学反应速率增
大,减小反应物浓度化学反应速率减小。
【原因】当反应物浓度增大时,单位体积内分子数增多,
活化分子数也相应增加,反应速率必然增大。
【注意】
a.反应物是纯液体或固体,其浓度是常数,因此改变它们的量反应速率不变。
b.
一般来说,固体反应物表面积越大,反应速率越大。
2、压强对反应速率的影响
结论:增大压强,相当于增大反应物浓度,反应速率加快。
压强对化学反应速率的影响
【原因】气体压强增大,体积减小,气体浓度增大,单位体积内分子数增多,活化分子数也相应增加,反应速率增大。
【结论】对于气体反应,其他条件
不变,压强增大化学反应
速率加快。
【注意】
a.
压强对固体和液体(溶液)间的反应无影响
b.
对于反应物和生成物都有气体的可逆反应,增大压强,正、逆反应速率都增大;减小压强,正、逆反应速率都减小
压强对于反应速率的影响是通过对浓度的影响实现的
P增大→C成比例增大,P减小→C成比例减小
压强只对于有气体参加的反应的速率有影响
理论延伸—解释压强对速率影响
改变压强的方法
减小体积
单位体积内活化分子数增多
有效碰撞几率增多
反应速率加快
有效增压
C活
v
理论延伸—解释压强对速率影响
改变压强的方法
体积不变,充入反应物气体
单位体积内活化分子数增多
有效碰撞几率增多
反应速率加快
C活
v
有效增压
改变压强的方法
理论延伸—解释压强对速率影响
体积不变,充入与反应无关的气体
单位体积内活化分子数不变
有效碰撞几率不变
反应速率不变
C活不变
v不变
无效增压
保持恒压的方法
理论延伸—解释压强对速率影响
充入与反应无关的气体保持恒压
单位体积内活化分子数不变
有效碰撞几率减小
反应速率不变
C活减小
v减小
假象“恒压”
对于气体有下列几种情况:
1、恒温时:增大压强→体积减少→C增大→反应速率增大
2、恒容时:
A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;
B、充入“无关气体”(如He)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变
3、恒压时:充入“无关气体”(如He)→引起体积增大,
→各反应物浓度减少→反应速率减慢。
3、温度对反应速率的影响
升高温度
活化分子的百分数
增大(分子运动速率加快,碰撞频率增加)
有效碰撞
次数增多
反应速率加快
温度对化学反应速率的影响
【原因】温度升高
(1)分子热运动加快,碰撞频率提高。
(2)分子获得能量,活化分子百分数提高。
【结论】其它条件不变,升高温度,化学反应速率
增大,降低温度,化学反应速率减小。
【注意】
(2)一般,温度每升高10℃,化学反应速率
增大2~4倍
(1)反应若是可逆反应,升高温度,正、
逆反应速率都加快,降低温度,正、逆
反应速率都减小。
4、
催化剂对化学反应速率的影响
【原因】加入催化剂改变反应的路径,降低反应
所需的活化能,反应体系中活化分子百
分数提高。
【结论】选用适当的催化剂是改变反应速率的常用
的方法之一。
(1)催化剂只能改变反应速率,不能改变反应方向。
【注意】
(2)对于可逆反应,同一催化剂能同等程度的改变
正、逆化学反应的速率。
(3)催化剂有一定的选择性和活化温度。
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。因而使反应速率加快。
C活
有效碰撞的几率
v
生成物总能量
活化分子具有能量
反应物总能量
能量
有效条件
能使活化能减小的外界条件有________________
能改变活化分子百分数增大的外界条件有______________
一定能改变化学反应速率的外界条件有______________
只有催化剂
温度和催化剂
温度和催化剂
讨论:
结论:
其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。
各条件对速率的影响大小是:
催化剂
>>温度>浓度=压强(体积变化引起的)。
各种影响都有其局限性,要针对具体反应具体分析。
总结:
影响因素
影响化学反应速率的因素
1、内因(主要)
物质本身的结构和性质
2、外因
浓度
压强
温度
催化剂
其它
小结
小结:影响化学反应速率的外因
影响
外因
单位体积内
有效碰撞次数
化学反应速率
分子总数
活化分子数
活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
比较下列情况混合时,开始时反应速率的大小。
A.10mL2mol/LNa2S2O3和10mL1mol/LHCl
B.10mL4mol/LNa2S2O3和30mL2mol/LHCl
C.10mL1mol/LNa2S2O3和30mL0.5mol/LHCl
【解析】浓度是指反应时(混合物中)的浓度,而不是所取试剂的浓度。故A=B>C。
练习巩固
选择:
(1)增大反应物的浓度使反应速率加快的主要原因(
)
(2)对于有气体参与的体系,压缩体积增大压强使反应速率加快的主要原因是(
)
(3)升高温度使反应速率加快的主要原因是(
)
(4)使用催化剂使反应速率加快的主要原因是(
)
A.活化分子百分数不变,但提高单位体积内活化分
子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
练习巩固
设C+CO2
2CO(正反应吸热)反应速率为v1;
N2+3H2
2NH3(正反应放热)反应速率为v2。
对于前述反应,当温度升高时,
V
1和V
2变化情况为(
)
A.同时增大
B.
同时减小
C.V
1减少,
V
2增大
D.
V
1增大,
V
2减小
A
反应C(s)+H2O(g)
CO(g)+H2(g)在一容积可变的
闭容器中进行,分析下列条件改变,反应速率如何改变?
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变充入N2
D.保持压强不变,充入N2
E.保持体积不变,充入CO
F.保持体积不变,充入H2O
不变
不变
第二章化学反应速率和化学平衡
第一节
化学反应速率
举出几例你在生活中所遇到与化学反应快慢有关的事例。
溶洞的形成
牛奶变质
你知道下列化学变化进行得快还是慢?
爆炸
有些反应可以瞬间完成,例如酸碱中和反应、炸弹爆炸
有些反应进行得很慢,例如牛奶变质、铁桥生锈等
溶洞的形成需要几百年甚至上千年
我们应如何衡量化学反应的快慢呢?
常见的描述快慢的例子:
1.运动的快慢通常用速度描述
2.速度变化的快慢通常用加速度描述
化学反应速率
一、化学反应速率
1、化学反应速率的含义:
化学反应速率是用来衡量化学反应进行快慢的尺度。它与两个因素有关:一个是反应的时间;另一个是反应物或生成物的浓度。反应物浓度随着反应的进行而不断减小,生成物浓度随着反应的不断进行而增大。
2、化学反应速率的表示:
化学反应速率用单位时间(如每秒,每分,每小时)内反应物浓度的减小或生成物浓度的增大来表示。
某一物质的化学反应速率的计算式为:
v
=
——
试根据以上计算式推出v的单位是什么?
⊿c
⊿
t
△c
3.
数学表达式
v
=
———
=
———
△
t
△n/V
△
t
3.
数学表达式
v
=
———
=
———
△
t
△n/V
△
t
4.
单位:mol/(L·min)
或
mol·L-1·min-1
mol/(L·s)
或
mol·L-1·s-1
null
1.某反应的反应物浓度在5
min内由6
mol/L变成了2
mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率?
ν=
C
t
=
5min
6mol/L
-2
mol/L
=0.8
mol/(L·min)
解:
答:用该物质表示的该反应在这段时间内的平
均反应速率为0.8
mol/(L·min)
练习一
1、指的是某一时间段内平均反应速率,只为正值,不是瞬时速率
即v>0
。
3、要注意是单位时间内物质的量浓度的变化量,而不是物质的量的变化量。
2、表示气体或溶液反应速率,不能表示固体或纯液体的反应速率。
5、比较同一个反应的速率大小时,应选用同一种物质,单位要相同。
4、同一化学反应中各物质的反应速率之比等于反应方程式中化学计量数之比。
注意:
6、0-2s内,c物质增加2mol,求v。
8、2SO2(g)+O2=2SO3(g)
2v(SO2)=v(O2)
7、2s时,v=……
易错点:“串比”
瞬时速率不可求。
易错点:忽略体积。
⑤求经历的时间
△t
△
C
ひ
——
=
②求浓度的变化
△t
△
C
ひ·
=
③求物质的量的变化
△
n
V
=
ひ·
△t·
④根据不同物质的反应速率的大小判断反应进行的快慢。
有关化学反应速率计算类型:
①求某一反应物或生成物的反应速率
ひ=△C/△t
⑥
求化学反应方程式
①求某一反应物或生成物的反应速率
V=△C/△t
[练习1]反应A(g)
+
3B(g)=2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol,有关反应速率正确的是(
)
A、
V(A)
=
0.005mol/(L·s)
B、
V(C)
=
0.002mol/(L·s)
C、
V(B)
=
V(A)/3
D、
V(A)
=
0.001mol/(L·s)
A
[练习3]
反应A+3B==2C+2D在四种不同的情况下
的反应速率分别为:
①ひ(A)=0.15mol/(L·S)
②ひ(B)=
0.6mol/(L·S)
③ひ(C)=
0.4mol/(L·S)
④ひ(D)=
0.45mol/(L·S)
该反应在四种情况下的快慢顺序为___________.
④>③=②>①
分析
:
1、根据反应速率之比等于物质的计量数之比来判断。
2、将不同物质表示的反应速率换算成同一物质表示的反应速率来判断。
④根据不同物质的反应速率的大小判断反应进行的快慢
返回
对于反应:Fe+2HCl=FeCl2+H2↑,已知5min内v(FeCl2)=1mol/(L·s),则下列说法中正确的是
(
)
A、v(Fe)=1mol/(L·s)
B、v(HCl)=2mol/(L·s)
C、v(H2)=1mol/(L·s)
D、以上均不对
练一练
固体/纯液体无浓度可言,不可用它们表示反应速率。
BC
⑤求经历的时间
△t
△
C
ひ
——
=
[练习4]在N2
+
3H2
===
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol·L-1.在此时间内用H2表示的平均速率为0.45mol
·(L·s)-1,则此段时间值为_____________.
2s
高温高压
催化剂
[练习6]
在一定条件下,mA
+
nB
=
pC的反应中,各物质的化学反应速率为v(A)=amol/(L·s),
v(B)=0.5amol/(L·s),v(C)=amol/(L·s),则该反应的化学方程式为:______________________.
2A
+
B
=
2C
⑥
求化学反应方程式
各物质的速率之比等于方程式计量数之比
实验步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中
加入稀硫酸
4、使稀硫酸滴入锥形瓶与锌粒反应
5、记录8.7mLH2所用的时间
二、化学反应速率的实验测定
结论:
4mol/L的硫酸与锌反应比1mol/L的硫酸与锌反应快。
秒表
二、化学反应速率的测定
分液漏斗不能改为长颈漏斗
二、化学反应速率的测定
1、如何检查装置的气密性?
液面差法:连接好装置,从顶部漏斗
口注水,当漏斗下端被水封闭后再注水,
水面不下降,表明装置气密性好;如果
水面下降,表明装置气密性差。
2、稀硫酸怎么滴加?
使稀硫酸快速滴入锥形瓶与锌粒反应,
滴完后迅速关闭分液漏斗活塞。
3、你还能根据反应速率相关的哪些变化来测定该反应的反应速率?
氢离子浓度,锌粒质量等等
1、m
A
+
n
B
p
C的反应中,m、n、p为各物质的计量数。现测得C每分钟增加a
mol/L,B每分钟减少1.5a
mol/L,A每分钟减少0.5a
mol/L,则m:n:p为
A、2:3:2
B、2:3:3
C、1:3:2
D、3:1:2
2、在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6
mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是
A、0.02
mol/(L?min)
B、1.8mol/(L?min)
C、1.2
mol/(L?min)
D、0.18
mol/(L?min)
3.(03年上海高考)可逆反应N2+3H2
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A、3v正(N2)=v正(H2)
B、v正(N2)=v逆(NH3)
C、2v正(H2)=3v逆(NH3D、v正(N2)=3v逆(H2)
课堂练习
课堂小结
1、化学反应速率:
化学反应速率是用来衡量化学反应进行快慢的一个物理量。
2、化学反应速率常用的单位:
mol/(L·min)或mol/(L·s)
3、化学反应速率计算公式:
4、化学反应速率与反应式中对应剂量数的关系:
化学反应速率之比等于它们的剂量数之比
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
