二氧 化硫
图片预览








文档简介
(共25张PPT)
二 氧 化 硫
宜都二中 李 星
森林
雕像
鱼
左侧图片摄于1908年
右侧图片摄于1968年
乐山大佛遭受酸雨腐蚀
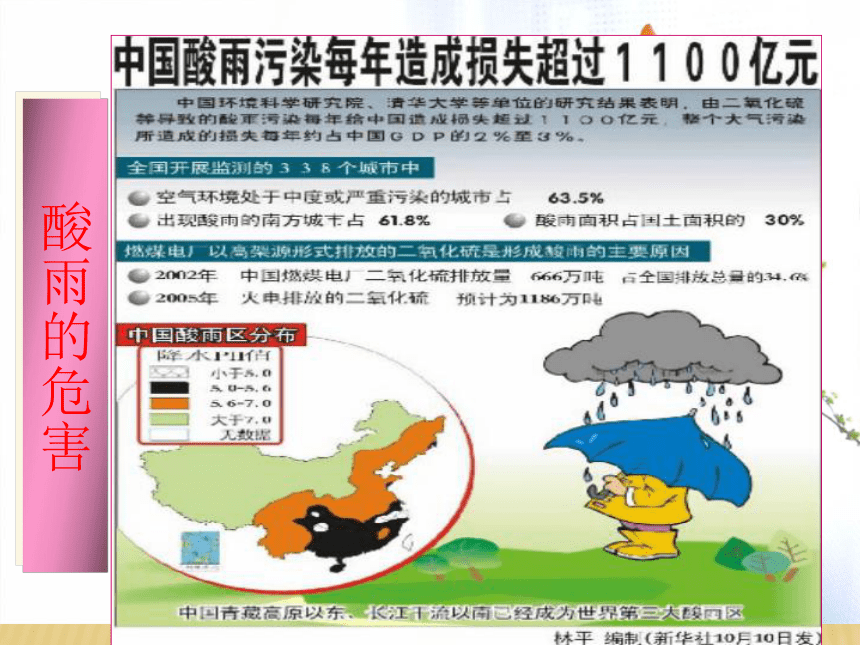
酸雨的危害
思考与讨论:
你在日常生活中与
二氧 化硫打过交道吗
无色、有刺激性气味、有毒气体、密度比空气大、易液化、
易溶于水(1:40)
实 验
二氧化硫的物理性质
颜色、状态、气味、是否有毒、溶沸点、密度、溶解性
实验结束时,在水下用胶塞塞紧试管口,避免实验功亏一篑
方法一:
向装有二氧化硫气体的塑料瓶中用注射器注入少量的水,振荡,观察现象并分析得出结论
方法二:
利用物质分类的思想,同类物质化学性质应相似,二氧化硫和二氧化碳都属于哪一类氧化物,猜测二氧化硫应能和哪几类物质发生反应?
推测:
具有酸性氧化物的通性
1、SO2与碱反应
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + Ca(OH)2 = CaSO3 + H2O
二氧化硫的化学性质
白色沉淀
提供的实验用品
SO2水溶液、紫色石蕊试液、蓝色石蕊试纸 pH试纸、玻璃棒、试管
讨论
怎样操作?
根据什么现象判断?
SO2和水发生化学反应了吗
2、SO2与水反应
可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
SO2+H2O H2SO3
二氧化硫的化学性质
判断下列反应哪一组不属于可逆反应?
A.2NO2 N2O4
B.2H2+O2 2H2O
C.SO2+ H2O H2SO3
D.CO2+ H2O H2CO3
试一试
B
电解
点燃
(亚硫酸)
SO2与 H2O反应生成H2SO3 , H2SO3 在相同条件下又分解得到SO2与 H2O
可逆号
氧化钙能与二氧化硫反应
SO2 + CaO = CaSO3
这体现了二氧化硫的什么性质?
3、 SO2与与碱性氧化物反应
SO2 + CaO = CaSO3
请你分析
酸雨治理办法之一:
火电厂在煤中混入一定比例的
生石灰粉, 可减少烟气中SO2的含量
二氧化硫的化学性质
能否用紫色石蕊或者澄清石灰水来区分SO2和CO2 为什么
请你分析
SO2 + Ca(OH)2 = CaSO3 + H2O
白色沉淀
向二氧化硫水溶液中滴1-2滴品红溶液,观察现象;加热,再观察现象。
探 究 3
现象:品红溶液红色褪去,加热后,红色又恢复
结论:二氧化硫具有漂白性,但漂 白作用是暂时性的
二氧化硫的特性
氯 水 二 氧 化 硫
原 理
反 应
实 质
效 果
范 围
氯水和二氧化硫漂白性的比较
氯水中HClO将有色物质氧化成无色物质
氧化还原反应
永久性
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
SO2溶于水与有色物质直接结合生成不稳定的无色物质
非氧化还原反应
暂时性
漂白某些有色物质,不能使紫色石蕊试液褪色
(石蕊变红)
纸张、草帽用久后会变黄,你现在知道这是用什么漂白的吗?
思 考
北京市场黄白两种银耳对比 中央电视台《生活》栏目
生活小常识:怎样选购银耳
通过“一看二闻三尝”来选购银耳:看色形:正常银耳呈乳白或米黄色,雪白的银耳不要买;闻香气:正常银耳散发清香,若有刺激性气味应慎购;尝味道:有辛辣味不要购买
二氧化硫对食品有漂白和防腐作用,使用二氧化硫能够达到使产品外观光亮、洁白的效果,是食品加工中常用的漂白剂和防腐剂,但必须严格按照国家有关范围和标准使用,否则,会影响人体健康。
SO2
+4
S
H2SO4
0
+6
加氧化剂
如O2、Cl2、Na2O2、KMnO4等
具有还原性和氧化性,以还原性为主
氧化性
还原性
二氧化硫的化学性质
2SO2+O2 2SO3
催化剂
Δ
工业制
硫酸:
SO3+H2O=H2SO4
探 究 4
分析SO2中S的化合价,从氧化还原的角度猜测SO2的化学性质
SO2的水溶液
酸性高锰酸钾溶液
验证二氧化硫有还原性
SO2的主要用途
制造硫酸
杀菌消毒
漂白纸浆、
毛、丝、
草编制品
SO2可以用来杀菌、抗氧化
1、下列关于SO2的说法中,不正确的一项是( )
A、SO2是硫及某些含硫化合物在空气中燃烧的产物
B、SO2有漂白作用,也有杀菌作用
C、SO2溶于水后生成H2SO4
D、 SO2是一种大气污染物
2、以下气体能用NaOH固体干燥的是( )
A.NH3 B.SO2 C.CO2 D.HCl?
C
A
练一练
3、下列物质均有漂白作用,其漂白原理相同的是( )
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭
A.① ④ B.①③ C.②③ D.①②
D
6、检验SO2气体中是否存在CO2气体,应采用的方法是( )
A、 通过澄清石灰水
B、通过氢样氧化钠溶液
C、先通过足量酸性高锰酸钾溶液,再通过石灰水
D、通过品红溶液
C
练一练
5、将等物质的量的SO2、Cl2通入水中,所得溶液具有( )
(Cl2+SO2+2H2O = H2SO4+2HCl)
A、 中性、 漂白性 B 、酸性、 漂白性
C 、只有漂白性 D、 只有酸性
D
4、能用于鉴别SO2和CO2溶液是( )
A、澄清石灰水 B、品红溶液
C、紫色石蕊试液 D、氯化钡溶液
B
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.62 4.56 4.55 4.55
7、我国农业因遭受酸雨而造成每年损失高达十五多亿元。为了有效控制酸雨,
目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份.每隔一段时间测定该雨水样品的pH,所得数据如下表:
分析数据,完成下列问题:
(已知Cl2+SO2+2H2O = H2SO4+2HCl ,
①雨水样品的pH变化的原因是(用化学反应方程式表示)_____________________________。
②如果将刚取样的上述雨水和自来水相混合,pH将变___(填“大”或“小”)。
(2)你认为减少酸雨产生的途径可采用的措施是_____。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在20世纪的60—70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取,简述其理由。
H2SO3能被氧气氧化)
测定时间 0 1 2 3 4
雨水PH 4.73 4.62 4.56 4.55 4.55
2H2SO3+O2=2H2SO4
小
C
二氧化硫
酸性氧化物的通性
(物质分类的角度)
还原性、氧化性
(氧化还原的角度)
漂白性
(特性的角度)
酸雨的部分治理
方法、
二氧化硫在生活中
的作用
学习的方法
从生活到化学
物理性质——
水中溶解性等
从化学到生活
小结
祝同学们学业有成
一帆风顺
二 氧 化 硫
宜都二中 李 星
森林
雕像
鱼
左侧图片摄于1908年
右侧图片摄于1968年
乐山大佛遭受酸雨腐蚀
酸雨的危害
思考与讨论:
你在日常生活中与
二氧 化硫打过交道吗
无色、有刺激性气味、有毒气体、密度比空气大、易液化、
易溶于水(1:40)
实 验
二氧化硫的物理性质
颜色、状态、气味、是否有毒、溶沸点、密度、溶解性
实验结束时,在水下用胶塞塞紧试管口,避免实验功亏一篑
方法一:
向装有二氧化硫气体的塑料瓶中用注射器注入少量的水,振荡,观察现象并分析得出结论
方法二:
利用物质分类的思想,同类物质化学性质应相似,二氧化硫和二氧化碳都属于哪一类氧化物,猜测二氧化硫应能和哪几类物质发生反应?
推测:
具有酸性氧化物的通性
1、SO2与碱反应
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + Ca(OH)2 = CaSO3 + H2O
二氧化硫的化学性质
白色沉淀
提供的实验用品
SO2水溶液、紫色石蕊试液、蓝色石蕊试纸 pH试纸、玻璃棒、试管
讨论
怎样操作?
根据什么现象判断?
SO2和水发生化学反应了吗
2、SO2与水反应
可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
SO2+H2O H2SO3
二氧化硫的化学性质
判断下列反应哪一组不属于可逆反应?
A.2NO2 N2O4
B.2H2+O2 2H2O
C.SO2+ H2O H2SO3
D.CO2+ H2O H2CO3
试一试
B
电解
点燃
(亚硫酸)
SO2与 H2O反应生成H2SO3 , H2SO3 在相同条件下又分解得到SO2与 H2O
可逆号
氧化钙能与二氧化硫反应
SO2 + CaO = CaSO3
这体现了二氧化硫的什么性质?
3、 SO2与与碱性氧化物反应
SO2 + CaO = CaSO3
请你分析
酸雨治理办法之一:
火电厂在煤中混入一定比例的
生石灰粉, 可减少烟气中SO2的含量
二氧化硫的化学性质
能否用紫色石蕊或者澄清石灰水来区分SO2和CO2 为什么
请你分析
SO2 + Ca(OH)2 = CaSO3 + H2O
白色沉淀
向二氧化硫水溶液中滴1-2滴品红溶液,观察现象;加热,再观察现象。
探 究 3
现象:品红溶液红色褪去,加热后,红色又恢复
结论:二氧化硫具有漂白性,但漂 白作用是暂时性的
二氧化硫的特性
氯 水 二 氧 化 硫
原 理
反 应
实 质
效 果
范 围
氯水和二氧化硫漂白性的比较
氯水中HClO将有色物质氧化成无色物质
氧化还原反应
永久性
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
SO2溶于水与有色物质直接结合生成不稳定的无色物质
非氧化还原反应
暂时性
漂白某些有色物质,不能使紫色石蕊试液褪色
(石蕊变红)
纸张、草帽用久后会变黄,你现在知道这是用什么漂白的吗?
思 考
北京市场黄白两种银耳对比 中央电视台《生活》栏目
生活小常识:怎样选购银耳
通过“一看二闻三尝”来选购银耳:看色形:正常银耳呈乳白或米黄色,雪白的银耳不要买;闻香气:正常银耳散发清香,若有刺激性气味应慎购;尝味道:有辛辣味不要购买
二氧化硫对食品有漂白和防腐作用,使用二氧化硫能够达到使产品外观光亮、洁白的效果,是食品加工中常用的漂白剂和防腐剂,但必须严格按照国家有关范围和标准使用,否则,会影响人体健康。
SO2
+4
S
H2SO4
0
+6
加氧化剂
如O2、Cl2、Na2O2、KMnO4等
具有还原性和氧化性,以还原性为主
氧化性
还原性
二氧化硫的化学性质
2SO2+O2 2SO3
催化剂
Δ
工业制
硫酸:
SO3+H2O=H2SO4
探 究 4
分析SO2中S的化合价,从氧化还原的角度猜测SO2的化学性质
SO2的水溶液
酸性高锰酸钾溶液
验证二氧化硫有还原性
SO2的主要用途
制造硫酸
杀菌消毒
漂白纸浆、
毛、丝、
草编制品
SO2可以用来杀菌、抗氧化
1、下列关于SO2的说法中,不正确的一项是( )
A、SO2是硫及某些含硫化合物在空气中燃烧的产物
B、SO2有漂白作用,也有杀菌作用
C、SO2溶于水后生成H2SO4
D、 SO2是一种大气污染物
2、以下气体能用NaOH固体干燥的是( )
A.NH3 B.SO2 C.CO2 D.HCl?
C
A
练一练
3、下列物质均有漂白作用,其漂白原理相同的是( )
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭
A.① ④ B.①③ C.②③ D.①②
D
6、检验SO2气体中是否存在CO2气体,应采用的方法是( )
A、 通过澄清石灰水
B、通过氢样氧化钠溶液
C、先通过足量酸性高锰酸钾溶液,再通过石灰水
D、通过品红溶液
C
练一练
5、将等物质的量的SO2、Cl2通入水中,所得溶液具有( )
(Cl2+SO2+2H2O = H2SO4+2HCl)
A、 中性、 漂白性 B 、酸性、 漂白性
C 、只有漂白性 D、 只有酸性
D
4、能用于鉴别SO2和CO2溶液是( )
A、澄清石灰水 B、品红溶液
C、紫色石蕊试液 D、氯化钡溶液
B
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.62 4.56 4.55 4.55
7、我国农业因遭受酸雨而造成每年损失高达十五多亿元。为了有效控制酸雨,
目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份.每隔一段时间测定该雨水样品的pH,所得数据如下表:
分析数据,完成下列问题:
(已知Cl2+SO2+2H2O = H2SO4+2HCl ,
①雨水样品的pH变化的原因是(用化学反应方程式表示)_____________________________。
②如果将刚取样的上述雨水和自来水相混合,pH将变___(填“大”或“小”)。
(2)你认为减少酸雨产生的途径可采用的措施是_____。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在20世纪的60—70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取,简述其理由。
H2SO3能被氧气氧化)
测定时间 0 1 2 3 4
雨水PH 4.73 4.62 4.56 4.55 4.55
2H2SO3+O2=2H2SO4
小
C
二氧化硫
酸性氧化物的通性
(物质分类的角度)
还原性、氧化性
(氧化还原的角度)
漂白性
(特性的角度)
酸雨的部分治理
方法、
二氧化硫在生活中
的作用
学习的方法
从生活到化学
物理性质——
水中溶解性等
从化学到生活
小结
祝同学们学业有成
一帆风顺
