化学计量在实验中的应用二
文档属性
| 名称 | 化学计量在实验中的应用二 |  | |
| 格式 | rar | ||
| 文件大小 | 922.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-05-13 14:43:56 | ||
图片预览







文档简介
(共28张PPT)
课堂复习:
1、24.5gH2SO4的物质的量是多少?
2、71gNa2SO4中含有Na+和SO42-的物质的量各是多少?
3、含有1.505X1022个分子的物质,其质量为0.7g,求该物质的相对分子质量。
4、12.25gKClO3中所含的Cl原子数与多少克CaCl2中所含的Cl-离子个数相等?
5、一定条件下,16gA和22gB恰好反应生成C和4.5gD,在相同条件下8gA和15gB反应可生成D和0.125molC,则C的式量是多少?
0.25mol
1mol, 0.5mol
28
5.55
134
1、我们学习了“物质的量(n)”及其单位摩尔(mol),由n可以求出哪些物理量?
[思考]
2、在实验室或 在生产中,对于气态物质常使用它的体积而不是质量。那么物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?
分子
离子
电子
原子
质量
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
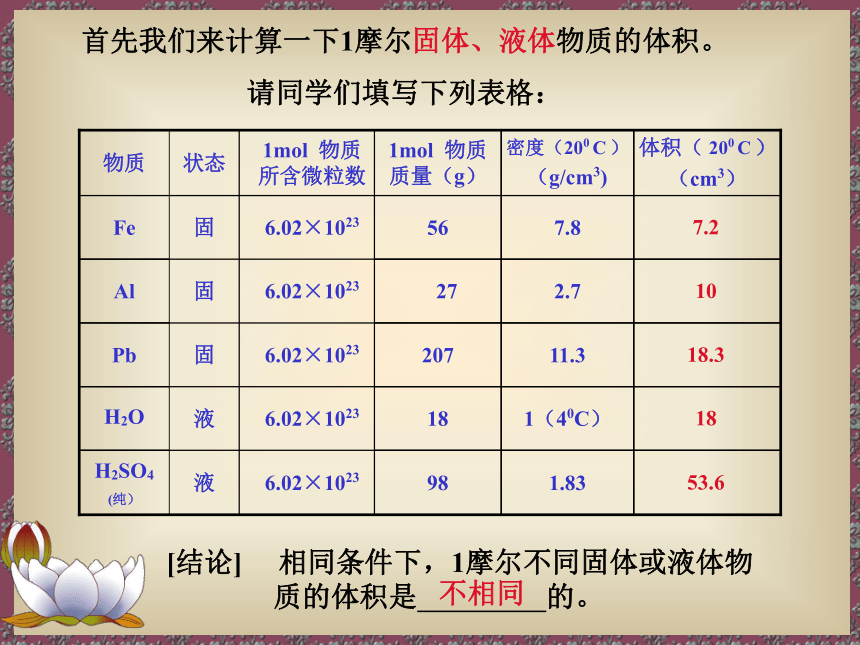
首先我们来计算一下1摩尔固体、液体物质的体积。
请同学们填写下列表格:
体积( 200 C )
(cm3)
1.83
98
6.02×1023
H2SO4
(纯)
1(40C)
18
6.02×1023
H2O
11.3
207
6.02×1023
Pb
2.7
27
6.02×1023
Al
7.8
56
6.02×1023
Fe
密度(200 C )
(g/cm3)
1mol 物质质量(g)
1mol 物质所含微粒数
液
液
固
固
固
状态
物质
[结论] 相同条件下,1摩尔不同固体或液体物质的体积是 的。
53.6
18
18.3
10
7.2
不相同
[讨论] 对于1mol不同的固体和液体物质,为什么它们的体积各不相同呢?
[启发] 决定物质体积大小的因素有哪些呢?
决定物质体积大小的因素之一:
粒子数目多少
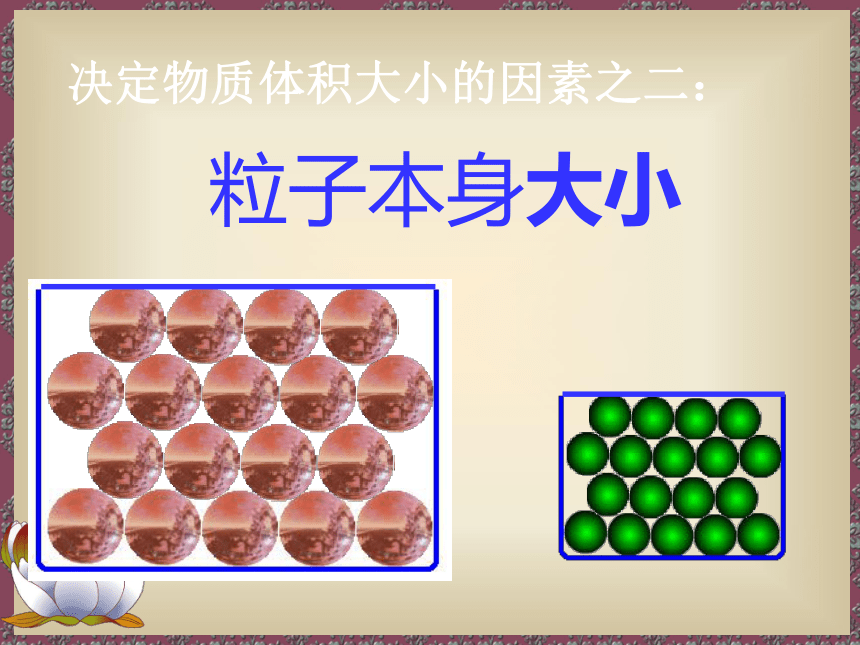
决定物质体积大小的因素之二:
粒子本身大小
决定物质体积大小的因素之三:
粒子间的距离
紧密堆积
微粒间有距离
可以忽略
不可忽略
粒子之间的距离对体积的影响
[小结] 固体、液体物质粒子间间隔很小,在 微粒数目相同的情况下,固体、液体 的体积主要由粒子本身大小决定。
[设问]相同条件(标准状况)下,1摩尔任何气体的体积是否相同呢?填写下列表格。
1.977
44.01
6.02×1023
CO2
1.429
32.00
6.02×1023
O2
0.0899
2.016
6.02×1023
H2
体积
标准状况(L)
密度
标准状况(g/L)
1mol气体质量(g)
1mol 气体所含分子数
气体物质
[结论] 在标准状况下,1mol任何气体所占的体积
L。
22.3
22.4
22.4
(标准状况:温度为0℃,压强为101KPa)
都约是 22.4
一般来说,气体分子的直径约为0.4nm,而分子之间的距离则约为4nm,即分子之间的距离约是分子直径的10倍。
[讨论]
2、分子间的平均距离受哪些条件影响?是怎样影响的?
3、为什么在标准状况下1mol任何气体所占的体积都相同呢?
1、决定气体体积大小的主要因素有哪些?
标准状况(S.T.P):温度(0℃、273K).
压强(101KPa、1.01×105Pa)
T.P相同
d相同
V相同(V=22.4L)
.
体积(V)
取决于
分子数目(N或n)
分子间平均距离(d)
d
取决于
V
n
T
d
P
d
标准状况下气体摩尔体积要点:
条件:标准状况
(S.T.P)
对象:任何气体
物质的量:1mol
结论
体积约占
22.4L
22.4L
(标准状况)
6.02×1023分子
0.282m
标准状况下的气体摩尔体积示意图
气体摩尔体积:
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号为Vm
概念:单位物质的量气体所占的体积。
[练习]
下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体一定处于标准状况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等
[答案] (D)
[练习] 在同温同压下,相同质量的下列气体,占有的体积由大到小的顺序是——
[讨论] 在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
[答案] ③>②>⑤>④>①
在同温同压下,相同分子数的气体,其体积 ( );
在同温同压下,体积相同的气体,其分子数( ) ;
在同温同压下,气体体积的大小与分子数目成( )比。
相同
相同
正
[讨论] 请列出标准状况下求算气体体积可能的方法:
1、V=m/ ρ
2、V=n×Vm
(V=m/M×Vm V=N/NA×Vm)
ρ
ρ
[练习] 在标准状况下
(1)0.5molHCl占有的体积是多少? (2)33.6LH2的物质的量是多少?
(3)16gO2的体积是多少?
(4)44.8LN2中含有的N2分子数是多少?
(11.2L)
(1.5mol)
(11.2L)
(2NA个)
小 结
2.标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
条件:标准状况(S.T.P)
对象:任何气体
物质的量:1mol
体积约占22.4L
结论
1、气体摩尔体积
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号为Vm
概念:单位物质的量气体所占的体积。
V
(标况)
÷vm
×vm
÷Vm×NA
Vm×NA÷
分子
离子
电子
原子
质量
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
m
n
N
÷ρ
× ρ
4、有关“物质的量”的计算关系
①V=m/ ρ
②V=n×Vm(V=m/M×Vm、V=N/NA×Vm)
3.求S.T.P下的V
判断下列说法是否正确:
1、同温同压时,相同体积的任何气体单质所
含的原子数相同( )
╳
2、1molCO2占有的体积约是22.4L( )
╳
3、标况下,1molH2O的体积约是22.4L( )
╳
4、CO在标况下占有的体积约是22.4L( )
╳
5、1molCO2和1molSO2所占有的体积相同,
所含的分子个数也相同( )
6、1LCO和1LCO2气体,在同温同压下所含
的原子个数相同( )
7、标况下1L甲烷与1LH2所含分子数相同( )
8、同温同压下,amolCl2和bmolO2(a≠b)的
质量一定不相等( )
╳
╳
╳
√
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2
所含原子数为NA( )
╳
2、常温常压,11.2LCl2含有的
分子数为0.5NA( )
╳
3、 常温常压,1molHe含有的
原子数为NA( )
√
4、 常温常压,2.3gNa由原子变为离子时,
失去的电子数为0.1 NA( )
√
例1、将1.2gC跟下列物质完全反应可生成 2.24L(标况)气体,该氧化物一定不是( )
A CuO B H2O C SiO2 D CO2
例2、在2730C和1.01╳105Pa条件下, 将1.40gN2,1.60gO2,4.00gAr 气混合,该混合气体的体积是 ( )L
A 3.36 B 6.72 C 8.96 D 4.48
BD
C
课堂复习:
1、24.5gH2SO4的物质的量是多少?
2、71gNa2SO4中含有Na+和SO42-的物质的量各是多少?
3、含有1.505X1022个分子的物质,其质量为0.7g,求该物质的相对分子质量。
4、12.25gKClO3中所含的Cl原子数与多少克CaCl2中所含的Cl-离子个数相等?
5、一定条件下,16gA和22gB恰好反应生成C和4.5gD,在相同条件下8gA和15gB反应可生成D和0.125molC,则C的式量是多少?
0.25mol
1mol, 0.5mol
28
5.55
134
1、我们学习了“物质的量(n)”及其单位摩尔(mol),由n可以求出哪些物理量?
[思考]
2、在实验室或 在生产中,对于气态物质常使用它的体积而不是质量。那么物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?
分子
离子
电子
原子
质量
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
首先我们来计算一下1摩尔固体、液体物质的体积。
请同学们填写下列表格:
体积( 200 C )
(cm3)
1.83
98
6.02×1023
H2SO4
(纯)
1(40C)
18
6.02×1023
H2O
11.3
207
6.02×1023
Pb
2.7
27
6.02×1023
Al
7.8
56
6.02×1023
Fe
密度(200 C )
(g/cm3)
1mol 物质质量(g)
1mol 物质所含微粒数
液
液
固
固
固
状态
物质
[结论] 相同条件下,1摩尔不同固体或液体物质的体积是 的。
53.6
18
18.3
10
7.2
不相同
[讨论] 对于1mol不同的固体和液体物质,为什么它们的体积各不相同呢?
[启发] 决定物质体积大小的因素有哪些呢?
决定物质体积大小的因素之一:
粒子数目多少
决定物质体积大小的因素之二:
粒子本身大小
决定物质体积大小的因素之三:
粒子间的距离
紧密堆积
微粒间有距离
可以忽略
不可忽略
粒子之间的距离对体积的影响
[小结] 固体、液体物质粒子间间隔很小,在 微粒数目相同的情况下,固体、液体 的体积主要由粒子本身大小决定。
[设问]相同条件(标准状况)下,1摩尔任何气体的体积是否相同呢?填写下列表格。
1.977
44.01
6.02×1023
CO2
1.429
32.00
6.02×1023
O2
0.0899
2.016
6.02×1023
H2
体积
标准状况(L)
密度
标准状况(g/L)
1mol气体质量(g)
1mol 气体所含分子数
气体物质
[结论] 在标准状况下,1mol任何气体所占的体积
L。
22.3
22.4
22.4
(标准状况:温度为0℃,压强为101KPa)
都约是 22.4
一般来说,气体分子的直径约为0.4nm,而分子之间的距离则约为4nm,即分子之间的距离约是分子直径的10倍。
[讨论]
2、分子间的平均距离受哪些条件影响?是怎样影响的?
3、为什么在标准状况下1mol任何气体所占的体积都相同呢?
1、决定气体体积大小的主要因素有哪些?
标准状况(S.T.P):温度(0℃、273K).
压强(101KPa、1.01×105Pa)
T.P相同
d相同
V相同(V=22.4L)
.
体积(V)
取决于
分子数目(N或n)
分子间平均距离(d)
d
取决于
V
n
T
d
P
d
标准状况下气体摩尔体积要点:
条件:标准状况
(S.T.P)
对象:任何气体
物质的量:1mol
结论
体积约占
22.4L
22.4L
(标准状况)
6.02×1023分子
0.282m
标准状况下的气体摩尔体积示意图
气体摩尔体积:
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号为Vm
概念:单位物质的量气体所占的体积。
[练习]
下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体一定处于标准状况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等
[答案] (D)
[练习] 在同温同压下,相同质量的下列气体,占有的体积由大到小的顺序是——
[讨论] 在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
[答案] ③>②>⑤>④>①
在同温同压下,相同分子数的气体,其体积 ( );
在同温同压下,体积相同的气体,其分子数( ) ;
在同温同压下,气体体积的大小与分子数目成( )比。
相同
相同
正
[讨论] 请列出标准状况下求算气体体积可能的方法:
1、V=m/ ρ
2、V=n×Vm
(V=m/M×Vm V=N/NA×Vm)
ρ
ρ
[练习] 在标准状况下
(1)0.5molHCl占有的体积是多少? (2)33.6LH2的物质的量是多少?
(3)16gO2的体积是多少?
(4)44.8LN2中含有的N2分子数是多少?
(11.2L)
(1.5mol)
(11.2L)
(2NA个)
小 结
2.标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
条件:标准状况(S.T.P)
对象:任何气体
物质的量:1mol
体积约占22.4L
结论
1、气体摩尔体积
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号为Vm
概念:单位物质的量气体所占的体积。
V
(标况)
÷vm
×vm
÷Vm×NA
Vm×NA÷
分子
离子
电子
原子
质量
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
m
n
N
÷ρ
× ρ
4、有关“物质的量”的计算关系
①V=m/ ρ
②V=n×Vm(V=m/M×Vm、V=N/NA×Vm)
3.求S.T.P下的V
判断下列说法是否正确:
1、同温同压时,相同体积的任何气体单质所
含的原子数相同( )
╳
2、1molCO2占有的体积约是22.4L( )
╳
3、标况下,1molH2O的体积约是22.4L( )
╳
4、CO在标况下占有的体积约是22.4L( )
╳
5、1molCO2和1molSO2所占有的体积相同,
所含的分子个数也相同( )
6、1LCO和1LCO2气体,在同温同压下所含
的原子个数相同( )
7、标况下1L甲烷与1LH2所含分子数相同( )
8、同温同压下,amolCl2和bmolO2(a≠b)的
质量一定不相等( )
╳
╳
╳
√
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2
所含原子数为NA( )
╳
2、常温常压,11.2LCl2含有的
分子数为0.5NA( )
╳
3、 常温常压,1molHe含有的
原子数为NA( )
√
4、 常温常压,2.3gNa由原子变为离子时,
失去的电子数为0.1 NA( )
√
例1、将1.2gC跟下列物质完全反应可生成 2.24L(标况)气体,该氧化物一定不是( )
A CuO B H2O C SiO2 D CO2
例2、在2730C和1.01╳105Pa条件下, 将1.40gN2,1.60gO2,4.00gAr 气混合,该混合气体的体积是 ( )L
A 3.36 B 6.72 C 8.96 D 4.48
BD
C
