气体摩尔体积2
图片预览







文档简介
(共36张PPT)
气体摩尔体积
概念: 单位物质的量气体所占的体积.
符号: Vm
公式:
常用单位有L/mol(L·mol-1)和m3/mol
课前回顾
1、气体摩尔体积
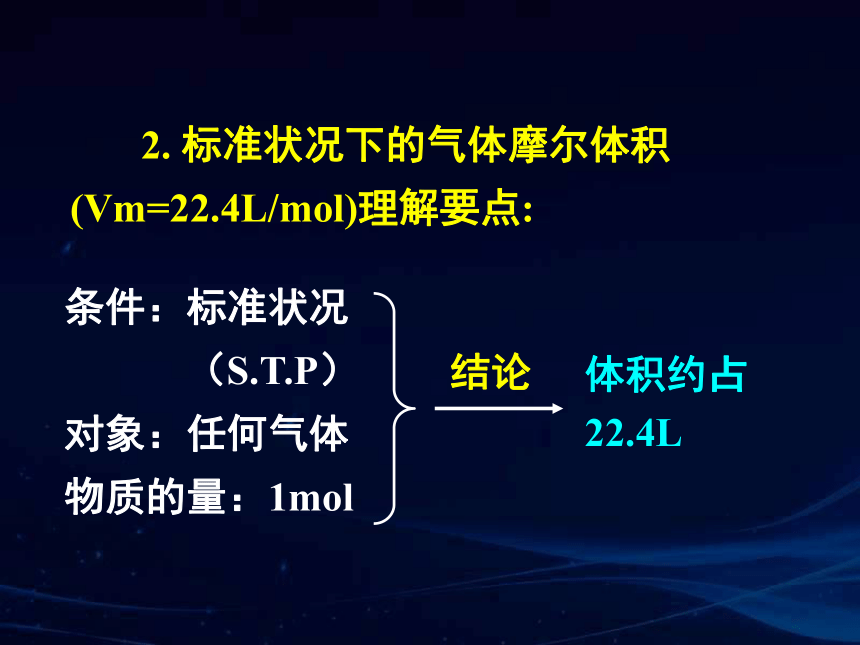
2. 标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
结论
条件:标准状况
(S.T.P) 对象:任何气体
物质的量:1mol
体积约占22.4L
1. V=m / ρ
(V=m/M×Vm, V=N/NA×Vm)
2. V=n×Vm
3. 求S.T.P下的V
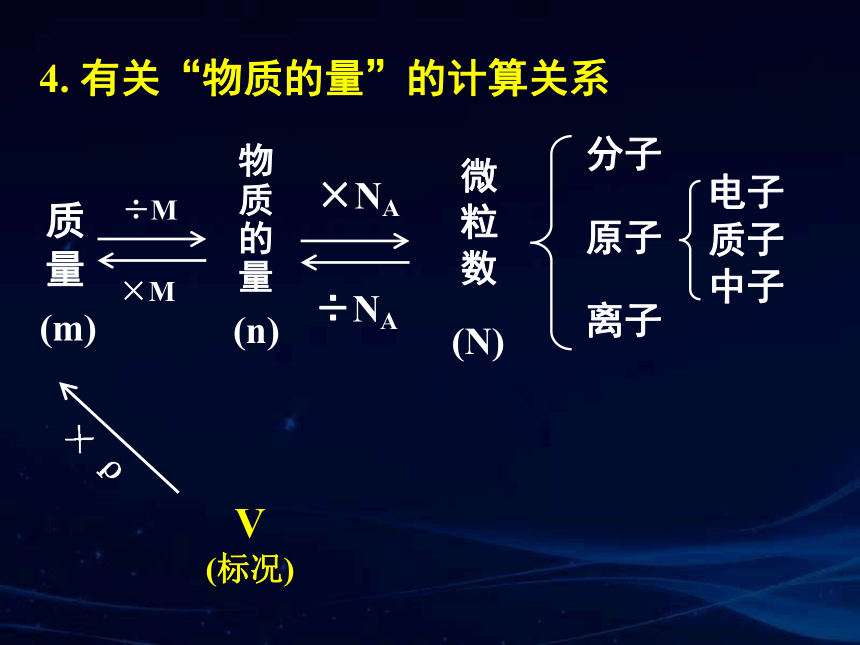
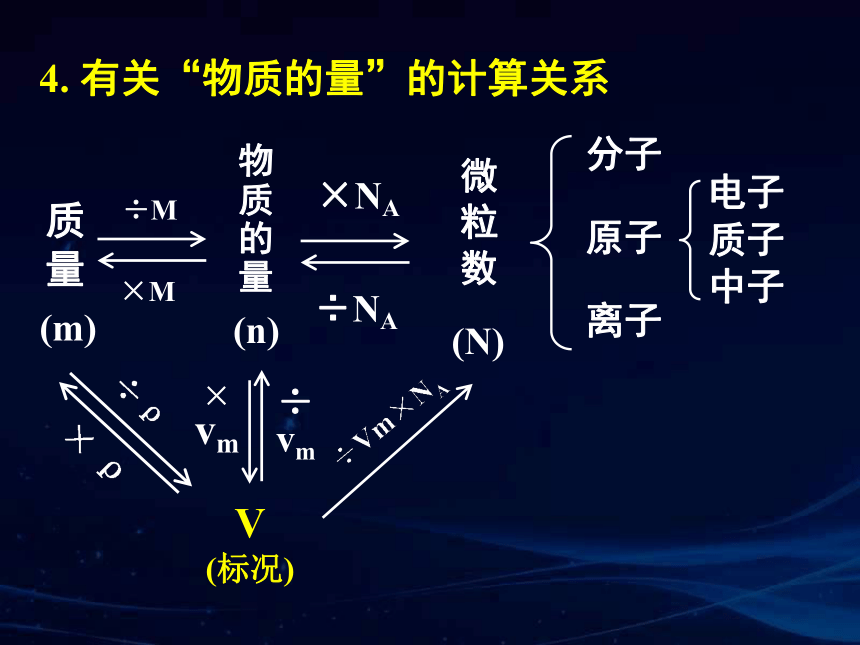
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
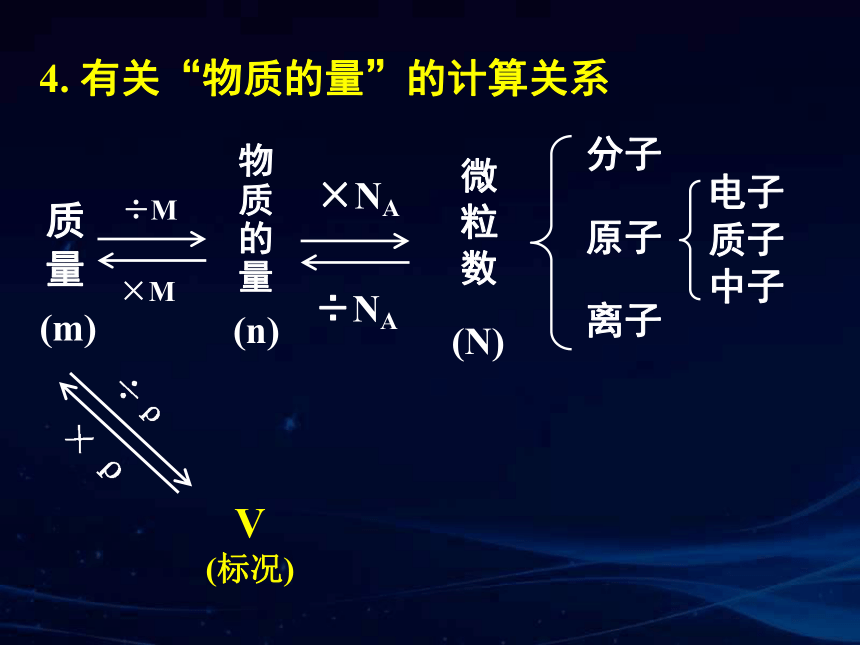
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
× vm
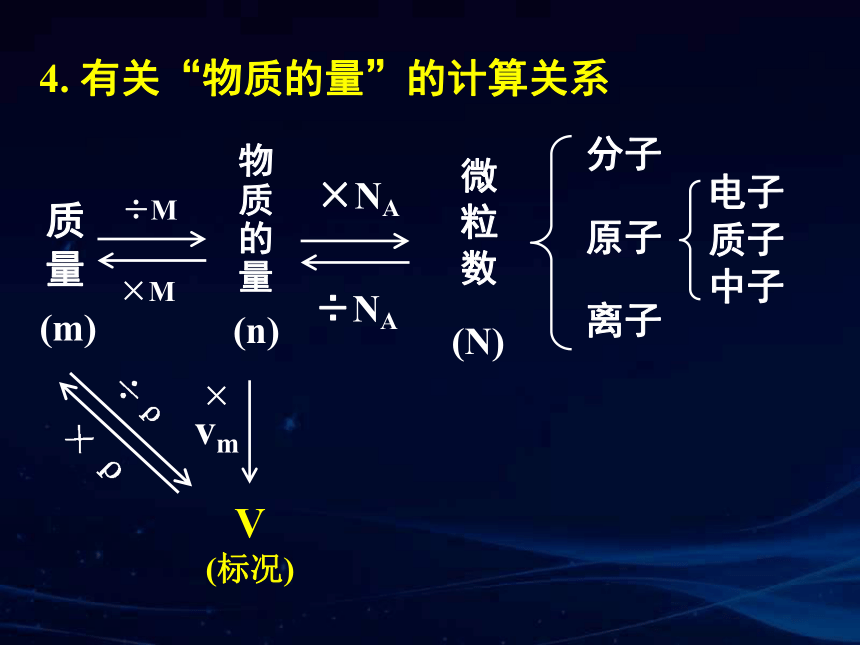
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
÷ vm
× vm
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
÷ vm
× vm
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
÷ vm
× vm
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
2. 1molCO2占有的体积约是22.4L( )
3. 标况下, 1molH2O的体积约是22.4L( )
4. CO在标况下占有的体积约是22.4L( )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
╳
2. 1molCO2占有的体积约是22.4L( )
3. 标况下, 1molH2O的体积约是22.4L( )
4. CO在标况下占有的体积约是22.4L( )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
╳
2. 1molCO2占有的体积约是22.4L( )
╳
3. 标况下, 1molH2O的体积约是22.4L( )
4. CO在标况下占有的体积约是22.4L( )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
╳
2. 1molCO2占有的体积约是22.4L( )
╳
3. 标况下, 1molH2O的体积约是22.4L( )
╳
4. CO在标况下占有的体积约是22.4L( )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
╳
2. 1molCO2占有的体积约是22.4L( )
╳
3. 标况下, 1molH2O的体积约是22.4L( )
╳
4. CO在标况下占有的体积约是22.4L( )
╳
判断下列说法是否正确:
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
╳
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
╳
╳
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
╳
╳
√
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
╳
╳
╳
√
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
3、常温常压,1molHe含有的原子数为NA ( )
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
╳
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
3、常温常压,1molHe含有的原子数为NA ( )
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
╳
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
╳
3、常温常压,1molHe含有的原子数为NA ( )
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
╳
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
╳
3、常温常压,1molHe含有的原子数为NA ( )
√
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
╳
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
╳
3、常温常压,1molHe含有的原子数为NA ( )
√
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
√
判断下列说法是否正确:
例1. 将1.2gC跟下列物质完全反应可生成 2.24L(标况)气体,该氧化物一定不是( )
A. CuO B. H2O C. SiO2 D. CO2
例2. 在273oC和1.01×105Pa条件下, 将1.40gN2, 1.60gO2,4.00gAr 气混合, 该混合气体的体 积是( )L
A. 3.36 B. 6.72 C. 8.96 D. 4.48
例1. 将1.2gC跟下列物质完全反应可生成 2.24L(标况)气体,该氧化物一定不是( )
A. CuO B. H2O C. SiO2 D. CO2
例2. 在273oC和1.01×105Pa条件下, 将1.40gN2, 1.60gO2,4.00gAr 气混合, 该混合气体的体 积是( )L
A. 3.36 B. 6.72 C. 8.96 D. 4.48
BD
例1. 将1.2gC跟下列物质完全反应可生成 2.24L(标况)气体,该氧化物一定不是( )
A. CuO B. H2O C. SiO2 D. CO2
例2. 在273oC和1.01×105Pa条件下, 将1.40gN2, 1.60gO2,4.00gAr 气混合, 该混合气体的体 积是( )L
A. 3.36 B. 6.72 C. 8.96 D. 4.48
BD
C
1. 内容:同温、同压下,相同体积的任 何气体含有相同数目的分子。
(2)适用于气态物质。既适用于单一气体,又适用于混合气体。
补充:阿伏加德罗定律
2. 数学表达式
***注意***
(1)“三同”定“一同”。
补充:阿伏加德罗定律的几个推论
1. 同温、同压: V1 / V2 = n1 / n2 = N1 / N2
2. 同温、同压:ρ1 / ρ2 = M1 / M2
3. 同温、同体积:P1 / P2 = n1 / n2 = N1 / N2
2. 在标准状况下,空气的平均式量为29,相同条件下的下列气体密度比空气密度大的是( )
①③④
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
1. 内容:同温、同压下,相同体积的任 何气体含有相同数目的分子。
(2)适用于气态物质。既适用于单一气体,又适用于混合气体。
补充:阿伏加德罗定律
2. 数学表达式
***注意***
(1)“三同”定“一同”。
补充:阿伏加德罗定律的几个推论
1. 同温、同压: V1 / V2 = n1 / n2 = N1 / N2
2. 同温、同压:ρ1 / ρ2 = M1 / M2
3. 同温、同体积:P1 / P2 = n1 / n2 = N1 / N2
2. 在标准状况下,空气的平均式量为29,相同条件下的下列气体密度比空气密度大的是( )
①③④
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
气体摩尔体积
概念: 单位物质的量气体所占的体积.
符号: Vm
公式:
常用单位有L/mol(L·mol-1)和m3/mol
课前回顾
1、气体摩尔体积
2. 标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
结论
条件:标准状况
(S.T.P) 对象:任何气体
物质的量:1mol
体积约占22.4L
1. V=m / ρ
(V=m/M×Vm, V=N/NA×Vm)
2. V=n×Vm
3. 求S.T.P下的V
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
× vm
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
÷ vm
× vm
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
÷ vm
× vm
4. 有关“物质的量”的计算关系
分子
离子
电子
原子
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
质量
V
(标况)
÷ vm
× vm
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
2. 1molCO2占有的体积约是22.4L( )
3. 标况下, 1molH2O的体积约是22.4L( )
4. CO在标况下占有的体积约是22.4L( )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
╳
2. 1molCO2占有的体积约是22.4L( )
3. 标况下, 1molH2O的体积约是22.4L( )
4. CO在标况下占有的体积约是22.4L( )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
╳
2. 1molCO2占有的体积约是22.4L( )
╳
3. 标况下, 1molH2O的体积约是22.4L( )
4. CO在标况下占有的体积约是22.4L( )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
╳
2. 1molCO2占有的体积约是22.4L( )
╳
3. 标况下, 1molH2O的体积约是22.4L( )
╳
4. CO在标况下占有的体积约是22.4L( )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含 的原子数相同( )
╳
2. 1molCO2占有的体积约是22.4L( )
╳
3. 标况下, 1molH2O的体积约是22.4L( )
╳
4. CO在标况下占有的体积约是22.4L( )
╳
判断下列说法是否正确:
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
╳
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
╳
╳
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
╳
╳
√
5. 1molCO2和1molSO2所占有的体积相同, 所含的分子个数也相同( ) 6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ) 7. 标况下1L甲烷与1LH2所含分子数相同 ( )
8. 同温同压下,amolCl2和bmolO2(a≠b) 的质量一定不相等( )
╳
╳
╳
√
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
3、常温常压,1molHe含有的原子数为NA ( )
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
╳
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
3、常温常压,1molHe含有的原子数为NA ( )
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
╳
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
╳
3、常温常压,1molHe含有的原子数为NA ( )
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
╳
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
╳
3、常温常压,1molHe含有的原子数为NA ( )
√
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( )
╳
2、常温常压,11.2LCl2含有的分子数为 0.5NA( )
╳
3、常温常压,1molHe含有的原子数为NA ( )
√
4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
√
判断下列说法是否正确:
例1. 将1.2gC跟下列物质完全反应可生成 2.24L(标况)气体,该氧化物一定不是( )
A. CuO B. H2O C. SiO2 D. CO2
例2. 在273oC和1.01×105Pa条件下, 将1.40gN2, 1.60gO2,4.00gAr 气混合, 该混合气体的体 积是( )L
A. 3.36 B. 6.72 C. 8.96 D. 4.48
例1. 将1.2gC跟下列物质完全反应可生成 2.24L(标况)气体,该氧化物一定不是( )
A. CuO B. H2O C. SiO2 D. CO2
例2. 在273oC和1.01×105Pa条件下, 将1.40gN2, 1.60gO2,4.00gAr 气混合, 该混合气体的体 积是( )L
A. 3.36 B. 6.72 C. 8.96 D. 4.48
BD
例1. 将1.2gC跟下列物质完全反应可生成 2.24L(标况)气体,该氧化物一定不是( )
A. CuO B. H2O C. SiO2 D. CO2
例2. 在273oC和1.01×105Pa条件下, 将1.40gN2, 1.60gO2,4.00gAr 气混合, 该混合气体的体 积是( )L
A. 3.36 B. 6.72 C. 8.96 D. 4.48
BD
C
1. 内容:同温、同压下,相同体积的任 何气体含有相同数目的分子。
(2)适用于气态物质。既适用于单一气体,又适用于混合气体。
补充:阿伏加德罗定律
2. 数学表达式
***注意***
(1)“三同”定“一同”。
补充:阿伏加德罗定律的几个推论
1. 同温、同压: V1 / V2 = n1 / n2 = N1 / N2
2. 同温、同压:ρ1 / ρ2 = M1 / M2
3. 同温、同体积:P1 / P2 = n1 / n2 = N1 / N2
2. 在标准状况下,空气的平均式量为29,相同条件下的下列气体密度比空气密度大的是( )
①③④
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
1. 内容:同温、同压下,相同体积的任 何气体含有相同数目的分子。
(2)适用于气态物质。既适用于单一气体,又适用于混合气体。
补充:阿伏加德罗定律
2. 数学表达式
***注意***
(1)“三同”定“一同”。
补充:阿伏加德罗定律的几个推论
1. 同温、同压: V1 / V2 = n1 / n2 = N1 / N2
2. 同温、同压:ρ1 / ρ2 = M1 / M2
3. 同温、同体积:P1 / P2 = n1 / n2 = N1 / N2
2. 在标准状况下,空气的平均式量为29,相同条件下的下列气体密度比空气密度大的是( )
①③④
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
