蛋白质
图片预览










文档简介
(共65张PPT)
蛋白质概述
蛋白质-英文为“Protein”—第一重要
1.蛋白质是生物体的重要组成成分,是生物体形态结构的物质基础。
2.蛋白质是生命活动的物质基础。
物质交换和运输 光合作用与呼吸作用
原生质运动 分泌与吸收 防御与抵抗
识别与调控 生物催化 等
Erythrocytes(红细胞) contain a large amount of
hemoglobins(血红蛋白), the oxygen-transporting protein.
The protein keratin (角蛋白) is the chief structural components of hair, scales, horn, wool, nails and feathers.
蛋白质的概念:蛋白质 (protein)是最基本的生命物质之一,是由许多不同的α-氨基酸按一定的序列通过酰胺键(肽键)缩合而成的,具有较稳定的构象并具有一定生物功能的大分子。
蛋白质的元素组成
C(50-55%)、H(6-8%)、O(20-23%)、N(15-18%)、S(0-4%),有些蛋白质还含有一些其它元素,如 P、Fe、Cu、Mo、I等。
N的含量平均为16%——凯氏(Kjadehl)定氮法的理论基础。 1克氮就相当于6.25克蛋白质。
氨基酸是蛋白质的基本结构单位。
氨基酸
蛋白质的基本结构单位——氨基酸(amino acid, aa或AA)
20种标准氨基酸(20 standard amino acids)
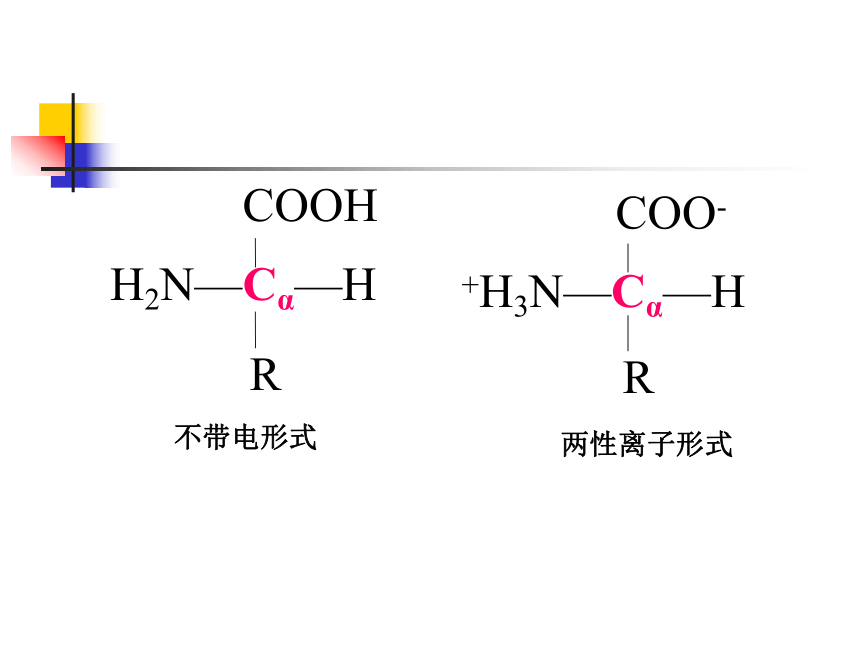
一、氨基酸的结构通式:
19种氨基酸具有一级氨基(-NH3+)和羧基(-COOH)结合到α碳原子(Cα),同时结合到(Cα)上的是H原子和各种侧链(R);Pro具有二级氨基(α-亚氨基酸)
不带电形式
H2N—Cα—H
COOH
R
+H3N—Cα—H
COO-
R
两性离子形式
1、天然蛋白质仅有20种氨基酸,除脯氨酸外均为 - 氨基酸
2、命名:天然氨基酸一般都用俗名;也可用系统命名法;每一种氨基酸都有一个国际上通用的符号和中文符号。如:
HCH-COOH 甘氨酸(2-氨基乙酸)Gly 甘
NH2
3、旋光性:左旋(-)和右旋(+)(除甘氨酸没有旋光性)
4、构型:D-型和L-型(除甘氨酸,天然蛋白质的氨基酸均为L-氨基酸,脯氨酸属于L- -亚氨基酸)。
氨基酸的相对构型与乳酸相联系;乳酸的相对构型与甘油醛相联系:
-碳原子为不对称的碳原子,组成蛋白质的氨基酸除Gly以外都有手性碳原子,在三维空间上就有两种不同的排列方式,它们互为镜影,所以,
CHO
COOH
COOH
L─甘油醛
L─乳酸
L─丙氨酸
NH2
CH3
CH2OH
HO
CH3
HO
H
H
H
构成蛋白质的20种氨基酸
二、常见的蛋白质氨基酸的分类:
法一:按R基化学结构特点分:
法二:按R基极性性质(pH 7时)分:
中性氨基酸
氨基酸的结构、代号:
人类8种必需氨基酸:(人体体内不能自身合成,必须从食物中获得)
Met、Val、Lys、Ile、Phe、Leu、Try、Thr
婴儿时期所需: Arg、His
早产儿所需:Try、Cys
1、一般物理性质
常见氨基酸均为无色结晶,其形状因构型而异。
溶解性:各种氨基酸在水中的溶解度差别很大,并能溶解于稀酸或稀碱中,但不能溶解于有机溶剂(酒精能把氨基酸从其溶液中沉淀析出)。
(2)熔点:氨基酸的熔点极高,一般在200℃以上。
(3)味感:其味随不同氨基酸有所不同,有的无味、有的为甜、有的味苦,谷氨酸的单钠盐有鲜味,是味精的主要成分。
三、氨基酸的重要理化性质
(4)光吸收:天然蛋白质分子的20种氨基酸,组成蛋白质的氨基酸中,Trp、Tyr和 Phe对紫外光有一定的吸收,这是因为它们分子中含有苯环,是苯环的共轭双键造成的,这三个氨基酸的光吸收都在280nm附近。
酪氨酸的 max=275nm,
苯丙氨酸的 max=257nm,
色氨酸的 max=280nm
2、氨基酸的两性解离和等电点
Br nsted的酸碱理论,即广义酸碱理论。
HA A- + H +
酸
碱
质子
两性离子(dipolar ion)
氨基酸在水中的两性离子既能像酸一样放出质子,也能像碱一样接受质子,氨基酸具有酸碱性质,是一类两性电解质。
As an acid(proton donor):
As a base(proton acceptor):
不同pH时氨基酸以不同的离子化形式存在:
正离子
两性离子
负离子
氨基酸所带静电荷为“零”时,溶液的pH值称为该氨基酸的等电点(isoelectric point),以pI表示。
实验证明在等电点时,氨基酸主要以两性离子形式存在,但也有少量的而且数量相等的正、负离子形式,还有极少量的中性分子。
当溶液的pH=pI时,氨基酸主要从两性离子形式存在。
pHpH>pI时,氨基酸主要以负离子形式存在。
氨基酸的酸碱滴定曲线
Henderson-Hasselbalch方程
pH=pKa + lg
[质子受体]
[质子供体]
酸碱滴定曲线
等电点的计算
中性氨基酸:以Gly为例
K1=
[Gly±] [H+]
[Gly+]
K2=
[Gly- ] [H+]
[Gly±]
pI时,
[Gly+ ] = [Gly- ]
[Gly±] [H+]
K1
=
[Gly±] K2
[H+]
[H+]2=K1K2
pH=(pK1+pK2)/2
pI=(pK1+pK2)/2
pI =(2.34+9.60)/2=5.97
Gly
酸性氨基酸,以Asp为例:
碱性氨基酸,以Lys为例:
pI的用途:分离、纯化和鉴定蛋白质制剂、氨基酸制剂,在药物使用上可改变pI方法延长疗效。
当pH=pI时:
(1)带净电=0,电场上不移动,导电性最小。
(2)溶解度最小,最易沉淀,粘度最小。
(1)与茚三酮的反应(颜色反应)
Pro产生黄色物质,其它为蓝紫色。在570nm(蓝紫色)或440nm(黄色)定量测定(几μg)。
4、氨基酸的化学性质
(2)与甲醛反应-氨基酸的甲醛滴定法
氨基酸定量分析—甲醛滴定法(间接滴定)
A.直接滴定,终点pH过高(12),没有适当指示剂。
B.与甲醛反应,滴定终点在9左右,可用酚酞作指示剂。
C.释放一个氢离子,相当于一个氨基(摩尔比1:1)
D.简单快速,一般用于测定蛋白质的水解速度。
二羟甲基衍生物
一羟甲基衍生物
(3) 与2,4-二硝基氟苯(DNFB)反应
应用:氨基酸取代DNFB测定蛋白质N端氨基酸,灵敏度高。
黄色
★首先由Sanger应用,确定了胰岛素的一级结构
A.肽分子与DNFB反应,得DNP-肽
B.水解DNP-肽,得DNP-N端氨基酸及其他游离氨基酸
C.分离DNP-氨基酸
D.层析法定性DNP-氨基酸,得出N端氨基酸的种类、数目
(4)与异硫氰酸苯酯(PITC)的反应
由Edman于1950年首先提出
为α- NH2的反应
又称Edman降解法(苯异硫氰酸酯法),氨基酸顺序分析法实际上也是一种N-端分析法。此法的特点是能够不断重复循环,将肽链N-端氨基酸残基逐一进行标记和解离。
—N=C=S + N—CH—COOH
H
H
R
PITC
—N—C—N—CH—COOH
H
H
R
S
PTC-氨基酸
—N—C
H
R
S
N
C
C
O
PTH-氨基酸
pH8.3
无水HF
重复测定多肽链N端氨基酸排列顺序,设计出“多肽顺序自动分析仪”
肽链(N端氨基酸)与PITC偶联,生成PTC-肽
环化断裂:最靠近PTC基的肽键断裂,生成PTC-氨基酸和少一残基的肽链,同时PTC-氨基酸环化生成PTH-氨基酸
分离PTH-氨基酸
层析法鉴定
Edman降解法的改进方法--- DNS-Edman降解法
用DNS(二甲基萘磺酰氯)测定N端氨基酸
原理DNFB法相同
但水解后的DNS-氨基酸不需分离,可直接用电泳或层析法鉴定
由于DNS有强烈荧光,灵敏度比DNFB法高100倍,比Edman法高几到十几倍
可用于微量氨基酸的定量
(5)与荧光胺的反应
α- NH2的反应
氨基酸定量
在室温下,氨基酸可与荧光胺反应产生具有荧光的产物,根据荧光强度可用荧光分光光度计测定氨基酸含量。
(6)与5,5 '-双硫基-双(2-硝基苯甲酸)反应:
半胱氨酸R侧链上的—SH,可在pH=8.0和室温的条件下与5,5'-双硫基-双(2-硝基苯甲酸)试剂(又称Ellman试剂)反应,产生一种含有—SH的硝基苯甲酸。这种产物在波长412nm处有一个最大吸收峰,可测定光吸收值确定半胱氨酸的含量。
H2N—CH
CH2
S
SH
NO2
HOOC
S
NO2
COOH
COOH
+
S
S
NO2
NO2
HOOC
COOH
H2N—CH—COOH +
CH2
SH
pH8.0
硫代硝基苯甲酸
(7)其他反应
成盐、成酯、成肽、脱羧反应
肽与肽键
一、肽与肽键
一个氨基酸的α-羧基和另一个氨基酸的α-氨基脱水缩合而成的化合物,称为肽。
氨基酸之间脱水后形成的键称肽键(酰胺键)。
肽键的形成
由两个氨基酸组成的肽称为二肽,由多个氨基酸组成的肽则称为多肽。组成多肽的氨基酸单元称为氨基酸残基。
氨基酸之间通过肽键连接形成的链称肽链。
N端
氨基酸残基
氨基酸残基
C端
肽链书写方式:N端→C端
写法:游离α-氨基在左,游离α-羧基在右,氨基酸之间用“-”表示肽键。 H2N-Ser-Leu-Phe-COOH
肽链有链状、环状和分支状。
命名:根据氨基酸组成,由N端→C端命名
丙氨酰甘氨酰亮氨酸
Ala-Gly-Leu
(or Ala Gly Leu)
化学反应:Sanger反应、DNS反应,Edman反应,茚三酮反应,双缩脲反应
在碱性溶液中与硫酸铜作用呈现紫红色,称双缩脲反应。
凡分子中含有两个以上-CO-NH-键的化合物都呈此反应
二、生物活性肽:
生物体内具有一定生物学活性的肽类物质称生物活性肽。
重要的生物活性肽有谷胱甘肽、神经肽、肽类激素等。
1. 谷胱甘肽(glutathione, GSH):
是一种称为 -谷氨酰半胱氨酰甘氨酸的三肽化合物。
还原型与氧化型谷胱甘肽的相互转变
Glu-Cys-Gly
|
S
|
S
|
Glu-Cys-Gly
-2H
+2H
谷胱甘肽分子中的巯基可氧化或还原,故有还原型(GSH)与氧化型(GSSG)两种存在形式。
2× Glu-Cys-Gly
|
SH
解毒作用:与毒物或药物结合,消除其毒性作用;
参与氧化还原反应:作为重要的还原剂,参与体内多种氧化还原反应;
保护巯基酶的活性:使巯基酶的活性基团-SH维持还原状态;
维持红细胞膜结构的稳定:消除氧化剂对红细胞膜结构的破坏作用。
谷胱甘肽的生理功用:
多肽类激素主要见于下丘脑及垂体分泌的激素,如催产素(9肽)、加压素(9肽);
。
2. 多肽类激素:
3.神经肽
甲硫氨酸脑啡肽 Tyr–Gly–Gly–phe- Met
亮氨酸脑啡肽 Tyr-Gly-Gly-phe-Leu
功能:镇痛
如脑啡肽 (enkephalin)
蛋白质概述
蛋白质-英文为“Protein”—第一重要
1.蛋白质是生物体的重要组成成分,是生物体形态结构的物质基础。
2.蛋白质是生命活动的物质基础。
物质交换和运输 光合作用与呼吸作用
原生质运动 分泌与吸收 防御与抵抗
识别与调控 生物催化 等
Erythrocytes(红细胞) contain a large amount of
hemoglobins(血红蛋白), the oxygen-transporting protein.
The protein keratin (角蛋白) is the chief structural components of hair, scales, horn, wool, nails and feathers.
蛋白质的概念:蛋白质 (protein)是最基本的生命物质之一,是由许多不同的α-氨基酸按一定的序列通过酰胺键(肽键)缩合而成的,具有较稳定的构象并具有一定生物功能的大分子。
蛋白质的元素组成
C(50-55%)、H(6-8%)、O(20-23%)、N(15-18%)、S(0-4%),有些蛋白质还含有一些其它元素,如 P、Fe、Cu、Mo、I等。
N的含量平均为16%——凯氏(Kjadehl)定氮法的理论基础。 1克氮就相当于6.25克蛋白质。
氨基酸是蛋白质的基本结构单位。
氨基酸
蛋白质的基本结构单位——氨基酸(amino acid, aa或AA)
20种标准氨基酸(20 standard amino acids)
一、氨基酸的结构通式:
19种氨基酸具有一级氨基(-NH3+)和羧基(-COOH)结合到α碳原子(Cα),同时结合到(Cα)上的是H原子和各种侧链(R);Pro具有二级氨基(α-亚氨基酸)
不带电形式
H2N—Cα—H
COOH
R
+H3N—Cα—H
COO-
R
两性离子形式
1、天然蛋白质仅有20种氨基酸,除脯氨酸外均为 - 氨基酸
2、命名:天然氨基酸一般都用俗名;也可用系统命名法;每一种氨基酸都有一个国际上通用的符号和中文符号。如:
HCH-COOH 甘氨酸(2-氨基乙酸)Gly 甘
NH2
3、旋光性:左旋(-)和右旋(+)(除甘氨酸没有旋光性)
4、构型:D-型和L-型(除甘氨酸,天然蛋白质的氨基酸均为L-氨基酸,脯氨酸属于L- -亚氨基酸)。
氨基酸的相对构型与乳酸相联系;乳酸的相对构型与甘油醛相联系:
-碳原子为不对称的碳原子,组成蛋白质的氨基酸除Gly以外都有手性碳原子,在三维空间上就有两种不同的排列方式,它们互为镜影,所以,
CHO
COOH
COOH
L─甘油醛
L─乳酸
L─丙氨酸
NH2
CH3
CH2OH
HO
CH3
HO
H
H
H
构成蛋白质的20种氨基酸
二、常见的蛋白质氨基酸的分类:
法一:按R基化学结构特点分:
法二:按R基极性性质(pH 7时)分:
中性氨基酸
氨基酸的结构、代号:
人类8种必需氨基酸:(人体体内不能自身合成,必须从食物中获得)
Met、Val、Lys、Ile、Phe、Leu、Try、Thr
婴儿时期所需: Arg、His
早产儿所需:Try、Cys
1、一般物理性质
常见氨基酸均为无色结晶,其形状因构型而异。
溶解性:各种氨基酸在水中的溶解度差别很大,并能溶解于稀酸或稀碱中,但不能溶解于有机溶剂(酒精能把氨基酸从其溶液中沉淀析出)。
(2)熔点:氨基酸的熔点极高,一般在200℃以上。
(3)味感:其味随不同氨基酸有所不同,有的无味、有的为甜、有的味苦,谷氨酸的单钠盐有鲜味,是味精的主要成分。
三、氨基酸的重要理化性质
(4)光吸收:天然蛋白质分子的20种氨基酸,组成蛋白质的氨基酸中,Trp、Tyr和 Phe对紫外光有一定的吸收,这是因为它们分子中含有苯环,是苯环的共轭双键造成的,这三个氨基酸的光吸收都在280nm附近。
酪氨酸的 max=275nm,
苯丙氨酸的 max=257nm,
色氨酸的 max=280nm
2、氨基酸的两性解离和等电点
Br nsted的酸碱理论,即广义酸碱理论。
HA A- + H +
酸
碱
质子
两性离子(dipolar ion)
氨基酸在水中的两性离子既能像酸一样放出质子,也能像碱一样接受质子,氨基酸具有酸碱性质,是一类两性电解质。
As an acid(proton donor):
As a base(proton acceptor):
不同pH时氨基酸以不同的离子化形式存在:
正离子
两性离子
负离子
氨基酸所带静电荷为“零”时,溶液的pH值称为该氨基酸的等电点(isoelectric point),以pI表示。
实验证明在等电点时,氨基酸主要以两性离子形式存在,但也有少量的而且数量相等的正、负离子形式,还有极少量的中性分子。
当溶液的pH=pI时,氨基酸主要从两性离子形式存在。
pH
氨基酸的酸碱滴定曲线
Henderson-Hasselbalch方程
pH=pKa + lg
[质子受体]
[质子供体]
酸碱滴定曲线
等电点的计算
中性氨基酸:以Gly为例
K1=
[Gly±] [H+]
[Gly+]
K2=
[Gly- ] [H+]
[Gly±]
pI时,
[Gly+ ] = [Gly- ]
[Gly±] [H+]
K1
=
[Gly±] K2
[H+]
[H+]2=K1K2
pH=(pK1+pK2)/2
pI=(pK1+pK2)/2
pI =(2.34+9.60)/2=5.97
Gly
酸性氨基酸,以Asp为例:
碱性氨基酸,以Lys为例:
pI的用途:分离、纯化和鉴定蛋白质制剂、氨基酸制剂,在药物使用上可改变pI方法延长疗效。
当pH=pI时:
(1)带净电=0,电场上不移动,导电性最小。
(2)溶解度最小,最易沉淀,粘度最小。
(1)与茚三酮的反应(颜色反应)
Pro产生黄色物质,其它为蓝紫色。在570nm(蓝紫色)或440nm(黄色)定量测定(几μg)。
4、氨基酸的化学性质
(2)与甲醛反应-氨基酸的甲醛滴定法
氨基酸定量分析—甲醛滴定法(间接滴定)
A.直接滴定,终点pH过高(12),没有适当指示剂。
B.与甲醛反应,滴定终点在9左右,可用酚酞作指示剂。
C.释放一个氢离子,相当于一个氨基(摩尔比1:1)
D.简单快速,一般用于测定蛋白质的水解速度。
二羟甲基衍生物
一羟甲基衍生物
(3) 与2,4-二硝基氟苯(DNFB)反应
应用:氨基酸取代DNFB测定蛋白质N端氨基酸,灵敏度高。
黄色
★首先由Sanger应用,确定了胰岛素的一级结构
A.肽分子与DNFB反应,得DNP-肽
B.水解DNP-肽,得DNP-N端氨基酸及其他游离氨基酸
C.分离DNP-氨基酸
D.层析法定性DNP-氨基酸,得出N端氨基酸的种类、数目
(4)与异硫氰酸苯酯(PITC)的反应
由Edman于1950年首先提出
为α- NH2的反应
又称Edman降解法(苯异硫氰酸酯法),氨基酸顺序分析法实际上也是一种N-端分析法。此法的特点是能够不断重复循环,将肽链N-端氨基酸残基逐一进行标记和解离。
—N=C=S + N—CH—COOH
H
H
R
PITC
—N—C—N—CH—COOH
H
H
R
S
PTC-氨基酸
—N—C
H
R
S
N
C
C
O
PTH-氨基酸
pH8.3
无水HF
重复测定多肽链N端氨基酸排列顺序,设计出“多肽顺序自动分析仪”
肽链(N端氨基酸)与PITC偶联,生成PTC-肽
环化断裂:最靠近PTC基的肽键断裂,生成PTC-氨基酸和少一残基的肽链,同时PTC-氨基酸环化生成PTH-氨基酸
分离PTH-氨基酸
层析法鉴定
Edman降解法的改进方法--- DNS-Edman降解法
用DNS(二甲基萘磺酰氯)测定N端氨基酸
原理DNFB法相同
但水解后的DNS-氨基酸不需分离,可直接用电泳或层析法鉴定
由于DNS有强烈荧光,灵敏度比DNFB法高100倍,比Edman法高几到十几倍
可用于微量氨基酸的定量
(5)与荧光胺的反应
α- NH2的反应
氨基酸定量
在室温下,氨基酸可与荧光胺反应产生具有荧光的产物,根据荧光强度可用荧光分光光度计测定氨基酸含量。
(6)与5,5 '-双硫基-双(2-硝基苯甲酸)反应:
半胱氨酸R侧链上的—SH,可在pH=8.0和室温的条件下与5,5'-双硫基-双(2-硝基苯甲酸)试剂(又称Ellman试剂)反应,产生一种含有—SH的硝基苯甲酸。这种产物在波长412nm处有一个最大吸收峰,可测定光吸收值确定半胱氨酸的含量。
H2N—CH
CH2
S
SH
NO2
HOOC
S
NO2
COOH
COOH
+
S
S
NO2
NO2
HOOC
COOH
H2N—CH—COOH +
CH2
SH
pH8.0
硫代硝基苯甲酸
(7)其他反应
成盐、成酯、成肽、脱羧反应
肽与肽键
一、肽与肽键
一个氨基酸的α-羧基和另一个氨基酸的α-氨基脱水缩合而成的化合物,称为肽。
氨基酸之间脱水后形成的键称肽键(酰胺键)。
肽键的形成
由两个氨基酸组成的肽称为二肽,由多个氨基酸组成的肽则称为多肽。组成多肽的氨基酸单元称为氨基酸残基。
氨基酸之间通过肽键连接形成的链称肽链。
N端
氨基酸残基
氨基酸残基
C端
肽链书写方式:N端→C端
写法:游离α-氨基在左,游离α-羧基在右,氨基酸之间用“-”表示肽键。 H2N-Ser-Leu-Phe-COOH
肽链有链状、环状和分支状。
命名:根据氨基酸组成,由N端→C端命名
丙氨酰甘氨酰亮氨酸
Ala-Gly-Leu
(or Ala Gly Leu)
化学反应:Sanger反应、DNS反应,Edman反应,茚三酮反应,双缩脲反应
在碱性溶液中与硫酸铜作用呈现紫红色,称双缩脲反应。
凡分子中含有两个以上-CO-NH-键的化合物都呈此反应
二、生物活性肽:
生物体内具有一定生物学活性的肽类物质称生物活性肽。
重要的生物活性肽有谷胱甘肽、神经肽、肽类激素等。
1. 谷胱甘肽(glutathione, GSH):
是一种称为 -谷氨酰半胱氨酰甘氨酸的三肽化合物。
还原型与氧化型谷胱甘肽的相互转变
Glu-Cys-Gly
|
S
|
S
|
Glu-Cys-Gly
-2H
+2H
谷胱甘肽分子中的巯基可氧化或还原,故有还原型(GSH)与氧化型(GSSG)两种存在形式。
2× Glu-Cys-Gly
|
SH
解毒作用:与毒物或药物结合,消除其毒性作用;
参与氧化还原反应:作为重要的还原剂,参与体内多种氧化还原反应;
保护巯基酶的活性:使巯基酶的活性基团-SH维持还原状态;
维持红细胞膜结构的稳定:消除氧化剂对红细胞膜结构的破坏作用。
谷胱甘肽的生理功用:
多肽类激素主要见于下丘脑及垂体分泌的激素,如催产素(9肽)、加压素(9肽);
。
2. 多肽类激素:
3.神经肽
甲硫氨酸脑啡肽 Tyr–Gly–Gly–phe- Met
亮氨酸脑啡肽 Tyr-Gly-Gly-phe-Leu
功能:镇痛
如脑啡肽 (enkephalin)
同课章节目录
- 第一章 走近细胞
- 第1节 从生物圈到细胞
- 第2节 细胞的多样性和统一性
- 第二章 组成细胞的分子
- 第1节 细胞中的元素和化合物
- 第2节 生命活动的主要承担者──蛋白质
- 第3节 遗传信息的携带者──核酸
- 第4节 细胞中的糖类和脂质
- 第5节 细胞中的无机物
- 第三章 细胞的基本结构
- 第1节 细胞膜──系统的边界
- 第2节 细胞器──系统内的分工合作
- 第3节 细胞核──系统的控制中心
- 第四章 细胞的物质输入和输出
- 第1节 物质跨膜运输的实例
- 第2节 生物膜的流动镶嵌模型
- 第3节 物质跨膜运输的方式
- 第五章 细胞的能量供应和利用
- 第1节 降低化学反应活化能的酶
- 第2节 细胞的能量“通货”──ATP
- 第3节 ATP的主要来源──细胞呼吸
- 第4节 能量之源——光与光合作用
- 第六章 细胞的生命历程
- 第1节 细胞的增殖
- 第2节 细胞的分化
- 第3节 细胞的衰老和凋亡
- 第4节 细胞的癌变
