人教版高中化学必修二4.1.2《海水资源的开发利用》课件(31张PPT)
文档属性
| 名称 | 人教版高中化学必修二4.1.2《海水资源的开发利用》课件(31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-17 21:36:20 | ||
图片预览








文档简介
(共31张PPT)
第四章
化学与自然资源的开发利用
第一节
开发利用金属矿物和海水资源
第2课时
海水资源的开发利用
二、海水资源的开发和利用
从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中
是“历史留给人类的资源储备”
海洋是美丽的,
也是富饶的
海水资源主要分为几大类?
海水中含有多少种元素?
海水中蕴含着的丰富资源。21世纪人类将重点开发海洋资源。
海水中的化学资源和矿产资源
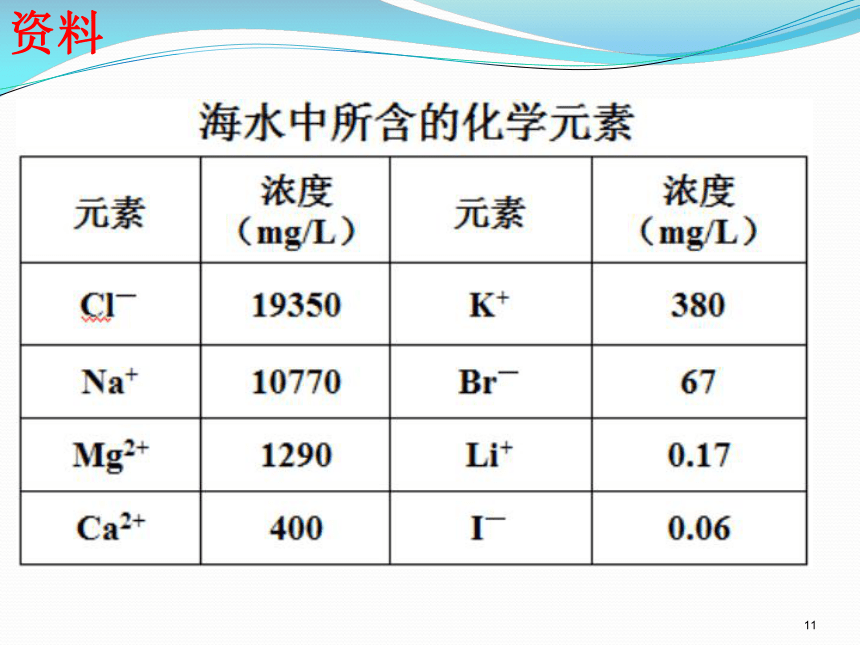
海水是元素的宝库,含有80多种元素
含80多种元素,以氢、氧、氯、钠、镁、硫、
钙、钾等较多。被称为“元素的故乡”。
海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。氘有50亿吨足够人类用上千万年
海水中的化学资源
海洋中的矿产资源
大陆架的浅海海底:
石油、天然气、
煤、硫、磷等
近岸带的滨海砂矿:
砂、贝壳等建筑
材料和金属矿产
海洋生物资源
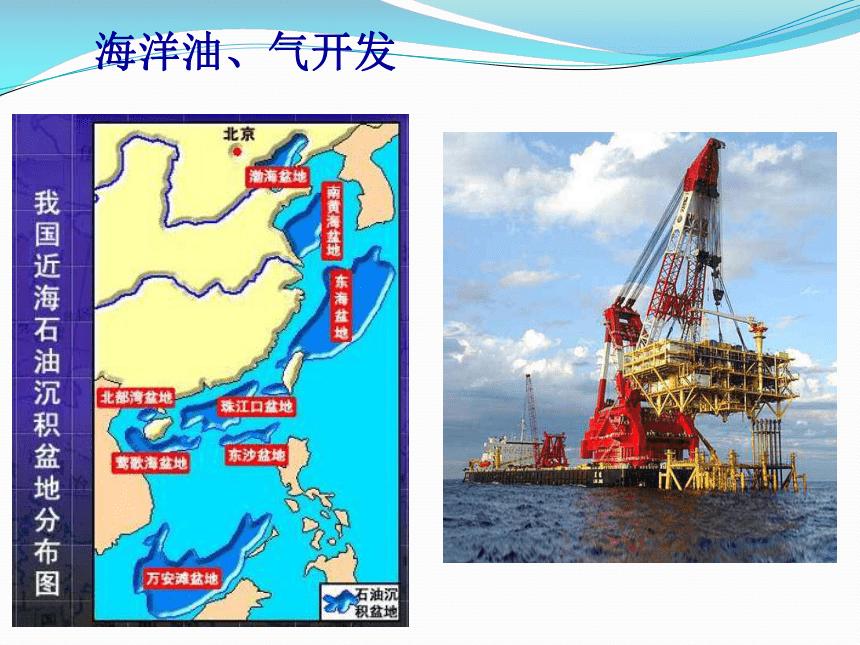
海洋油、气开发
海洋能源
具有商业开发价值的:潮汐发电和波浪发电
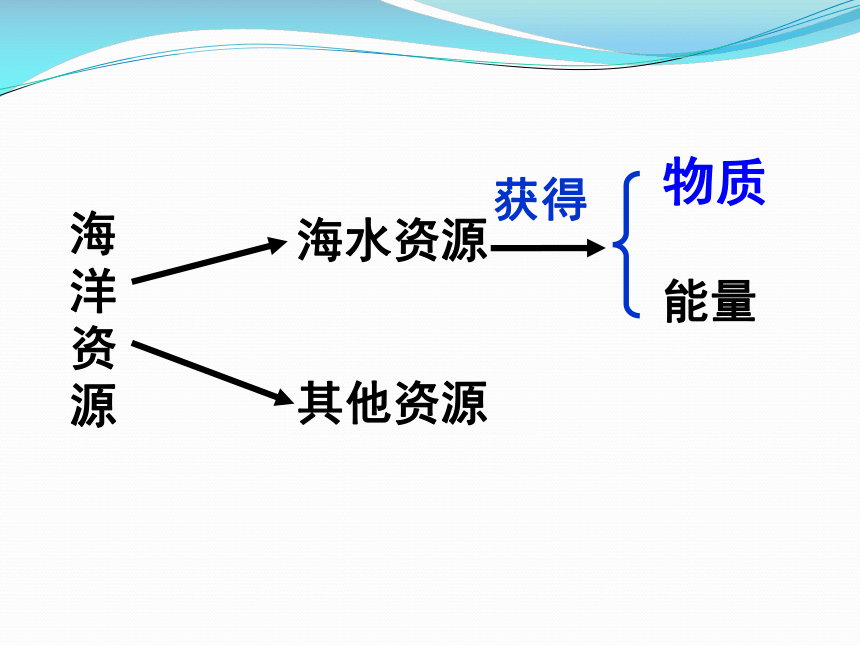
海水资源
其他资源
物质
海洋资源
能量
获得
资料
海水提Mg
海水淡化
海水提取NaCl
Br2的提取
海水综合利用联合工业体系一例
蒸馏法
加入沸石或碎瓷片
温度计水银球处于支管口处
冷水下进上出
液体体积不超过烧瓶体积1/3
原理:加热到水的沸点,液态水变为水蒸汽与海水中的盐分离,水蒸汽冷凝得到淡水
蒸馏适用于分离哪些混合物?
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
太阳能蒸发海水示意图
2、海水晒盐(海水中提取NaCl)
2
、从海水中提取NaCl方案
①Na2CO3
②NaOH
③BaCl2
②③①或③②①或③①②
粗盐中的杂质:
除杂试剂:
试剂加入顺序:
主要操作:
溶解、过滤、蒸发
④盐酸
粗盐
淡水
卤水
海水
盐水
滤液
沉淀
适量
盐酸
溶解
(含Mg+)
过滤
蒸发
结晶
泥沙、Ca2+、Mg2+、SO42-
物质提纯的方案设计一般思路:
分析混合物的组成
根据杂质的特点选择除杂试剂和分离方法
所加试剂的顺序、用量及过量后如何处理
3
、实验方案设计:
从海水中提取镁元素得到单质镁
卤水
Mg(OH)2
MgCl2
金属Mg
海水
从海水中的Mg2+到金属镁,经历了哪些化学变化,用化学方程式表示。
这个生产流程采用了哪些措施来提高经济效益?你获得了哪些启示?
海水提取镁的工艺流程图
引入海水
贝壳(CaCO3)
工业制镁流程
沉降池
过滤槽
Mg(OH)2
盐酸
锻烧产物
电解
MgCl2
金属镁
氯气
海水提镁的步骤为:
贝壳
生石灰
石灰乳
氢氧化镁
氯化镁
镁
写出有关的化学反应方程式:
a、
;
b、
;
c、
;
d、
;
e、
。
煅烧
a
水
b
海水
c
d
e
4
、科学探究:
如何证明海带中有碘元素?
证明海带中含有碘,有以下步骤:
①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤。
(1)合理的步骤是:
(2)证明含碘的步骤是:
现象是:
反应的离子方程式是:
③①④②
②
滴入淀粉溶液,溶液变蓝。
燃烧
加水
加热
溶解
过滤
CCl4
蒸馏
萃取
分液
5
、科学探究:
如何将海水中的溴离子转变成溴单质?
1、推测海水提溴的步骤和实验装置;
2、写出相关的化学方程式。
浓缩海水
溴单质
氢溴酸
单质溴
2NaBr
+
Cl2=
Br2+2NaCl
2H2O
+
Br2+SO2=
H2SO4+2HBr
2HBr
+
Cl2=
Br2+2HCl
海水提溴的实验室模拟装置
空气吹出法
思考2:萃取Br2、I2常用的萃取剂是什么?它们在萃取剂中一般呈现什么颜色?
归纳提升
用到了那些分离、提纯的方法?
海水综合利用联合工业体系一例
一位遇上海难的水手,随着木排在海上漂流。他用完了淡水,感到异常口渴,但他不喝海水,因为他知道海水会致命。原因是
(
)
A、海水有苦涩味,根本喝不下去
B、海水中含有多种盐,能使肠胃腐烂致人死亡
C、海水中有许多微生物,有些微生物能致人死亡
D、海水会造成人体水分从血液和组织内脱离出来,进入肠胃中,使人脱水死亡
想一想、猜一猜
D
本节课你的收获
提取物质的一般过程和方法
第四章
化学与自然资源的开发利用
第一节
开发利用金属矿物和海水资源
第2课时
海水资源的开发利用
二、海水资源的开发和利用
从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中
是“历史留给人类的资源储备”
海洋是美丽的,
也是富饶的
海水资源主要分为几大类?
海水中含有多少种元素?
海水中蕴含着的丰富资源。21世纪人类将重点开发海洋资源。
海水中的化学资源和矿产资源
海水是元素的宝库,含有80多种元素
含80多种元素,以氢、氧、氯、钠、镁、硫、
钙、钾等较多。被称为“元素的故乡”。
海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。氘有50亿吨足够人类用上千万年
海水中的化学资源
海洋中的矿产资源
大陆架的浅海海底:
石油、天然气、
煤、硫、磷等
近岸带的滨海砂矿:
砂、贝壳等建筑
材料和金属矿产
海洋生物资源
海洋油、气开发
海洋能源
具有商业开发价值的:潮汐发电和波浪发电
海水资源
其他资源
物质
海洋资源
能量
获得
资料
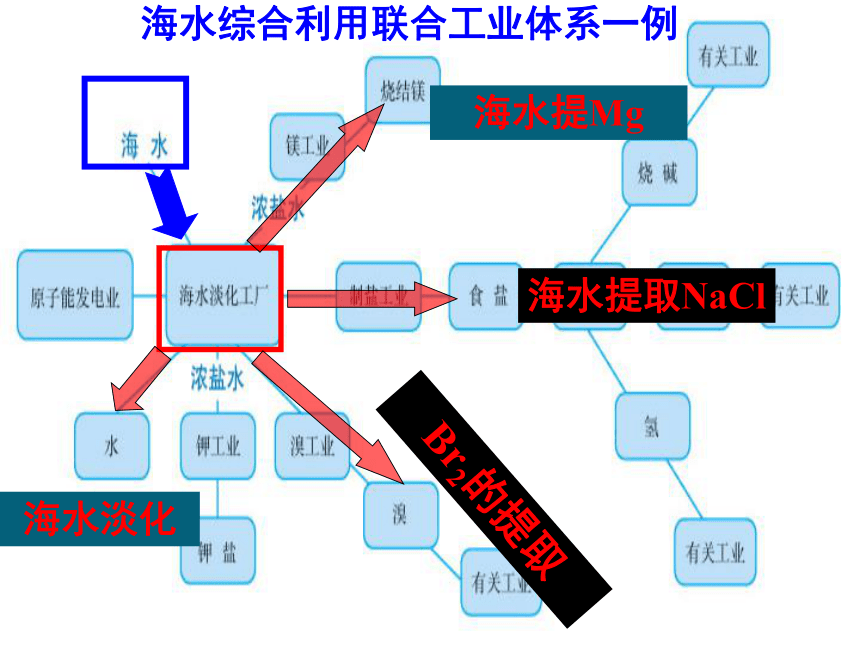
海水提Mg
海水淡化
海水提取NaCl
Br2的提取
海水综合利用联合工业体系一例
蒸馏法
加入沸石或碎瓷片
温度计水银球处于支管口处
冷水下进上出
液体体积不超过烧瓶体积1/3
原理:加热到水的沸点,液态水变为水蒸汽与海水中的盐分离,水蒸汽冷凝得到淡水
蒸馏适用于分离哪些混合物?
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
太阳能蒸发海水示意图
2、海水晒盐(海水中提取NaCl)
2
、从海水中提取NaCl方案
①Na2CO3
②NaOH
③BaCl2
②③①或③②①或③①②
粗盐中的杂质:
除杂试剂:
试剂加入顺序:
主要操作:
溶解、过滤、蒸发
④盐酸
粗盐
淡水
卤水
海水
盐水
滤液
沉淀
适量
盐酸
溶解
(含Mg+)
过滤
蒸发
结晶
泥沙、Ca2+、Mg2+、SO42-
物质提纯的方案设计一般思路:
分析混合物的组成
根据杂质的特点选择除杂试剂和分离方法
所加试剂的顺序、用量及过量后如何处理
3
、实验方案设计:
从海水中提取镁元素得到单质镁
卤水
Mg(OH)2
MgCl2
金属Mg
海水
从海水中的Mg2+到金属镁,经历了哪些化学变化,用化学方程式表示。
这个生产流程采用了哪些措施来提高经济效益?你获得了哪些启示?
海水提取镁的工艺流程图
引入海水
贝壳(CaCO3)
工业制镁流程
沉降池
过滤槽
Mg(OH)2
盐酸
锻烧产物
电解
MgCl2
金属镁
氯气
海水提镁的步骤为:
贝壳
生石灰
石灰乳
氢氧化镁
氯化镁
镁
写出有关的化学反应方程式:
a、
;
b、
;
c、
;
d、
;
e、
。
煅烧
a
水
b
海水
c
d
e
4
、科学探究:
如何证明海带中有碘元素?
证明海带中含有碘,有以下步骤:
①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤。
(1)合理的步骤是:
(2)证明含碘的步骤是:
现象是:
反应的离子方程式是:
③①④②
②
滴入淀粉溶液,溶液变蓝。
燃烧
加水
加热
溶解
过滤
CCl4
蒸馏
萃取
分液
5
、科学探究:
如何将海水中的溴离子转变成溴单质?
1、推测海水提溴的步骤和实验装置;
2、写出相关的化学方程式。
浓缩海水
溴单质
氢溴酸
单质溴
2NaBr
+
Cl2=
Br2+2NaCl
2H2O
+
Br2+SO2=
H2SO4+2HBr
2HBr
+
Cl2=
Br2+2HCl
海水提溴的实验室模拟装置
空气吹出法
思考2:萃取Br2、I2常用的萃取剂是什么?它们在萃取剂中一般呈现什么颜色?
归纳提升
用到了那些分离、提纯的方法?
海水综合利用联合工业体系一例
一位遇上海难的水手,随着木排在海上漂流。他用完了淡水,感到异常口渴,但他不喝海水,因为他知道海水会致命。原因是
(
)
A、海水有苦涩味,根本喝不下去
B、海水中含有多种盐,能使肠胃腐烂致人死亡
C、海水中有许多微生物,有些微生物能致人死亡
D、海水会造成人体水分从血液和组织内脱离出来,进入肠胃中,使人脱水死亡
想一想、猜一猜
D
本节课你的收获
提取物质的一般过程和方法
