课题3 溶液的浓度课件(共25张PPT含内嵌视频建议WPS打开)
文档属性
| 名称 | 课题3 溶液的浓度课件(共25张PPT含内嵌视频建议WPS打开) |

|
|
| 格式 | zip | ||
| 文件大小 | 16.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-18 09:12:19 | ||
图片预览






文档简介
(共25张PPT)
课题3
溶液的浓度
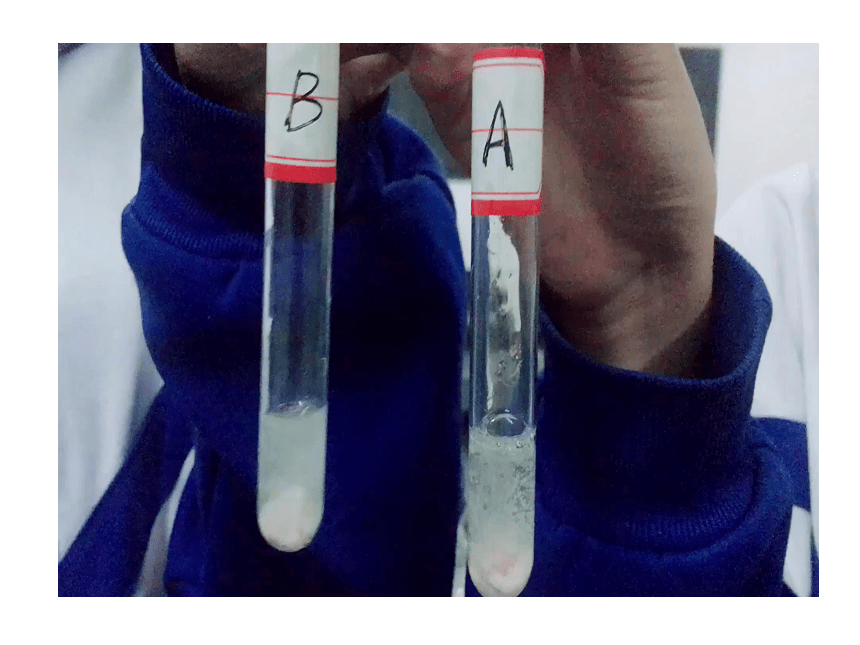
溶质种类相同的不同溶液,如何判断各溶液的浓和稀呢?
探究内容
取盐酸A、盐酸B各3mL
等量的碳酸钙
等量的碳酸钙
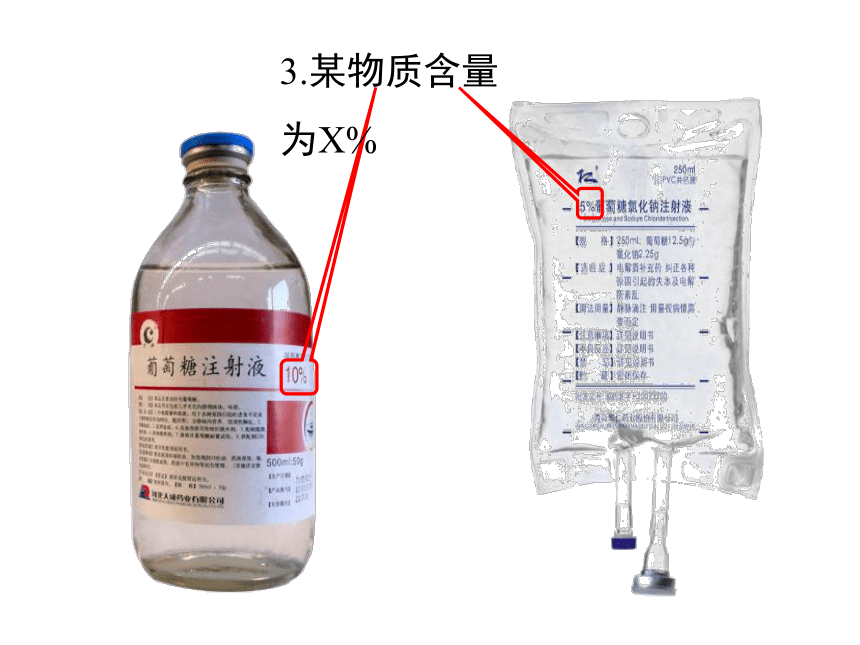
11.5%(V/V)
750mL
3.某物质含量为X%
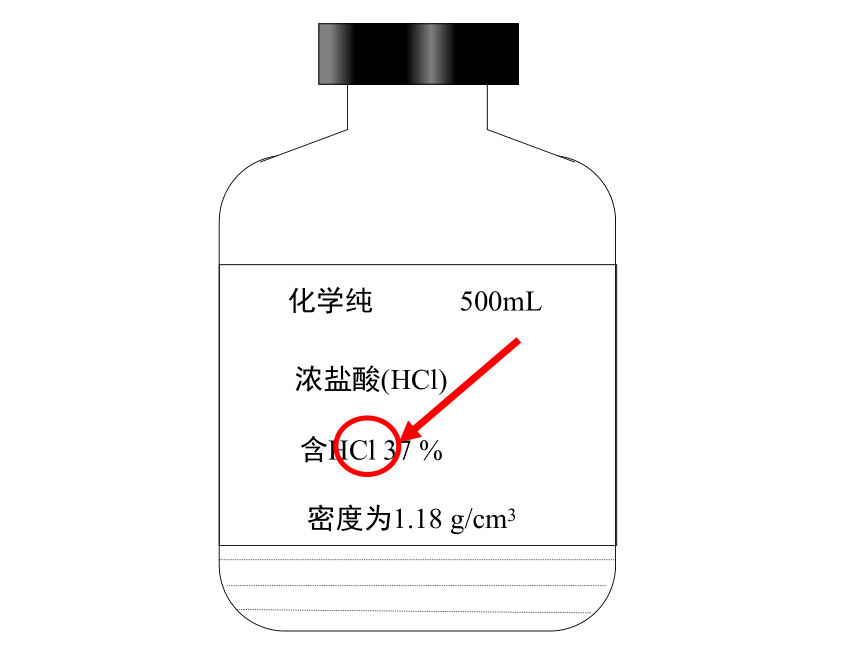
化学纯
500mL
浓盐酸(HCl)
含HCl
37
%
密度为1.18
g/cm3
1.
认识一种溶液组成的表示方法——溶质的质量分数。
2.能进行溶质的质量分数的简单计算。
探究目标
0.1g
0.5g
2g
溶质:
溶剂:
20g
20g
20g
×
0.1g
20.1g
100%
=
0.5%
C%
=
=
2.44%
0.5g
20.5g
100%
×
C%=
2g
22g
100%
×
=
9.09%
C%
=
1、定义:
溶质质量和溶液质量之比。
2、定义式:
溶质质量
溶液质量
?100%
溶质质量分数=
溶质质量
=
溶质质量+
溶剂质量
?100%
一、溶质的质量分数
【例题1】在农业生产上,常需要用
的氯化钠溶液选种。现要配制
,需要氯化钠和水的质量各是多少?
溶质的质量分数=
溶质质量
溶液质量
×100%
=150Kg
×
16%
解:
质量分数为16%
150Kg这种溶液
溶质质量=溶液质量×溶质的质量分数
溶剂质量=溶液质量-溶质质量
=24Kg
=150Kg
-
24Kg
=126Kg
答:配制150Kg质量分数为16%的氯化钠溶液,需24Kg氯化钠和126Kg水。
探究一:公式的换算运用
溶质质量
溶液质量
?100%
溶质质量分数=
计算的依据
:
溶质的质量
=溶液质量
×溶质质量分数
溶液的质量
=
溶质质量
溶质质量分数
小结:在溶液中知道任意两个量就可以求出第三个量。
探究一:公式的换算运用
溶液质量
溶剂质量
溶质质量
溶质的质量分数
100g
90g
200g
15%
380g
20g
10g
170g
30g
400g
10%
5%
比一比:看谁又快又准?
解:
加水:
加盐:
20g10%食盐溶液
20g10%食盐溶液
2g水
2g食盐
20g
×10%
20g
+2g
=9.1%
C%
=
20g
×10%+2g
20g
+2g
=18.2%
+2
C%
=
合作探究
?100%
?100%
从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么?
关键是准确找出溶质和溶液的质量
将上述20g
10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
答:剩余溶液的溶质质量分数不变,仍是
10
%
议一议
看谁脑瓜最聪明?
合作探究
20克氯化钠
80克水
30克氯化钠
70克水
10克氯化钠
90克水
实验探究
编号
溶质质量/g
溶剂质量/g
现象
溶质的质量分数
1
10
90
2
20
80
3
30
70
完全溶解
10%
完全溶解
20%
未完全溶解
?
讨论:已知20℃时,氯化钠的溶解度为36g。有人说:“20℃时氯化钠饱和溶液中溶质的溶质质量分数36%。”这种说法对吗?为什么?
溶质的质量分数36%
是指:
100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指:
在200C
时,100g水中最多溶解该溶质36g。
解:20℃时食盐饱和溶液的溶质质量分数为
=
26.5%
36g
100g+36g
合作探究:饱和溶液溶质质量分数的计算
?100%
饱和溶液的
溶质质量分数
溶解度
100g+溶解度
=
(注:T,S)
※
?100%
实验探究
编号
溶质质量/g
溶剂质量/g
现象
溶质的质量分数
1
10
90
2
20
80
3
30
70
完全溶解
10%
完全溶解
20%
C%
=
——————
×100%
未完全溶解
?
20℃:
36g
100g+36g
1.
80℃时,a的溶解度是(
)
2.80℃时,a的饱和溶液的质量分数是(
)
(只需列计算式)
85g
85g
100g+85g
?100%
溶质质量
溶液质量
?100%
溶质质量分数=
(溶质的质量
=
溶液质量
×溶质质量分数)
1.溶质的质量分数
2.饱和溶液溶质质量分数计算
溶解度
100g+溶解度
(已知:T,S)
溶质质量分数=
退
出
探究小结
?100%
课题3
溶液的浓度
溶质种类相同的不同溶液,如何判断各溶液的浓和稀呢?
探究内容
取盐酸A、盐酸B各3mL
等量的碳酸钙
等量的碳酸钙
11.5%(V/V)
750mL
3.某物质含量为X%
化学纯
500mL
浓盐酸(HCl)
含HCl
37
%
密度为1.18
g/cm3
1.
认识一种溶液组成的表示方法——溶质的质量分数。
2.能进行溶质的质量分数的简单计算。
探究目标
0.1g
0.5g
2g
溶质:
溶剂:
20g
20g
20g
×
0.1g
20.1g
100%
=
0.5%
C%
=
=
2.44%
0.5g
20.5g
100%
×
C%=
2g
22g
100%
×
=
9.09%
C%
=
1、定义:
溶质质量和溶液质量之比。
2、定义式:
溶质质量
溶液质量
?100%
溶质质量分数=
溶质质量
=
溶质质量+
溶剂质量
?100%
一、溶质的质量分数
【例题1】在农业生产上,常需要用
的氯化钠溶液选种。现要配制
,需要氯化钠和水的质量各是多少?
溶质的质量分数=
溶质质量
溶液质量
×100%
=150Kg
×
16%
解:
质量分数为16%
150Kg这种溶液
溶质质量=溶液质量×溶质的质量分数
溶剂质量=溶液质量-溶质质量
=24Kg
=150Kg
-
24Kg
=126Kg
答:配制150Kg质量分数为16%的氯化钠溶液,需24Kg氯化钠和126Kg水。
探究一:公式的换算运用
溶质质量
溶液质量
?100%
溶质质量分数=
计算的依据
:
溶质的质量
=溶液质量
×溶质质量分数
溶液的质量
=
溶质质量
溶质质量分数
小结:在溶液中知道任意两个量就可以求出第三个量。
探究一:公式的换算运用
溶液质量
溶剂质量
溶质质量
溶质的质量分数
100g
90g
200g
15%
380g
20g
10g
170g
30g
400g
10%
5%
比一比:看谁又快又准?
解:
加水:
加盐:
20g10%食盐溶液
20g10%食盐溶液
2g水
2g食盐
20g
×10%
20g
+2g
=9.1%
C%
=
20g
×10%+2g
20g
+2g
=18.2%
+2
C%
=
合作探究
?100%
?100%
从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么?
关键是准确找出溶质和溶液的质量
将上述20g
10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
答:剩余溶液的溶质质量分数不变,仍是
10
%
议一议
看谁脑瓜最聪明?
合作探究
20克氯化钠
80克水
30克氯化钠
70克水
10克氯化钠
90克水
实验探究
编号
溶质质量/g
溶剂质量/g
现象
溶质的质量分数
1
10
90
2
20
80
3
30
70
完全溶解
10%
完全溶解
20%
未完全溶解
?
讨论:已知20℃时,氯化钠的溶解度为36g。有人说:“20℃时氯化钠饱和溶液中溶质的溶质质量分数36%。”这种说法对吗?为什么?
溶质的质量分数36%
是指:
100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指:
在200C
时,100g水中最多溶解该溶质36g。
解:20℃时食盐饱和溶液的溶质质量分数为
=
26.5%
36g
100g+36g
合作探究:饱和溶液溶质质量分数的计算
?100%
饱和溶液的
溶质质量分数
溶解度
100g+溶解度
=
(注:T,S)
※
?100%
实验探究
编号
溶质质量/g
溶剂质量/g
现象
溶质的质量分数
1
10
90
2
20
80
3
30
70
完全溶解
10%
完全溶解
20%
C%
=
——————
×100%
未完全溶解
?
20℃:
36g
100g+36g
1.
80℃时,a的溶解度是(
)
2.80℃时,a的饱和溶液的质量分数是(
)
(只需列计算式)
85g
85g
100g+85g
?100%
溶质质量
溶液质量
?100%
溶质质量分数=
(溶质的质量
=
溶液质量
×溶质质量分数)
1.溶质的质量分数
2.饱和溶液溶质质量分数计算
溶解度
100g+溶解度
(已知:T,S)
溶质质量分数=
退
出
探究小结
?100%
同课章节目录
