苏教版必修2第1专题“微观结构与物质的多样性”专题复习 第1课时(课件49页)
文档属性
| 名称 | 苏教版必修2第1专题“微观结构与物质的多样性”专题复习 第1课时(课件49页) |  | |
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-18 16:52:42 | ||
图片预览









文档简介
(共49张PPT)
苏教版
化学
必修2
专题1
微观结构与物质的多样性
专题复习
第1课时
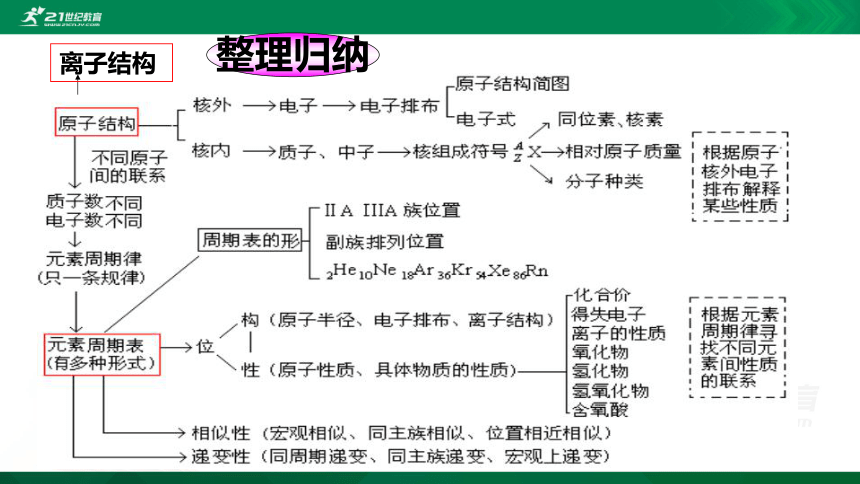
离子结构
整理归纳
练习:
解析:图①道尔顿的是实心球模型,图②是汤姆生的“葡萄干布丁模型”,图③是玻尔的核外电子分层排布模型,故选B。
B
H
H
He
Li
多
(一)原子结构
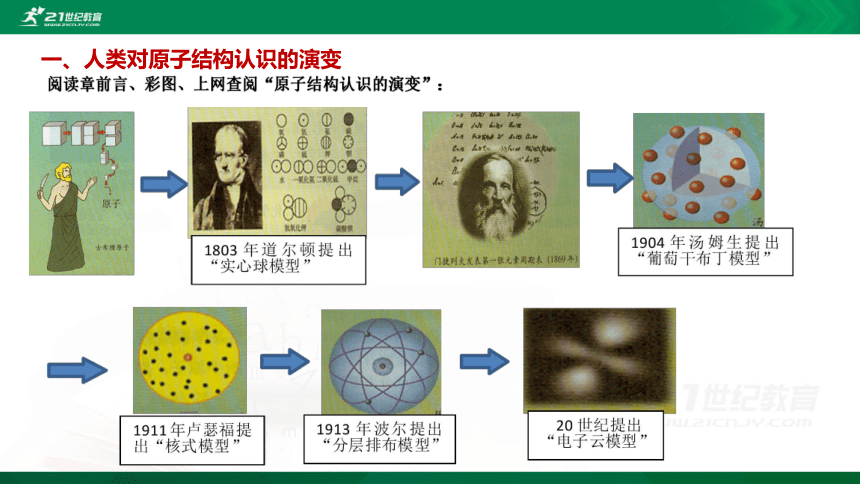
1.原子结构模型的演变
人类对原子结构的认识是逐渐深入的,每前进一步,都建立在_________的基础之上。_________是揭示原子结构奥秘的重要手段。
原子结构模型的演变图如下:
①为道尔顿实心球式原子模型;②为汤姆生葡萄干面包式原子模型;③为卢瑟福行星运转式原子模型;④为玻尔轨道式原子模型;⑤为近代量子力学原子模型。
实验研究
科学研究
2.构成原子的微粒及作用
质子(Z个)——决定_____的种类
原子核
在质子数确定后
决定_____种类
同位素
核外电子(Z个)——最外层电子数决定元素的_____性质
中子[(A-Z)个
原子
化学
元素
3.微粒之间的关系
(1)原子中:质子数(Z)=核电荷数=___________;
(2)质量数(A)=_______
(Z)+_______
(N);
(3)阳离子的核外电子数=质子数-___________________;
(4)阴离子的核外电子数=质子数+___________________。
核外电子数
质子数
中子数
阳离子所带的电荷数
阴离子所带的电荷数
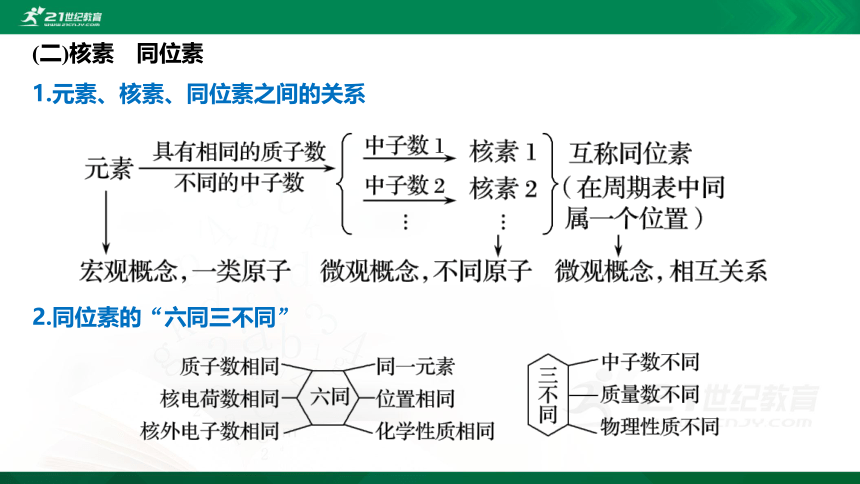
(二)核素 同位素
1.元素、核素、同位素之间的关系
2.同位素的“六同三不同”
问题思考
(2)互为同素异形体的微粒是__________。
(4)上述9种微粒中有____种核素,含有____种元素。
核素
同位素
30
24
7
5
求完成以下各题:
(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( )
(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同( )
(3)核聚变如
,因为有新微粒生成,所以该变化是化学变化
( )
(4)中子数不同而质子数相同的微粒一定互为同位素( )
(5)通过化学变化可以实现16O与18O间的相互转化( )
(6)
得电子能力几乎相同( )
√
×
×
×
√
√
题组一 微粒组成及数量关系判断
1.(2019·温州中学高三质检)已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是
√
解析 依据阳离子核外电子数=质子数-所带电荷数,可知质子数=阳离子核外电子数+所带电荷数,R2+核外有a个电子,所以其质子数为a+2;依据质量数=质子数+中子数,R2+有b个中子,所以其质量数为a+2+b,所以R原子符号为
,答案选C。
变式1.(2018·
宁波市余姚中学高三调研)已知R元素的某种同位素能形成离子化合物AmRn,其中A的化合价为+n。该化合物中一个R微粒的核外电子数是a,核内中子数是b,则x
g该同位素的原子所含电子的物质的量(mol)为
解析 该离子化合物中R的化合价是-m价,该化合物中一个R微粒的核外电子数是a,则R的质子数是a-m,核内中子数是b,则R的质量数是a-m+b,因此x
g该同位素的原子所含电子的物质的量为
√
变式2..现有下列几组粒子:
CN-;
对上述四组粒子归类正确的是
A.质子数相等、电子数和原子数不相等:①
B.质子数和电子数相等、原子数不相等:②
C.电子数相等、质子数和原子数不相等:③
D.原子数和电子数相等、质子数不相等:④
√
题组二 同位素、核素、同素异形体
2.(2018·嘉兴市第一中学高三联考)
是常规核裂变产物之一,可以通过测定大气或水中
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的叙述正确的是
√
D.氧元素的相对原子质量为(16a%+17b%+18c%)
变式1..氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则下列说法正确的是
A.一个16O原子的质量为16
g
B.17O的相对原子质量约为17
√
1.能量规律
核外电子总是先排布在能量最低的电子层里,然后再按照由里向外的顺序依次排布在能量逐渐升高的电子层里。
2.排布规律
2n2
8
2
18
32
特别提醒 核外电子的排布规律是相互联系的,不能孤立地理解,必须同时满足各项要求,如M层不是最外层时,最多能容纳18个电子,当M层为最外层时,最多容纳8个电子。
(三)核外电子排布
问题思考
现有六种粒子的结构示意图分别为
请回答下列问题
(1)依次写出6种粒子的符号:____________________________。
(2)A、B、C、D、E、F共表示___种元素、___种原子、___种阳离子、___种阴离子。
(3)上述微粒中,阴离子与阳离子可构成两种化合物,这两种化合物的化学式为___________。
F、F-、Ne、Na+、Mg2+、Mg
4
3
2
1
NaF、MgF2
(1)最外层电子数为8的粒子一定是稀有气体元素原子(
)
(2)某原子M层上的电子数为L层上电子数的4倍( )
(3)最外层电子数相同的元素,其化学性质一定相同( )
(4)某元素原子的最外层电子数是次外层的a倍(a>1),则该原子核外电子排布只有两层( )
(5)同一原子核外的M层上电子数一定比L层上的电子数多( )
(6)He、Ne两种元素原子每层电子容纳的电子数都满足2n2( )
(7)某离子M层和L层上的电子数可以均为K层的4倍( )
√
×
×
×
√
√
×
1.元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子。X和Y所形成的稳定化合物的摩尔质量为
A.148
g·mol-1
B.100
g·mol-1
C.90
g·mol-1
D.38
g·mol-1
√
解析 K层是最里层,有2个电子,M层与K层电子数相同,所以M层有2个电子,所以K、L、M层电子数分别是2、8、2,所以X是Mg(镁);Y的L层上有5个电子,说明没有全充满,所以K、L层电子数分别是2、5,所以Y是N(氮),所以Mg和N形成的稳定化合物为Mg3N2,摩尔质量:(3×24+2×14)g·mol-1=100
g·mol-1。
题组一 微粒组成及数量关系判断
变式1.(2019·温州中学高三模拟)核电荷数为1~18的元素中,最外层电子数是电子层数3倍的原子
A.只有4种
B.只有3种
C.只有2种
D.只有1种
√
解析 核电荷数为1~18的元素中,最外层电子数是电子层数3倍的原子只有O一种元素的原子,故答案选D。
变式1.已知X、Y是原子核电荷数不大于18的元素。X原子的最外层电子数为a,次外层电子数为a+2,Y原子的最外层电子数为b-5,次外层电子数为b,则X、Y两元素形成化合物的组成是
A.XY2
B.X4X
C.Y2X3
D.YX3
√
解析 X元素应为S,Y元素为Al,所以X、Y两种元素形成的化合物为Al2S3。
2He
10
Ne
18
Ar
36
Kr
54
Xe
86
Rn
2
8
18
18
32
8
32
118
(四)元素周期表和周期律
1.原子序数:按照核电荷数由小到大的顺序给元素编号,称之为__________,_________=核电荷数=质子数=核外电子数。
2.编排原则
(1)周期:把_________相同的元素,按______________的顺序,从左至右排成的横行。
(2)族:把_____________相同的元素,按______________的顺序,从上至下排成的纵列。
原子序数
原子序数
电子层数
原子序数递增
最外层电子数
电子层数递增
3.元素周期表的结构
元素周期表
周期(7个)
___周期
第1、2、3周期
元素种数分别为__、__、__种
___周期
第4、5、6、7周期
元素种数分别为___、___、___、32种
族(16个)
主族:由_______________共同构成,共__个
副族:完全由长周期元素构成,共__个
第Ⅷ族:第_________共3个纵列
0族:第___纵列
短
长
2
8
8
18
18
32
短周期和长周期
8、9、10
18
7
7
1.利用“构-位-性”的关系指导化学学习
原子结构
表中位置
元素性质
原子序数=
核电荷数
周期数=
电子层数
主族序数=最外层电子数
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
(主族)最外层电子数
=
最高正价
最外层电子数-8
=
负价
大→小
小→大
电子层数相同、最外层电子增多
逐渐减小
逐渐增大
逐渐增大
逐渐减小
金属性减、非金属性增
金属性增、非金属性减
最高正价+1→+7
最高正价=族系数
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
形成:难→易
稳定性:弱→强
形成:易→难
稳定性:强→弱
电子层增多
最外层电子数相同
2.元素性质递变规律
内容
同周期(从左到右)
同主族(从上到下)
原子半径
电子层结构
失电子能力
得电子能力
金属性非金属性
主要化合价
最高价氧化物对应的水化物酸碱性
非金属元素气态氢
化物的形成与稳定性
族
周期
原子半径逐渐减小
原子半径增大
金属性减弱,非金属性增强
金属性增强
非金属性增强
稀有气体元素
金属性增强
非金属区域
金属区域
元素金属性和非金属性的递变
注意:位于分界线附近的元素,既表现出一定的金属性,又
表现出一定的非金属性。如Be(OH)2具有两性。
讨论:每一周期最后一个金属元素的最外层电子数与电子层
数(周期序数)有什么关系?
金属元素的最外层电子数≤原子核外电子层数(H例外)
原子半径减小
原子半径逐渐增大
3.元素的金属性和非金属性与周期表中位置的关系
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
3
4
5
6
(1)两短周期元素原子序数相差8,则周期数一定相差1( )
(2)最外层电子数是2的元素,都是ⅡA族元素( )
(3)位于同一周期的甲、乙两种元素,甲位于ⅠA族,原子序数为x,乙位于ⅢA族,则乙的原子序数可能为x+12( )
(4)铁位于元素周期表的第4周期ⅧB族( )
(5)位于同一主族的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4( )
√
×
×
×
√
题组一 元素周期表结构的考查
1.(2019·杭州高三月考)以下关于元素周期表的结构叙述正确的是
A.有七个主族,八个副族
B.有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.0族位于元素周期表的第18列(从左往右)
D.第ⅢA族位于元素周期表的第三列(从左往右)
√
变式1
.根据原子序数推断元素
(1)56号元素位于第____周期_____族。
(2)114号元素位于第____周期_____族。
(3)25号元素位于第____周期____族。
6
ⅡA
7
ⅣA
4
ⅦB
变式2.结合元素周期表回答下列问题:
(2)元素f是第____周期_____族元素,请在方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。
3
ⅥA
答案
(3)简述元素在元素周期表中的位置与元素原子结构的关系:________________
_______________________________________________________________。
元素所在的主族序数等于原子的最外层电子数,元素所在的周期数等于原子的电子层数
题组二 元素周期表中特殊位置元素原子序数关系
2.第ⅡA族相邻周期的A、B两种元素所在周期分别最多可排m和n种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数可能为
A.x-n
B.x+m
C.x-m
D.x+n
√
解析 A、B同在第ⅡA族,B在A的上一周期时,A和B的原子序数之差恰好为B所在周期的元素种类数,已知A、B两种元素所在周期分别最多可排m和n种元素,所以当A的原子序数为x时,B的原子序数为x-n,故合理选项是A。
变式1
.第ⅢA族相邻周期的A、B两种元素所在周期分别最多可排m和n种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数可能为
A.x-n
B.x+m
C.x-m
D.x+n
√
变式2
.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为
A.5x+10
B.5x
C.5x+14
D.5x+16
√
解析
变式1.下列各图为周期表中的一部分,原子序数与其位置不相符的是( )
解析 在B选项中,4号元素在第ⅡA族,5号元素在第ⅢA族,第ⅡA族和第ⅢA族在周期表中不相邻。
答案 B
题组三 元素周期表中元素的推断
3.下列各表是元素周期表的一部分,表中数字表示的原子序数与其在周期表中的位置相符合的是
√
变式2:A、B分别为第3、4两周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数。①若A为ⅡA族,其质量数为X,则B的质子数为Y;②若A为ⅣA族,其质子数为m,则B质量数为n,则Y和n的值是
√
元素周期表的特殊结构及位置与原子序数的关系
1.
元素周期表的特殊结构及位置与原子序数的关系
3.(2018·4月浙江选考,12)四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )
A.原子半径(r)大小比较:r(X)>r(Y)
B.X和W可形成共价化合物XW3
C.W的非金属性比Z的强,所以W氢化物的沸点比Z的高
D.Z的最低价单核阴离子的失电子能力比Y的强
答案 C
变式1.(2018·温州模拟)A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
A.Be、Na、Al
B.B、Mg、Si
C.O、P、Cl
D.C、Al、P
√
解析 设A的原子序数为x,则B的原子序数为x+8-1,C的原子序数为x+8+1,(x+8-1)+(x+8+1)=4x,解得x=8,所以A为O元素,B为P元素,C为Cl元素,故选C。
变式2.
W、X、Y、Z、R为五种短周期主族非金属元素,它们在元素周期表中的相对位置如图所示。下列关于五种元素的说法正确的是( )
A.粒子半径:原子半径最大的是W,简单阴离子半径最小的是R
B.单质:氧化性最强的是Z,还原性最强的是Y
C.最高价氧化物对应的水化物:酸性最强的是Z,水溶性最差的是Y
D.最简单氢化物:沸点最高的是X,稳定性最差的是W
答案 C
复习:①半径比较;②金属(非金属)性比较;③最高级金属(非金属)氧化物水化物碱(酸)性比较;④气态氢化物稳定性比较
?
W
X
R
Y
?
?
Z
变式3.(2018·浙江杭州十四中高三模拟)右表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
A.X、W、Z元素的原子半径及它们的最简单气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
答案 D
题组三 元素的金属性、非金属性判断
4.下列不能说明氯元素的非金属性比硫元素强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤
B.①②
C.①②④
D.①③⑤
√
变式1.依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物NH3、H2O、HF的稳定性
C.碱金属单质Li、Na、K与水反应的剧烈程度
D.1
mol
Na、Mg、Al分别与足量盐酸反应时失电子数的多少
√
变式2.下列实验不能达到实验目的的是
√
选项
实验操作
实验目的
A
Cl2、Br2分别与H2反应
比较氯、溴的非金属性强弱
B
向MgCl2、AlCl3溶液中分别通入NH3
比较镁、铝的金属性强弱
C
测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH
比较C、S的非金属性强弱
D
Fe、Cu分别与稀盐酸反应
比较Fe、Cu的金属性强弱
变式3.利用图示装置进行下列实验,能达到实验目的的是
√
选项
溶液a
固体b
溶液c
实验目的:验证
A
浓硝酸
NaHCO3
Na2SiO3
非金属性:N>C>Si
B
浓盐酸
KMnO4
Na2S
氧化性:KMnO4>Cl2>S
C
浓盐酸
CaCO3
NaAlO2
酸性:HCl>H2CO3>Al(OH)3
D
浓氨水
CaO
酚酞溶液
NH3·H2O是弱碱
题组四 元素金属性、非金属性强弱的实验设计
4.某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1
mol分别投入到足量的0.1
mol·L-1的盐酸中,试预测实验结果:____与盐酸反应最剧烈,____与盐酸反应最慢。
钾
铝
解析 金属性:K>Na>Mg>Al,故钾与盐酸反应最剧烈,铝与盐酸反应最慢。
(2)将NaOH与NH4Cl溶液混合生成NH3·H2O从而验证NaOH的碱性强于NH3·H2O,继而可以验证Na的金属性强于N,你认为此设计是否合理?并说明理由:____
____________________________________________________________________________________________________________________________。
理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3·H2O不是N元素最高价氧化物对应的水化物
不合
Ⅱ.利用如图装置可以验证非金属性的变化规律。
(3)仪器A的名称为_________,干燥管D的作用是_________。
解析 若A、B中的物质反应产生的气体易溶于C中的液体,则易发生倒吸现象,干燥管D可以防止C中的液体倒吸到烧瓶中。
分液漏斗
防止倒吸
(4)实验室中现有药品Na2S溶液、KMnO4溶液、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫;装置A、B、C中所装药品分别为_______、_______、_________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
解析 由题中所给药品可知,可用Na2S与Cl2发生置换反应判断氯与硫的非金属性强弱,因为无加热装置,所以只能选择KMnO4与浓盐酸反应制取氯气。
浓盐酸
KMnO4
Na2S溶液
S2-+Cl2===S↓+2Cl-
(5)若要证明非金属性:S>C>Si,则A中加_______、B中加Na2CO3、C中加____________,观察到C中溶液的现象为___________________。
解析 由B中药品Na2CO3可知,用最高价氧化物对应水化物的酸性强弱来判断非金属性强弱,所以A中加入稀硫酸,B、C装置中加入相应的盐溶液。
稀硫酸
Na2SiO3溶液
有白色胶状沉淀产生
下列说法正确的是
A.E与B的简单离子的电子层结构
相同,且简单离子半径BB.④⑥中依次盛装的试剂可以是
NaOH溶液、碱石灰
C.D元素形成的单质与A2C不反应
D.实验结束后,取⑤中的少量产物于试管中,加适量蒸馏水,可以产生使试管
口湿润的红色石蕊试纸变蓝的气体
变式1.短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和D同主族,B和C相邻,F的最高价氧化物对应的水化物为无机含氧酸中的最强酸。E与B可组成化合物E3B2,且该物质遇水发生水解反应。已知利用如图所示装置以制备E3B2,装置①用于制备B单质。
√
规避金属性和非金属性判断中的易错点
(1)对于主族元素而言,元素的最高正化合价和主族序数相同,但是氧无最高正价,氟无正价,一般为零价或负价。
(2)判断元素非金属性或金属性的强弱,依据是元素原子在化学反应中得失电子的难易而不是得失电子数目的多少。
(3)根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物的水化物。
练后反思
苏教版
化学
必修2
专题1
微观结构与物质的多样性
专题复习
第1课时
离子结构
整理归纳
练习:
解析:图①道尔顿的是实心球模型,图②是汤姆生的“葡萄干布丁模型”,图③是玻尔的核外电子分层排布模型,故选B。
B
H
H
He
Li
多
(一)原子结构
1.原子结构模型的演变
人类对原子结构的认识是逐渐深入的,每前进一步,都建立在_________的基础之上。_________是揭示原子结构奥秘的重要手段。
原子结构模型的演变图如下:
①为道尔顿实心球式原子模型;②为汤姆生葡萄干面包式原子模型;③为卢瑟福行星运转式原子模型;④为玻尔轨道式原子模型;⑤为近代量子力学原子模型。
实验研究
科学研究
2.构成原子的微粒及作用
质子(Z个)——决定_____的种类
原子核
在质子数确定后
决定_____种类
同位素
核外电子(Z个)——最外层电子数决定元素的_____性质
中子[(A-Z)个
原子
化学
元素
3.微粒之间的关系
(1)原子中:质子数(Z)=核电荷数=___________;
(2)质量数(A)=_______
(Z)+_______
(N);
(3)阳离子的核外电子数=质子数-___________________;
(4)阴离子的核外电子数=质子数+___________________。
核外电子数
质子数
中子数
阳离子所带的电荷数
阴离子所带的电荷数
(二)核素 同位素
1.元素、核素、同位素之间的关系
2.同位素的“六同三不同”
问题思考
(2)互为同素异形体的微粒是__________。
(4)上述9种微粒中有____种核素,含有____种元素。
核素
同位素
30
24
7
5
求完成以下各题:
(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( )
(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同( )
(3)核聚变如
,因为有新微粒生成,所以该变化是化学变化
( )
(4)中子数不同而质子数相同的微粒一定互为同位素( )
(5)通过化学变化可以实现16O与18O间的相互转化( )
(6)
得电子能力几乎相同( )
√
×
×
×
√
√
题组一 微粒组成及数量关系判断
1.(2019·温州中学高三质检)已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是
√
解析 依据阳离子核外电子数=质子数-所带电荷数,可知质子数=阳离子核外电子数+所带电荷数,R2+核外有a个电子,所以其质子数为a+2;依据质量数=质子数+中子数,R2+有b个中子,所以其质量数为a+2+b,所以R原子符号为
,答案选C。
变式1.(2018·
宁波市余姚中学高三调研)已知R元素的某种同位素能形成离子化合物AmRn,其中A的化合价为+n。该化合物中一个R微粒的核外电子数是a,核内中子数是b,则x
g该同位素的原子所含电子的物质的量(mol)为
解析 该离子化合物中R的化合价是-m价,该化合物中一个R微粒的核外电子数是a,则R的质子数是a-m,核内中子数是b,则R的质量数是a-m+b,因此x
g该同位素的原子所含电子的物质的量为
√
变式2..现有下列几组粒子:
CN-;
对上述四组粒子归类正确的是
A.质子数相等、电子数和原子数不相等:①
B.质子数和电子数相等、原子数不相等:②
C.电子数相等、质子数和原子数不相等:③
D.原子数和电子数相等、质子数不相等:④
√
题组二 同位素、核素、同素异形体
2.(2018·嘉兴市第一中学高三联考)
是常规核裂变产物之一,可以通过测定大气或水中
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的叙述正确的是
√
D.氧元素的相对原子质量为(16a%+17b%+18c%)
变式1..氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则下列说法正确的是
A.一个16O原子的质量为16
g
B.17O的相对原子质量约为17
√
1.能量规律
核外电子总是先排布在能量最低的电子层里,然后再按照由里向外的顺序依次排布在能量逐渐升高的电子层里。
2.排布规律
2n2
8
2
18
32
特别提醒 核外电子的排布规律是相互联系的,不能孤立地理解,必须同时满足各项要求,如M层不是最外层时,最多能容纳18个电子,当M层为最外层时,最多容纳8个电子。
(三)核外电子排布
问题思考
现有六种粒子的结构示意图分别为
请回答下列问题
(1)依次写出6种粒子的符号:____________________________。
(2)A、B、C、D、E、F共表示___种元素、___种原子、___种阳离子、___种阴离子。
(3)上述微粒中,阴离子与阳离子可构成两种化合物,这两种化合物的化学式为___________。
F、F-、Ne、Na+、Mg2+、Mg
4
3
2
1
NaF、MgF2
(1)最外层电子数为8的粒子一定是稀有气体元素原子(
)
(2)某原子M层上的电子数为L层上电子数的4倍( )
(3)最外层电子数相同的元素,其化学性质一定相同( )
(4)某元素原子的最外层电子数是次外层的a倍(a>1),则该原子核外电子排布只有两层( )
(5)同一原子核外的M层上电子数一定比L层上的电子数多( )
(6)He、Ne两种元素原子每层电子容纳的电子数都满足2n2( )
(7)某离子M层和L层上的电子数可以均为K层的4倍( )
√
×
×
×
√
√
×
1.元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子。X和Y所形成的稳定化合物的摩尔质量为
A.148
g·mol-1
B.100
g·mol-1
C.90
g·mol-1
D.38
g·mol-1
√
解析 K层是最里层,有2个电子,M层与K层电子数相同,所以M层有2个电子,所以K、L、M层电子数分别是2、8、2,所以X是Mg(镁);Y的L层上有5个电子,说明没有全充满,所以K、L层电子数分别是2、5,所以Y是N(氮),所以Mg和N形成的稳定化合物为Mg3N2,摩尔质量:(3×24+2×14)g·mol-1=100
g·mol-1。
题组一 微粒组成及数量关系判断
变式1.(2019·温州中学高三模拟)核电荷数为1~18的元素中,最外层电子数是电子层数3倍的原子
A.只有4种
B.只有3种
C.只有2种
D.只有1种
√
解析 核电荷数为1~18的元素中,最外层电子数是电子层数3倍的原子只有O一种元素的原子,故答案选D。
变式1.已知X、Y是原子核电荷数不大于18的元素。X原子的最外层电子数为a,次外层电子数为a+2,Y原子的最外层电子数为b-5,次外层电子数为b,则X、Y两元素形成化合物的组成是
A.XY2
B.X4X
C.Y2X3
D.YX3
√
解析 X元素应为S,Y元素为Al,所以X、Y两种元素形成的化合物为Al2S3。
2He
10
Ne
18
Ar
36
Kr
54
Xe
86
Rn
2
8
18
18
32
8
32
118
(四)元素周期表和周期律
1.原子序数:按照核电荷数由小到大的顺序给元素编号,称之为__________,_________=核电荷数=质子数=核外电子数。
2.编排原则
(1)周期:把_________相同的元素,按______________的顺序,从左至右排成的横行。
(2)族:把_____________相同的元素,按______________的顺序,从上至下排成的纵列。
原子序数
原子序数
电子层数
原子序数递增
最外层电子数
电子层数递增
3.元素周期表的结构
元素周期表
周期(7个)
___周期
第1、2、3周期
元素种数分别为__、__、__种
___周期
第4、5、6、7周期
元素种数分别为___、___、___、32种
族(16个)
主族:由_______________共同构成,共__个
副族:完全由长周期元素构成,共__个
第Ⅷ族:第_________共3个纵列
0族:第___纵列
短
长
2
8
8
18
18
32
短周期和长周期
8、9、10
18
7
7
1.利用“构-位-性”的关系指导化学学习
原子结构
表中位置
元素性质
原子序数=
核电荷数
周期数=
电子层数
主族序数=最外层电子数
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
(主族)最外层电子数
=
最高正价
最外层电子数-8
=
负价
大→小
小→大
电子层数相同、最外层电子增多
逐渐减小
逐渐增大
逐渐增大
逐渐减小
金属性减、非金属性增
金属性增、非金属性减
最高正价+1→+7
最高正价=族系数
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
形成:难→易
稳定性:弱→强
形成:易→难
稳定性:强→弱
电子层增多
最外层电子数相同
2.元素性质递变规律
内容
同周期(从左到右)
同主族(从上到下)
原子半径
电子层结构
失电子能力
得电子能力
金属性非金属性
主要化合价
最高价氧化物对应的水化物酸碱性
非金属元素气态氢
化物的形成与稳定性
族
周期
原子半径逐渐减小
原子半径增大
金属性减弱,非金属性增强
金属性增强
非金属性增强
稀有气体元素
金属性增强
非金属区域
金属区域
元素金属性和非金属性的递变
注意:位于分界线附近的元素,既表现出一定的金属性,又
表现出一定的非金属性。如Be(OH)2具有两性。
讨论:每一周期最后一个金属元素的最外层电子数与电子层
数(周期序数)有什么关系?
金属元素的最外层电子数≤原子核外电子层数(H例外)
原子半径减小
原子半径逐渐增大
3.元素的金属性和非金属性与周期表中位置的关系
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
3
4
5
6
(1)两短周期元素原子序数相差8,则周期数一定相差1( )
(2)最外层电子数是2的元素,都是ⅡA族元素( )
(3)位于同一周期的甲、乙两种元素,甲位于ⅠA族,原子序数为x,乙位于ⅢA族,则乙的原子序数可能为x+12( )
(4)铁位于元素周期表的第4周期ⅧB族( )
(5)位于同一主族的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4( )
√
×
×
×
√
题组一 元素周期表结构的考查
1.(2019·杭州高三月考)以下关于元素周期表的结构叙述正确的是
A.有七个主族,八个副族
B.有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.0族位于元素周期表的第18列(从左往右)
D.第ⅢA族位于元素周期表的第三列(从左往右)
√
变式1
.根据原子序数推断元素
(1)56号元素位于第____周期_____族。
(2)114号元素位于第____周期_____族。
(3)25号元素位于第____周期____族。
6
ⅡA
7
ⅣA
4
ⅦB
变式2.结合元素周期表回答下列问题:
(2)元素f是第____周期_____族元素,请在方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。
3
ⅥA
答案
(3)简述元素在元素周期表中的位置与元素原子结构的关系:________________
_______________________________________________________________。
元素所在的主族序数等于原子的最外层电子数,元素所在的周期数等于原子的电子层数
题组二 元素周期表中特殊位置元素原子序数关系
2.第ⅡA族相邻周期的A、B两种元素所在周期分别最多可排m和n种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数可能为
A.x-n
B.x+m
C.x-m
D.x+n
√
解析 A、B同在第ⅡA族,B在A的上一周期时,A和B的原子序数之差恰好为B所在周期的元素种类数,已知A、B两种元素所在周期分别最多可排m和n种元素,所以当A的原子序数为x时,B的原子序数为x-n,故合理选项是A。
变式1
.第ⅢA族相邻周期的A、B两种元素所在周期分别最多可排m和n种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数可能为
A.x-n
B.x+m
C.x-m
D.x+n
√
变式2
.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为
A.5x+10
B.5x
C.5x+14
D.5x+16
√
解析
变式1.下列各图为周期表中的一部分,原子序数与其位置不相符的是( )
解析 在B选项中,4号元素在第ⅡA族,5号元素在第ⅢA族,第ⅡA族和第ⅢA族在周期表中不相邻。
答案 B
题组三 元素周期表中元素的推断
3.下列各表是元素周期表的一部分,表中数字表示的原子序数与其在周期表中的位置相符合的是
√
变式2:A、B分别为第3、4两周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数。①若A为ⅡA族,其质量数为X,则B的质子数为Y;②若A为ⅣA族,其质子数为m,则B质量数为n,则Y和n的值是
√
元素周期表的特殊结构及位置与原子序数的关系
1.
元素周期表的特殊结构及位置与原子序数的关系
3.(2018·4月浙江选考,12)四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )
A.原子半径(r)大小比较:r(X)>r(Y)
B.X和W可形成共价化合物XW3
C.W的非金属性比Z的强,所以W氢化物的沸点比Z的高
D.Z的最低价单核阴离子的失电子能力比Y的强
答案 C
变式1.(2018·温州模拟)A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
A.Be、Na、Al
B.B、Mg、Si
C.O、P、Cl
D.C、Al、P
√
解析 设A的原子序数为x,则B的原子序数为x+8-1,C的原子序数为x+8+1,(x+8-1)+(x+8+1)=4x,解得x=8,所以A为O元素,B为P元素,C为Cl元素,故选C。
变式2.
W、X、Y、Z、R为五种短周期主族非金属元素,它们在元素周期表中的相对位置如图所示。下列关于五种元素的说法正确的是( )
A.粒子半径:原子半径最大的是W,简单阴离子半径最小的是R
B.单质:氧化性最强的是Z,还原性最强的是Y
C.最高价氧化物对应的水化物:酸性最强的是Z,水溶性最差的是Y
D.最简单氢化物:沸点最高的是X,稳定性最差的是W
答案 C
复习:①半径比较;②金属(非金属)性比较;③最高级金属(非金属)氧化物水化物碱(酸)性比较;④气态氢化物稳定性比较
?
W
X
R
Y
?
?
Z
变式3.(2018·浙江杭州十四中高三模拟)右表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
A.X、W、Z元素的原子半径及它们的最简单气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
答案 D
题组三 元素的金属性、非金属性判断
4.下列不能说明氯元素的非金属性比硫元素强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤
B.①②
C.①②④
D.①③⑤
√
变式1.依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物NH3、H2O、HF的稳定性
C.碱金属单质Li、Na、K与水反应的剧烈程度
D.1
mol
Na、Mg、Al分别与足量盐酸反应时失电子数的多少
√
变式2.下列实验不能达到实验目的的是
√
选项
实验操作
实验目的
A
Cl2、Br2分别与H2反应
比较氯、溴的非金属性强弱
B
向MgCl2、AlCl3溶液中分别通入NH3
比较镁、铝的金属性强弱
C
测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH
比较C、S的非金属性强弱
D
Fe、Cu分别与稀盐酸反应
比较Fe、Cu的金属性强弱
变式3.利用图示装置进行下列实验,能达到实验目的的是
√
选项
溶液a
固体b
溶液c
实验目的:验证
A
浓硝酸
NaHCO3
Na2SiO3
非金属性:N>C>Si
B
浓盐酸
KMnO4
Na2S
氧化性:KMnO4>Cl2>S
C
浓盐酸
CaCO3
NaAlO2
酸性:HCl>H2CO3>Al(OH)3
D
浓氨水
CaO
酚酞溶液
NH3·H2O是弱碱
题组四 元素金属性、非金属性强弱的实验设计
4.某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1
mol分别投入到足量的0.1
mol·L-1的盐酸中,试预测实验结果:____与盐酸反应最剧烈,____与盐酸反应最慢。
钾
铝
解析 金属性:K>Na>Mg>Al,故钾与盐酸反应最剧烈,铝与盐酸反应最慢。
(2)将NaOH与NH4Cl溶液混合生成NH3·H2O从而验证NaOH的碱性强于NH3·H2O,继而可以验证Na的金属性强于N,你认为此设计是否合理?并说明理由:____
____________________________________________________________________________________________________________________________。
理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3·H2O不是N元素最高价氧化物对应的水化物
不合
Ⅱ.利用如图装置可以验证非金属性的变化规律。
(3)仪器A的名称为_________,干燥管D的作用是_________。
解析 若A、B中的物质反应产生的气体易溶于C中的液体,则易发生倒吸现象,干燥管D可以防止C中的液体倒吸到烧瓶中。
分液漏斗
防止倒吸
(4)实验室中现有药品Na2S溶液、KMnO4溶液、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫;装置A、B、C中所装药品分别为_______、_______、_________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
解析 由题中所给药品可知,可用Na2S与Cl2发生置换反应判断氯与硫的非金属性强弱,因为无加热装置,所以只能选择KMnO4与浓盐酸反应制取氯气。
浓盐酸
KMnO4
Na2S溶液
S2-+Cl2===S↓+2Cl-
(5)若要证明非金属性:S>C>Si,则A中加_______、B中加Na2CO3、C中加____________,观察到C中溶液的现象为___________________。
解析 由B中药品Na2CO3可知,用最高价氧化物对应水化物的酸性强弱来判断非金属性强弱,所以A中加入稀硫酸,B、C装置中加入相应的盐溶液。
稀硫酸
Na2SiO3溶液
有白色胶状沉淀产生
下列说法正确的是
A.E与B的简单离子的电子层结构
相同,且简单离子半径B
NaOH溶液、碱石灰
C.D元素形成的单质与A2C不反应
D.实验结束后,取⑤中的少量产物于试管中,加适量蒸馏水,可以产生使试管
口湿润的红色石蕊试纸变蓝的气体
变式1.短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和D同主族,B和C相邻,F的最高价氧化物对应的水化物为无机含氧酸中的最强酸。E与B可组成化合物E3B2,且该物质遇水发生水解反应。已知利用如图所示装置以制备E3B2,装置①用于制备B单质。
√
规避金属性和非金属性判断中的易错点
(1)对于主族元素而言,元素的最高正化合价和主族序数相同,但是氧无最高正价,氟无正价,一般为零价或负价。
(2)判断元素非金属性或金属性的强弱,依据是元素原子在化学反应中得失电子的难易而不是得失电子数目的多少。
(3)根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物的水化物。
练后反思
同课章节目录
