苏教版必修2第1专题“微观结构与物质的多样性”专题复习 第2课时(课件43页)
文档属性
| 名称 | 苏教版必修2第1专题“微观结构与物质的多样性”专题复习 第2课时(课件43页) |  | |
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-18 16:39:49 | ||
图片预览










文档简介
(共43张PPT)
苏教版
化学
必修2
专题1
微观结构与物质的多样性
专题复习
第2课时
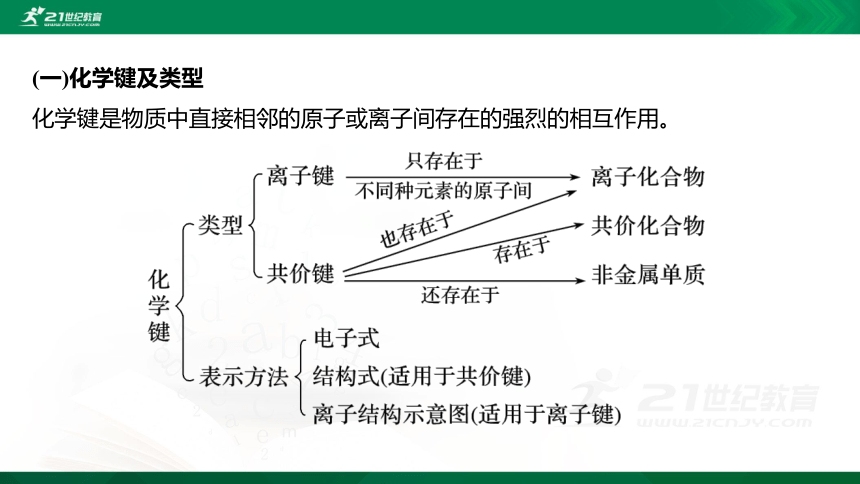
(一)化学键及类型
化学键是物质中直接相邻的原子或离子间存在的强烈的相互作用。
(二)离子键、共价键的比较
静电作用
共用电子对
阴、阳离子
原子
?
离子键
共价键
概念
阴、阳离子通过_________所形成的化学键
原子间通过___________而形成的化学键
成键粒子
___________
_____
成键实质
阴、阳离子的静电作用
共用电子对不偏向任何一方
共用电子对偏向一方原子
形成条件
活泼金属元素与活泼非金属元素经电子得失,形成离子键
同种元素原子之间成键
不同种元素原子之间成键
形成的物质
离子化合物
非金属单质;某些共价化合物或离子化合物
共价化合物或离子化合物
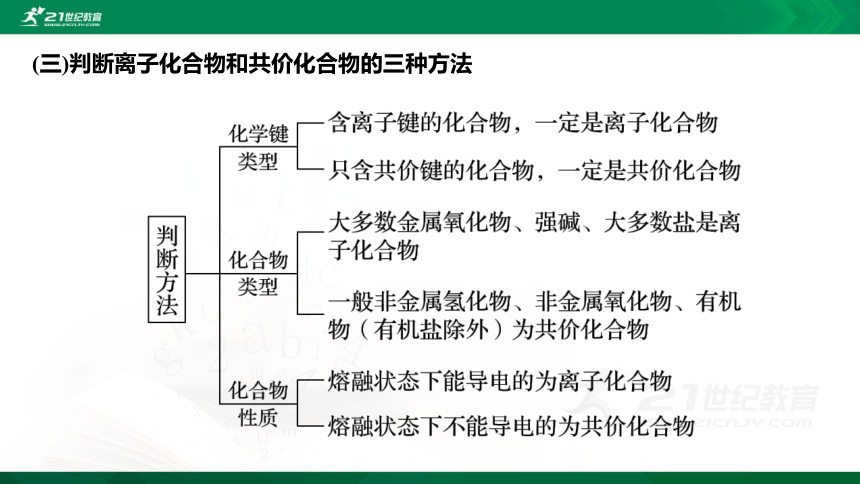
(三)判断离子化合物和共价化合物的三种方法
题组一 化学键的判断
1.有以下8种物质:①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH
⑦Na2O2 ⑧NH4Cl
请用上述物质的序号填空:
(1)不存在化学键的是____。
(2)只存在共价键的是________。
(3)只存在离子键的是____。
(4)既存在离子键又存在共价键的是_______。
(5)属于离子化合物的是_________。
解题能力提升
①
②③④
⑤
⑥⑦⑧
⑤⑥⑦⑧
(四)化学键的断裂与化学反应
1.化学反应过程
化学反应过程中反应物中的化学键被破坏。如H2+F2===2HF,H—H键、F—F键均被破坏。
化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
2.物理变化过程
(1)离子化合物,溶于水便电离成自由移动的阴、阳离子,离子键被破坏;熔化后,也电离成自由移动的阴、阳离子,离子键被破坏。
(2)有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏。如:CO2、SO3等;有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏。如:HCl、H2SO4等强酸。
题组二 物质变化与化学键
2.下列关于NaHSO4的说法中正确的是
A.因为NaHSO4是离子化合物,所以NaHSO4固体能够导电
B.NaHSO4固体中阳离子和阴离子的个数比是2∶1
C.NaHSO4固体熔化时破坏的是离子键和共价键
D.NaHSO4固体溶于水时破坏的是离子键和共价键
√
变式1.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A.将SO2通入水中
B.烧碱溶于水
C.将HCl通入水中
D.碳酸氢钠溶于水
√
化学键断裂或形成与物质变化理解中的易错点
(1)化学变化中一定有化学键的断裂和形成。
(2)有化学键断裂或形成的变化不一定是化学变化。如NaCl熔化、HCl溶于水等,只有旧化学键的断裂没有新化学键的形成;从溶液中析出晶体时,无化学键的断裂但有化学键的形成,均未发生化学变化。
练后反思
题组三 微粒间作用力与物质变化
3.正误判断,正确的打“√”,错误的打“×”
(1)加热硅、硫晶体使之熔化,克服的作用力不同( )
(2)二氧化硅熔化和干冰气化所破坏的作用力不相同( )
(3)HBr比HCl的热稳定性差说明HBr的分子间作用力比HCl弱( )
(4)碘单质升华,克服的是其分子间作用力( )
(5)HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl-( )
(6)碘晶体是分子晶体,加热升华过程中只需克服分子间作用力( )
(7)氯化钠的电离是一个破坏离子键的过程( )
(8)HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强( )
√
√
×
√
√
√
√
×
(9)碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力( )
(10)干冰受热易升华,但不易分解,说明其化学键比分子间作用力强( )
(11)石墨转化为金刚石的过程中,既有化学键的断裂,又有化学键的形成( )
(12)NaHCO3受热分解生成Na2CO3、CO2和H2O,既破坏了离子键,也破坏了共价键( )
(13)H2O、H2S、H2Se的分子间作用力依次增大,沸点依次升高( )
(14)HF比HCl稳定是因为HF间存在氢键( )
√
×
√
√
×
×
(一)分类书写
4.请写出下列微粒的电子式
(1)原子:Na_____,Cl______。
(2)简单离子:Na+______,F-__________。
(3)复杂离子:
_____________,OH-____________。
Na·
Na+
(五)微粒电子式的书写
题组四
电子式书写
(4)离子化合物:MgCl2______________________,Na2O__________________,
Ba(OH)2________________________,Na2O2______________________。
(5)非金属单质及共价化合物:N2__________,H2O_________,
H2O2_____________。
(二)对比书写
5.(1)—OH________,OH-____________,H3O+____________,
_____________,
________________。
(2)HClO___________,CCl4__________,CO2______________,
CS2_______________,COS______________,HCHO________,
C2H4__________________,(CN)2____________________,
(SCN)2________________________,COCl2___________,N2H4_____________。
(3)Na2S_________________,NaH__________,NH4H__________________,
NaCN_________________,NaSCN______________________,
NaBH4_________________,H2O_________,H2S________。
电子式书写常见的四大误区
练后反思
题组五 “8”电子稳定结构的判断
5.下列分子中各原子都满足8电子稳定结构的化合物是
A.C6H6
B.HCN
C.CO2
D.N2
√
解析 氢原子不满足8电子稳定结构,A、B项错误;
N2是单质,不是化合物,D项错误。
变式1.(2018·余姚模拟)下列物质中所有原子均满足最外层8电子稳定结构的化合物是
A.PCl5
B.P4
C.CCl4
D.NH3
√
变式2.含有极性键且分子中各原子都满足8电子稳定结构的化合物是
A.CH4
B.CH2==CH2
C.CO2
D.O2
√
解析 A、B两项中的氢原子都只满足2电子稳定结构;
D项,O2是单质而不是化合物。
8电子结构的判断方法
(1)经验规律法
凡符合最外层电子数+|化合价|=8的皆为8电子结构。
(2)试写结构法
判断某化合物中的某原子最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如①H2O中O原子最外层有8个电子,而H原子最外层只有2个电子,②N2中N原子最外层有5个电子,N与N之间形成3个共价键,所以N2中的N原子最外层达到8电子稳定结构。
方法归纳
返回
(六)分子间作用力
1.概念
分子间存在着将分子聚集在一起的作用力叫分子间作用力,分子间作用力包括范德华力和氢键。
2.特点
(1)分子间作用力比化学键弱得多,它主要影响物质的熔沸点和溶解度等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力只存在于由共价键形成的多数化合物分子之间和绝大多数非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在分子间作用力。
3.氢键
(1)氢原子与电负性较大的原子以共价键结合,若与另一电负性较大的原子接近时所形成的一种特殊的分子间或分子内作用,是一种比范德华力稍强的相互作用。
(2)除H原子外,形成氢键的原子通常是N、O、F。
4.变化规律
(1)组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。
(2)与H原子形成氢键的原子的电负性越大,所形成的氢键越强,物质的熔沸点越高。
(七)简单共价分子的空间结构及键能
1.指出下列分子的空间结构
Cl2:_______;H2O:
____;NH3:_________;CH4:___________;CO2:___
_____;C2H4:______;C2H2:_______;
:_____________;CS2:_______;CCl4:___________。
2.键能
(1)概念:气态基态原子形成1
mol化学键放出的最低能量。
(2)因素:成键原子半径越小,键长越短,键能越大,分子越稳定。
试比较下列分子的稳定性(填“>”或“<”):
NH3______
PH3;H2S____
H2O;HCl____
HBr。
直线形
V形
三角锥型
正四面体型
线形
直
平面形
平面正六边形
直线形
直线形
正四面体型
>
<
>
3.简单共价分子的两种模型——球棍模型和比例模型
球棍模型主要体现的是分子空间结构和成键类型,比例模型主要体现的是组成该分子的原子间的大小关系;两种模型都显示了原子间的连接顺序,但球棍模型侧重价键结构,比例模型侧重原子大小。
考查两种模型的设错方式:(1)混淆两种模型,(2)比例模型中混淆原子大小。
几种典型物质的电子式、结构式和模型:
H—Cl
Cl—Cl
H—O—H
物质
HCl
Cl2
H2O
NH3
CH4
电子式
?
?
?
?
?
结构式
_______
_______
_________
?
?
球棍模型
?
?
?
?
?
比例模型
?
?
?
?
?
题组六 两种模型的判断
6.正误判断,正确的打“√”,错误的打“×”
(1)CH4的球棍模型:
( )
(2)四氯化碳的球棍模型:
( )
(3)水分子的比例模型:
( )
(4)乙炔分子的球棍模型:
( )
(5)比例模型
可以表示CO2分子或SiO2分子( )
√
×
×
√
×
(1)化学键是相邻离子或原子间的一种强作用力,既包括静电吸引力,又包括静电排斥力( )
(2)所有物质中都存在化学键( )
(3)由活泼金属元素与活泼非金属元素形成的化学键都是离子键( )
(4)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键( )
(5)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键( )
(6)1
mol
KHSO4加热熔化时可电离出2NA阳离子( )
√
×
×
×
√
×
(7)共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏( )
(8)分子内共价键越强,分子越稳定,其熔沸点也越高( )
(9)H2O的稳定性大于H2S,是因为水分子间存在氢键( )
(10)HF、HCl、HBr、HI的稳定性逐渐减弱,其熔沸点逐渐升高( )
×
×
×
×
(1)金刚石晶体中,每个C原子与另外___个C原子形成共价键,C—C
键之间的夹角是109.5°,最小的环是____元环。含有1
mol
C原子的金刚石中,形成的共价键有
___mol。
(八)金刚石、石英、干冰、足球烯、NaCl的晶体结构
1.金刚石和石英
4
六
2
(2)SiO2晶体中,每个Si原子与___个O原子成键,每个O原子与
___个硅原子成键,最小的环是______元环,在“硅氧”四面体中,处于中心的是____原子,
1
mol
SiO2中含有___
mol
Si—O键。
(3)在金刚石、SiO2中微粒间的相互作用是________。
4
2
十二
Si
4
共价键
2.干冰和足球烯
(1)干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有____个。
(2)在C60中有12个正五边形,20个正六边形,共有60个碳碳单键,30个碳碳双键。
(3)在干冰和足球烯微粒间的相互作用是____________,在微粒内部存在_______。
12
分子间作用力
共价键
3.NaCl
(1)NaCl型:在晶体中,每个Na+同时吸引___个Cl-,每个Cl-同时吸引___个Na+,配位数为___。每个晶胞含___个Na+和___个Cl-。
(2)在NaCl中,Na+、Cl-之间的相互作用是_______。
6
6
6
4
4
离子键
(九)晶体类型及性质比较
阳离子
阴
离子
分子
原子
金属离子、
自由电子
离子键
范德华力(有
的存在氢键)
共价键
金属键
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
构成晶体的粒子
______、___
____
_____
_____
__________
________
组成晶体粒子间的相互作用
_______
__________
__________
_______
______
典型实例
NaCl
冰(H2O)、干冰(CO2)
金刚石、晶体硅、SiO2、SiC及Si3N4等大多数新型高温结构陶瓷
除汞外的金属及合金
固态不导电,熔融或溶于水能导电
固体、熔融状态均不导电,部分化合物溶于水能导电
不良
不良
不良
不导电
晶体的物理性质
熔沸点
熔点较高,沸点高
熔沸点低
熔沸点高
易导电、易导热,大多数具有较好的延展性,密度、硬度、熔点、沸点等差别较大
导热性
_____
_____
_____
导电性
_______________________________
_______________________________________________
_______
机械加工性能
不良
不良
不良
硬度
略硬而脆
硬度低
高硬度
(1)离子晶体除含离子键外,一定不含其他化学键( )
(2)含有阳离子的晶体一定是离子晶体( )
(3)离子晶体中一定不含分子( )
(4)金属与非金属形成的化合物一定都是离子化合物( )
(5)具有金属光泽且能导电的单质一定是金属( )
(6)NaOH、NH4Cl晶体中既有离子键又有共价键( )
(7)在O2、CO2和SiO2中,都存在共价键,它们均由分子构成( )
(8)金刚石、NaCl、H2O、HCl晶体的熔点依次降低( )
(9)金刚石和足球烯都是通过共用电子对形成空间网状结构,所以都是原子晶体( )
(10)He、CO2和CH4都是由分子构成,它们中都存在共价键( )
×
×
×
√
√
×
×
×
×
×
题组一 化学键与晶体类型
1.有以下9种物质:①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH
⑦Na2O2 ⑧NH4Cl ⑨AlCl3。
请用上述物质的序号填空:
(1)分子晶体____________。
(2)离子晶体__________。
(3)不存在化学键的是____。
(4)只存在共价键的是__________。
(5)只存在离子键的是____。
(6)既存在离子键又存在共价键的是________。
①②③④⑨
⑤⑥⑦⑧
①
②③④⑨
⑤
⑥⑦⑧
题组二 晶体类型的判断
2.有下列八种晶体:A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.铝 G.氯化铵 H.金刚石。用字母回答下列问题:
(1)直接由原子构成的晶体是______,属于原子晶体的化合物是____。
(2)由极性分子构成的晶体是____,含有共价键的离子晶体是____,属于分子晶体的单质是____。
(3)在一定条件下能导电而不发生化学变化的是____。
AEH
A
B
G
DE
F
变式1.有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对这三种晶体进行实验,结果如下表:
(1)晶体的化学式分别为A______、B____、C_____。
(2)晶体的类型分别是A__________、B_________、C_________。
(3)晶体中微粒间作用力分别是A_______、B________、C_________。
NaCl
C
HCl
离子晶体
原子晶体
分子晶体
离子键
共价键
范德华力
序号
熔点/℃
硬度
水溶性
导电性
水溶液与Ag+反应
A
811
较大
易溶
水溶液或熔融导电
白色沉淀
B
3
500
很大
不溶
不导电
不反应
C
-114.2
很小
易溶
液态不导电
白色沉淀
1.依据物质的分类记忆晶体类型
(1)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合物类原子晶体有碳化硅、二氧化硅等。
(4)金属单质是金属晶体。
反思归纳
2.依据晶体性质推断晶体类型
(1)依据晶体的熔点判断
①离子晶体的熔点较高。
②原子晶体的熔点很高。
③分子晶体的熔点低。
④金属晶体多数熔点高,但也有少数熔点相当低。
(2)依据导电性判断
①离子晶体溶于水及熔融状态时能导电。
②原子晶体一般为非导体。
③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
④金属晶体是电的良导体。
(3)依据硬度和机械性能判断
①离子晶体硬度较大、硬而脆。
②原子晶体硬度大。
③分子晶体硬度小且较脆。
④金属晶体多数硬度较大,但也有较低的,且具有延展性。
注意 (1)常温下为气态或液态的物质,其晶体应属于分子晶体(Hg除外)。
(2)AlCl3晶体中虽含有金属元素,但属于分子晶体,熔沸点低(熔点190
℃)。
(3)合金的硬度比其成分金属大,熔沸点比其成分金属低。
返回
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
苏教版
化学
必修2
专题1
微观结构与物质的多样性
专题复习
第2课时
(一)化学键及类型
化学键是物质中直接相邻的原子或离子间存在的强烈的相互作用。
(二)离子键、共价键的比较
静电作用
共用电子对
阴、阳离子
原子
?
离子键
共价键
概念
阴、阳离子通过_________所形成的化学键
原子间通过___________而形成的化学键
成键粒子
___________
_____
成键实质
阴、阳离子的静电作用
共用电子对不偏向任何一方
共用电子对偏向一方原子
形成条件
活泼金属元素与活泼非金属元素经电子得失,形成离子键
同种元素原子之间成键
不同种元素原子之间成键
形成的物质
离子化合物
非金属单质;某些共价化合物或离子化合物
共价化合物或离子化合物
(三)判断离子化合物和共价化合物的三种方法
题组一 化学键的判断
1.有以下8种物质:①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH
⑦Na2O2 ⑧NH4Cl
请用上述物质的序号填空:
(1)不存在化学键的是____。
(2)只存在共价键的是________。
(3)只存在离子键的是____。
(4)既存在离子键又存在共价键的是_______。
(5)属于离子化合物的是_________。
解题能力提升
①
②③④
⑤
⑥⑦⑧
⑤⑥⑦⑧
(四)化学键的断裂与化学反应
1.化学反应过程
化学反应过程中反应物中的化学键被破坏。如H2+F2===2HF,H—H键、F—F键均被破坏。
化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
2.物理变化过程
(1)离子化合物,溶于水便电离成自由移动的阴、阳离子,离子键被破坏;熔化后,也电离成自由移动的阴、阳离子,离子键被破坏。
(2)有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏。如:CO2、SO3等;有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏。如:HCl、H2SO4等强酸。
题组二 物质变化与化学键
2.下列关于NaHSO4的说法中正确的是
A.因为NaHSO4是离子化合物,所以NaHSO4固体能够导电
B.NaHSO4固体中阳离子和阴离子的个数比是2∶1
C.NaHSO4固体熔化时破坏的是离子键和共价键
D.NaHSO4固体溶于水时破坏的是离子键和共价键
√
变式1.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A.将SO2通入水中
B.烧碱溶于水
C.将HCl通入水中
D.碳酸氢钠溶于水
√
化学键断裂或形成与物质变化理解中的易错点
(1)化学变化中一定有化学键的断裂和形成。
(2)有化学键断裂或形成的变化不一定是化学变化。如NaCl熔化、HCl溶于水等,只有旧化学键的断裂没有新化学键的形成;从溶液中析出晶体时,无化学键的断裂但有化学键的形成,均未发生化学变化。
练后反思
题组三 微粒间作用力与物质变化
3.正误判断,正确的打“√”,错误的打“×”
(1)加热硅、硫晶体使之熔化,克服的作用力不同( )
(2)二氧化硅熔化和干冰气化所破坏的作用力不相同( )
(3)HBr比HCl的热稳定性差说明HBr的分子间作用力比HCl弱( )
(4)碘单质升华,克服的是其分子间作用力( )
(5)HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl-( )
(6)碘晶体是分子晶体,加热升华过程中只需克服分子间作用力( )
(7)氯化钠的电离是一个破坏离子键的过程( )
(8)HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强( )
√
√
×
√
√
√
√
×
(9)碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力( )
(10)干冰受热易升华,但不易分解,说明其化学键比分子间作用力强( )
(11)石墨转化为金刚石的过程中,既有化学键的断裂,又有化学键的形成( )
(12)NaHCO3受热分解生成Na2CO3、CO2和H2O,既破坏了离子键,也破坏了共价键( )
(13)H2O、H2S、H2Se的分子间作用力依次增大,沸点依次升高( )
(14)HF比HCl稳定是因为HF间存在氢键( )
√
×
√
√
×
×
(一)分类书写
4.请写出下列微粒的电子式
(1)原子:Na_____,Cl______。
(2)简单离子:Na+______,F-__________。
(3)复杂离子:
_____________,OH-____________。
Na·
Na+
(五)微粒电子式的书写
题组四
电子式书写
(4)离子化合物:MgCl2______________________,Na2O__________________,
Ba(OH)2________________________,Na2O2______________________。
(5)非金属单质及共价化合物:N2__________,H2O_________,
H2O2_____________。
(二)对比书写
5.(1)—OH________,OH-____________,H3O+____________,
_____________,
________________。
(2)HClO___________,CCl4__________,CO2______________,
CS2_______________,COS______________,HCHO________,
C2H4__________________,(CN)2____________________,
(SCN)2________________________,COCl2___________,N2H4_____________。
(3)Na2S_________________,NaH__________,NH4H__________________,
NaCN_________________,NaSCN______________________,
NaBH4_________________,H2O_________,H2S________。
电子式书写常见的四大误区
练后反思
题组五 “8”电子稳定结构的判断
5.下列分子中各原子都满足8电子稳定结构的化合物是
A.C6H6
B.HCN
C.CO2
D.N2
√
解析 氢原子不满足8电子稳定结构,A、B项错误;
N2是单质,不是化合物,D项错误。
变式1.(2018·余姚模拟)下列物质中所有原子均满足最外层8电子稳定结构的化合物是
A.PCl5
B.P4
C.CCl4
D.NH3
√
变式2.含有极性键且分子中各原子都满足8电子稳定结构的化合物是
A.CH4
B.CH2==CH2
C.CO2
D.O2
√
解析 A、B两项中的氢原子都只满足2电子稳定结构;
D项,O2是单质而不是化合物。
8电子结构的判断方法
(1)经验规律法
凡符合最外层电子数+|化合价|=8的皆为8电子结构。
(2)试写结构法
判断某化合物中的某原子最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如①H2O中O原子最外层有8个电子,而H原子最外层只有2个电子,②N2中N原子最外层有5个电子,N与N之间形成3个共价键,所以N2中的N原子最外层达到8电子稳定结构。
方法归纳
返回
(六)分子间作用力
1.概念
分子间存在着将分子聚集在一起的作用力叫分子间作用力,分子间作用力包括范德华力和氢键。
2.特点
(1)分子间作用力比化学键弱得多,它主要影响物质的熔沸点和溶解度等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力只存在于由共价键形成的多数化合物分子之间和绝大多数非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在分子间作用力。
3.氢键
(1)氢原子与电负性较大的原子以共价键结合,若与另一电负性较大的原子接近时所形成的一种特殊的分子间或分子内作用,是一种比范德华力稍强的相互作用。
(2)除H原子外,形成氢键的原子通常是N、O、F。
4.变化规律
(1)组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。
(2)与H原子形成氢键的原子的电负性越大,所形成的氢键越强,物质的熔沸点越高。
(七)简单共价分子的空间结构及键能
1.指出下列分子的空间结构
Cl2:_______;H2O:
____;NH3:_________;CH4:___________;CO2:___
_____;C2H4:______;C2H2:_______;
:_____________;CS2:_______;CCl4:___________。
2.键能
(1)概念:气态基态原子形成1
mol化学键放出的最低能量。
(2)因素:成键原子半径越小,键长越短,键能越大,分子越稳定。
试比较下列分子的稳定性(填“>”或“<”):
NH3______
PH3;H2S____
H2O;HCl____
HBr。
直线形
V形
三角锥型
正四面体型
线形
直
平面形
平面正六边形
直线形
直线形
正四面体型
>
<
>
3.简单共价分子的两种模型——球棍模型和比例模型
球棍模型主要体现的是分子空间结构和成键类型,比例模型主要体现的是组成该分子的原子间的大小关系;两种模型都显示了原子间的连接顺序,但球棍模型侧重价键结构,比例模型侧重原子大小。
考查两种模型的设错方式:(1)混淆两种模型,(2)比例模型中混淆原子大小。
几种典型物质的电子式、结构式和模型:
H—Cl
Cl—Cl
H—O—H
物质
HCl
Cl2
H2O
NH3
CH4
电子式
?
?
?
?
?
结构式
_______
_______
_________
?
?
球棍模型
?
?
?
?
?
比例模型
?
?
?
?
?
题组六 两种模型的判断
6.正误判断,正确的打“√”,错误的打“×”
(1)CH4的球棍模型:
( )
(2)四氯化碳的球棍模型:
( )
(3)水分子的比例模型:
( )
(4)乙炔分子的球棍模型:
( )
(5)比例模型
可以表示CO2分子或SiO2分子( )
√
×
×
√
×
(1)化学键是相邻离子或原子间的一种强作用力,既包括静电吸引力,又包括静电排斥力( )
(2)所有物质中都存在化学键( )
(3)由活泼金属元素与活泼非金属元素形成的化学键都是离子键( )
(4)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键( )
(5)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键( )
(6)1
mol
KHSO4加热熔化时可电离出2NA阳离子( )
√
×
×
×
√
×
(7)共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏( )
(8)分子内共价键越强,分子越稳定,其熔沸点也越高( )
(9)H2O的稳定性大于H2S,是因为水分子间存在氢键( )
(10)HF、HCl、HBr、HI的稳定性逐渐减弱,其熔沸点逐渐升高( )
×
×
×
×
(1)金刚石晶体中,每个C原子与另外___个C原子形成共价键,C—C
键之间的夹角是109.5°,最小的环是____元环。含有1
mol
C原子的金刚石中,形成的共价键有
___mol。
(八)金刚石、石英、干冰、足球烯、NaCl的晶体结构
1.金刚石和石英
4
六
2
(2)SiO2晶体中,每个Si原子与___个O原子成键,每个O原子与
___个硅原子成键,最小的环是______元环,在“硅氧”四面体中,处于中心的是____原子,
1
mol
SiO2中含有___
mol
Si—O键。
(3)在金刚石、SiO2中微粒间的相互作用是________。
4
2
十二
Si
4
共价键
2.干冰和足球烯
(1)干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有____个。
(2)在C60中有12个正五边形,20个正六边形,共有60个碳碳单键,30个碳碳双键。
(3)在干冰和足球烯微粒间的相互作用是____________,在微粒内部存在_______。
12
分子间作用力
共价键
3.NaCl
(1)NaCl型:在晶体中,每个Na+同时吸引___个Cl-,每个Cl-同时吸引___个Na+,配位数为___。每个晶胞含___个Na+和___个Cl-。
(2)在NaCl中,Na+、Cl-之间的相互作用是_______。
6
6
6
4
4
离子键
(九)晶体类型及性质比较
阳离子
阴
离子
分子
原子
金属离子、
自由电子
离子键
范德华力(有
的存在氢键)
共价键
金属键
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
构成晶体的粒子
______、___
____
_____
_____
__________
________
组成晶体粒子间的相互作用
_______
__________
__________
_______
______
典型实例
NaCl
冰(H2O)、干冰(CO2)
金刚石、晶体硅、SiO2、SiC及Si3N4等大多数新型高温结构陶瓷
除汞外的金属及合金
固态不导电,熔融或溶于水能导电
固体、熔融状态均不导电,部分化合物溶于水能导电
不良
不良
不良
不导电
晶体的物理性质
熔沸点
熔点较高,沸点高
熔沸点低
熔沸点高
易导电、易导热,大多数具有较好的延展性,密度、硬度、熔点、沸点等差别较大
导热性
_____
_____
_____
导电性
_______________________________
_______________________________________________
_______
机械加工性能
不良
不良
不良
硬度
略硬而脆
硬度低
高硬度
(1)离子晶体除含离子键外,一定不含其他化学键( )
(2)含有阳离子的晶体一定是离子晶体( )
(3)离子晶体中一定不含分子( )
(4)金属与非金属形成的化合物一定都是离子化合物( )
(5)具有金属光泽且能导电的单质一定是金属( )
(6)NaOH、NH4Cl晶体中既有离子键又有共价键( )
(7)在O2、CO2和SiO2中,都存在共价键,它们均由分子构成( )
(8)金刚石、NaCl、H2O、HCl晶体的熔点依次降低( )
(9)金刚石和足球烯都是通过共用电子对形成空间网状结构,所以都是原子晶体( )
(10)He、CO2和CH4都是由分子构成,它们中都存在共价键( )
×
×
×
√
√
×
×
×
×
×
题组一 化学键与晶体类型
1.有以下9种物质:①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH
⑦Na2O2 ⑧NH4Cl ⑨AlCl3。
请用上述物质的序号填空:
(1)分子晶体____________。
(2)离子晶体__________。
(3)不存在化学键的是____。
(4)只存在共价键的是__________。
(5)只存在离子键的是____。
(6)既存在离子键又存在共价键的是________。
①②③④⑨
⑤⑥⑦⑧
①
②③④⑨
⑤
⑥⑦⑧
题组二 晶体类型的判断
2.有下列八种晶体:A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.铝 G.氯化铵 H.金刚石。用字母回答下列问题:
(1)直接由原子构成的晶体是______,属于原子晶体的化合物是____。
(2)由极性分子构成的晶体是____,含有共价键的离子晶体是____,属于分子晶体的单质是____。
(3)在一定条件下能导电而不发生化学变化的是____。
AEH
A
B
G
DE
F
变式1.有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对这三种晶体进行实验,结果如下表:
(1)晶体的化学式分别为A______、B____、C_____。
(2)晶体的类型分别是A__________、B_________、C_________。
(3)晶体中微粒间作用力分别是A_______、B________、C_________。
NaCl
C
HCl
离子晶体
原子晶体
分子晶体
离子键
共价键
范德华力
序号
熔点/℃
硬度
水溶性
导电性
水溶液与Ag+反应
A
811
较大
易溶
水溶液或熔融导电
白色沉淀
B
3
500
很大
不溶
不导电
不反应
C
-114.2
很小
易溶
液态不导电
白色沉淀
1.依据物质的分类记忆晶体类型
(1)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合物类原子晶体有碳化硅、二氧化硅等。
(4)金属单质是金属晶体。
反思归纳
2.依据晶体性质推断晶体类型
(1)依据晶体的熔点判断
①离子晶体的熔点较高。
②原子晶体的熔点很高。
③分子晶体的熔点低。
④金属晶体多数熔点高,但也有少数熔点相当低。
(2)依据导电性判断
①离子晶体溶于水及熔融状态时能导电。
②原子晶体一般为非导体。
③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
④金属晶体是电的良导体。
(3)依据硬度和机械性能判断
①离子晶体硬度较大、硬而脆。
②原子晶体硬度大。
③分子晶体硬度小且较脆。
④金属晶体多数硬度较大,但也有较低的,且具有延展性。
注意 (1)常温下为气态或液态的物质,其晶体应属于分子晶体(Hg除外)。
(2)AlCl3晶体中虽含有金属元素,但属于分子晶体,熔沸点低(熔点190
℃)。
(3)合金的硬度比其成分金属大,熔沸点比其成分金属低。
返回
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
