人教版必修1 2.3 氧化还原反应(3个课时)(共56张PPT)
文档属性
| 名称 | 人教版必修1 2.3 氧化还原反应(3个课时)(共56张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 678.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-19 10:19:24 | ||
图片预览









文档简介
(共56张PPT)
氧化还原反应(1课时)
学习目标:
1.
从得氧和失氧的分类标准认识氧化还原反应的概念。
2.
从化合价变化的分类标准认识氧化反应、还原
反应的特征
3.
从化合价升降、电子的得失或电子对的偏移角度
理解氧化还原反应
(一)
揭示课堂目标
一、氧化还原反应定义
1.氧化反应和还原反应
从得氧和失氧角度认识氧化还原反应:
(1).
初中化学中,
(填“得”或“失”下同)氧的反应
属于氧化反应;____
氧的反应属于还原反应。
思考:2CuO+
C==2Cu+
CO2
——————(填物质的名称,同)发生氧化反应,
发生还原反应。
得
失
碳
氧化铜
注意:氧化反应和还原反应是一个反应对立
统一的两个方面。
在这个反应中,同时进行了氧化反应和还原反应,像这样的反应,我们称之为氧化还原反应。
2、从化合价升降角度认识氧化还原反应
标出氧化铜与碳反应的化合价并分析变化
2CuO
+
C
==
2Cu
+
CO2
+2
-2
0
0
-2
+4
①碳元素发生
,化合价
(填“升高”或“降低”)。
氧化反应
升高
②铜元素发生
反应,化合价
(填“升高”或“降低”)
降低
还原
③总结:化合价升高的反应叫氧化反应,化合价降低的反应叫还原反应,有化合价升降的反应就是氧化还原反应。
C生成CO2的反应化合价升高是氧化反应
CuO生成Cu的反应化合价降低是还原反应
3.化合价的规律:
一价氢氯钾钠银
二价氧钙钡镁锌
三铝四硅五氮磷
二三铁,二四碳,
二四六硫都齐全
铜汞二价最常见
单质为零要记清
负一氢氧硝酸根 负二碳酸硫酸根
正一价的是铵根
1.
在化合物中金属元素的价态一定为正价,氧元素的价态一般为-2价,氢元素一般+1价
2.
非金属元素一般有一种负价,且负价得绝对值等于8-最外层电子数,
3.
常用元素化合价最高正价一般为最外层电子数(氧、氟)
化合物元素的化合价最高为+7价,
最低价为-4价
5、化合物中元素化合价之和等于0
化合物中元素化合价的判断方法:
1.
先确定只有唯一化合价的元素的化合价,比如:H、O、Na等
2.
再根据化合价总和为0的规律去求出那些变价元素的化合价。
3.
K、Ca、Na、Mg、Al、Zn、Ba在化合物中就一种价态,N
为-3、+1
—
+5;
S
为-2、+4、+6;
Cl为-1、+1、+3
+5、+7
Mn为
+2、+4、+6、+7
标出下列元素的化合价
H2SO4
HNO3
H3PO4
NaOH
MgCl2
Al2O3
P2O5
Na2S
FeCl3
H2SO3
KMnO4
CO32-
NH4+
ClO3-
+6
+5
+5
+1
+2
-1
+3
+5
-2
+3
+4
+1
+7
+4
-3
+5
课堂练习:分析下列反应那些是氧化还原反应?同时分析氧化反应和还原反应。
①2Na+Cl2=2NaCl
②Na2O+CO2=Na2CO3
③CaCO3==CaO+CO2
④2KClO3==2KCl+3O2↑
⑤Cu+2AgNO3=Cu(NO3)2+2Ag
⑥Na2SO4+BaCl2==2NaCl+BaSO4↓
一价钾钠氯氢银,二价氧钙钡镁锌,
三铝四硅五氮磷,单质零,??铁二三,
二四六硫二四碳,
√
√
√
化合反应
分解反应
置换反应
复分解反应
总结:氧化还原与四个基本反应的关系
化合反应
分解反应
置换反应
复分解反应
3、化合价与转移电子的关系。
以NaCl的形成为例。
Na
Cl
Na
Cl
+1
-1
结论:元素化合价每升高一价,就失去1个电子,化合价每降低一价,就得到1个电子。
电子带一个单位负电荷。
4、氧化还原反应的实质。
①氧化反应元素的化合价升高,
电子。
②还原反应元素的化合价降低,
电子
失去
得到
③氧化还原反应就是有化合价变化的反应,一定有电子的
。
得失
化学上叫电子的转移
氧化还原反应的实质就是:电子的转移。
总结:氧化反应和还原反应的特征和实质
(1)
特征:反应前后元素
发
生了变化
(2)
本质:发生
转移
的化合价
电子的
达标练习:初中学习的化学反应四种基本类型:分解反应、化合反应、置换反应、复分解反应。其中一定是氧化还原反应的是
。一定不是氧化还原反应的是
。
置换反应
复分解反应
2、分析下列反应指出哪些是氧化还原反应。
3.H2O(g)+C
CO+H2
高温
1.H2+CuO
==
H2O
+
Cu
高温
高温
分析氧化反应和还原反应
指出哪些物质得到或失去电子
0
+2
+1
0
+3
+2
0
+4
+1
0
+2
0
0
0
+1
-2
0
0
+4
-2
①氧化反应元素的化合价升高,
电子。
②还原反应元素的化合价降低,
电子
失去
得到
2、氧化剂和还原剂
氧化剂:得电子的物质是氧化剂。
还原剂:失电子的物质是还原剂。
不是元素
Fe2O3
+
3CO
===
2Fe
+
3CO2
高温
+3
+2
0
+4
Fe2O3中Fe元素化合价从+3价变成了0价,化合价降低,得电子,Fe2O3是氧化剂。
CO中C元素化合价从+2价变成了+4价,化合价升高,失电子,CO是还原剂。
氧化剂(Fe2O3)发生还原反应,被还原。
还原剂(CO)发生氧化反应,被氧化。
课堂练习:指出下列反应的氧化剂和还原剂,氧化反应和还原反应。
Fe+CuS04====FeS04+Cu
Mg+2HCl===MgCl2+H2
0
0
0
0
+2
+2
+2
+1
氧化剂
还原剂
CuS04
Cu
发生还原反应
Fe
FeS04
发生氧化反应
氧化剂
还原剂
HCl
H2
发生还原反应
Mg
MgCl2
发生氧化反应
三、氧化还原反应总结
得、降、氧
升、失、还
得到电子,化合价降低,是氧化剂。失去电子,化合价升高,是还原剂
被还原
被氧化
课堂练习:指出下列氧化还原反应的氧化剂和还原剂。
①S+O2==SO2
②2Na+Cl2==2NaCl
③Cu+2AgNO3==Cu(NO3)2+2Ag
④2H2O==2H2+O2
⑤2H2S+SO2==3S+2H2O
氧化剂
还原剂
O2
S
Cl2
Na
AgNO3
Cu
H2O
H2O
SO2
H2S
得、降、氧
升、失、还
氧化剂被还原,发生还原反应,其产物叫还原产物。还原剂被氧化,发生氧化反应,其产物叫氧化产物。
C
CaCO3
CO2
D
H2
H2O
A
KCl
AgCl
B
CuSO4
Cu
1、下列变化中,元素化合价升高的是
(四)课堂检测和巩固:
D
B
AB
▲
氧化还原反应的特征:
▲
氧化还原反应的本质:
元素化合价发生了变化
电子发生转移
总结:
▲熟记概念:得、降、氧
升、失、还
化合价——得失电子——氧化剂和还原剂
氧化剂——被还原——发生还原反应——产物是还原产物
还原剂——被氧化——发生氧化反应——产物是氧化产物。
作业:
1、完善笔记。
2、预习第二课时。
3、完成课时作业(1)
第三节
氧化还原反应
第二课时
学习目标:
1.应用电子转移的观点进一步理解氧化还原反应。
2.认识氧化还原反应中各有关物质的相互关系
3.掌握常见氧化剂和还原剂的判断
(一)
揭示课堂目标
一、氧化还原反应表示方法。
1、双线桥表示法
①写出正确的氧化还原化学方程式。
CuO
+
H2
==
Cu
+
H2O
②标出反应前后元素化合价的变化
CuO
+
H2
==
Cu
+
H2O
+2
0
0
+1
化合价降低2价
得2e-
氧化剂
被还原
化合价升高2价
失2e-
被氧化
还原剂
③标出得失电子数,指明氧化剂和还原剂及反应
注意:箭头出入方向
还原产物
氧化产物
同一元素
课堂练习:用双线桥表示下列氧化还原反应,并指出氧化剂和还原剂
Zn
+
H2SO4
==
ZnSO4
+
H2↑
MnO2
+
4HCl(浓)
==
MnCl2
+
Cl2↑
+
2H2O
得2e-
还原反应
失2e-
氧化反应
氧化剂
还原剂
得2e-
被还原
失2e-
被氧化
氧化剂
还原剂
还原产物
氧化产物
还原产物
氧化产物
2、单线桥表示法
①写出正确的氧化还原化学方程式。
②标出反应前后元素化合价的变化
0
+1
2Na
+
2H2O
===
2NaOH
+
H2↑
2Na
+
2H2O
===
2NaOH
+
H2↑
+1
0
③标出得失电子数,指明氧化剂和还原剂
注意:箭头出入方向
2e-
氧化剂
还原剂
失电子元素指向得电子元素
课堂练习:用单线桥表示转移电子和氧化剂、还原剂。
Zn
+
H2SO4
==
ZnSO4
+
H2↑
SO2
+
2H2S
=
3S
+
2H2O
2KMnO4
==
K2MnO4+MnO2
+O2
↑
2e-
氧化剂
还原剂
4e-
还原剂
氧化剂
4e-
还原剂
氧化剂
二、氧化性和还原性。
氧化剂:
在化学反应中
电子(或电子对偏向)的物质叫氧化剂,在反应时氧化剂所含某一元素的化合价
。反应时本身被
。
1.氧化剂和还原剂
得到
降低
还原
氧化剂得到电子的能力或性质叫氧化性,因此氧化剂都具有氧化性。
还原剂:
在化学反应中
电子(或电子对偏远)的物质叫还原剂,在反应时还原剂所含某一元素的化合价
。反应时本身被
。
失去
升高
氧化
还原剂失去电子的能力或性质叫还原性,因此还原剂都具有还原性。
2、氧化性和还原性比较。
氧化剂+还原剂
===
氧化产物+还原产物
氧化性:氧化剂
>
氧化产物;
还原性:还原剂
>
还原产物
思考:
对Zn
+
CuCl2
===
ZnCl2
+
Cu反应而言,氧化剂
。还原剂
。
氧化产物
。还原产物
。
还原性:
>____________
氧化性:
>____________
CuCl2
Zn
ZnCl2
Cu
Zn
Cu
CuCl2
ZnCl2
氧化性:氧化剂
氧化性>还原剂的氧化性;
还原性:还原剂还原性
>
氧化剂的还原性。
还原性:
>____________
氧化性:
>____________
Zn
CuCl2
CuCl2
Zn
应用:X2+2Y-=Y2+2X-
,Y2+2Z-=2Y-+Z2
则氧化性由强到弱的顺序
X2
Y2
Z2
比较:Z-
Y-
X-的还原性
氧化性比较先找氧化剂。
还原性比较先找还原剂。
>
>
>
>
规律(2)金属元素还原性大小顺序:
金属活动性
K,
Ca,
Na,
Mg,
Al,
Zn,
Fe,
Sn,
Pb
(H+)
Cu,
Fe3+,
Hg,
Ag,
Pt,
Au。
K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Sn2+,Pb2+
(H+)
Cu2+,
Fe3+,Hg2+,Ag+,
Pt+,
Au+。
还原性渐弱
氧化性渐强
金属活动性
还原性渐弱
氧化性渐强
分析下列化学反应能发生的是(
)
A、Cu+2Ag+
=Cu2++2Ag
B、
Cu+Fe2+
=Fe+Cu2+
√
规律(3)氧化还原反应发生的原因是:
强制弱。
所有氧化能力强的氧化剂都可以在一定条件下制取氧化能力弱的氧化剂。(非金属元素的比较)
所有还原能力强的还原剂都可以在一定条件下制取还原能力弱的还原剂。(金属元素的比较)
分析下列化学反应能发生的是(
)
A、Cu+2Ag+
=Cu2++2Ag
B、
Cu+Fe2+
=Fe+Cu2+
√
F2,
KMnO4,
O2,
Cl2,
Br2,
Fe3+,
I2,
S
氧化性渐弱
F-,
Mn2+,
H2O(OH-),
Cl-,
Br-,
Fe2+,
I-,
S2-
还原性渐强
离子的氧化性,还原性正相反
规律(4)具有多种化合价的元素
元素处于中间价态时,一般既有氧化性又有还原性
2Na+S==Na2S
S+O2==SO2
2SO2+O2====2SO3
催化剂
元素处于最低价态时,只有还原性。如:Na
元素处于最高价态时,只有氧化性。如:Fe3+
C
2.在Fe2+、Fe3+、S
I
--、H+中只能作氧化
剂的是
,只能作还原剂的
是
,
既能作氧化剂又能作还原剂
的是
。
3.下列对还原剂的说法:①反应中得电子的物质
②反应中失电子的物质
③反应过程中有元素化合价升高的物质
④反应过程中有元素化合价降低的物质。正确的组合是(
)
A.②③
B.①④
C.①③
D.②④
(四)课堂检测
Fe3+
H+
I
--
Fe2+
S
A
常见的氧化剂和还原剂:
1.常见的氧化剂:
①活泼的非金属单质:如
Cl2、O2、O3等
②元素处于高价态的物质:如
浓硫酸、HNO3
、KMnO4、KClO3、FeCl3等
③某些典型物质:漂白粉、Na2O2、MnO2、H2O2等
2.常见的还原剂:
①活泼的金属单质:如
Na、Al、Zn、Fe、Mg等
②某些非金属单质:H2、C等
③元素处于低价态的物质:如
CO、SO2
、HCl、H2S、Na2SO3、FeCl2、KI等
小结:
1、双线桥、单线桥表示氧化还原反应的方法。
2、氧化性、还原性比较。
3、转移电子数守恒的应用。
4、常见氧化剂和还原剂。
作业:
1、完善笔记。
2、作业第二课时。
氧化还原反应知识扩展(第三课时)
常见的氧化剂和还原剂:
1.常见的氧化剂:
①活泼的非金属单质:如
Cl2、O2、O3等
②元素处于高价态的物质:如
浓硫酸、HNO3
、KMnO4、KClO3、FeCl3等
③某些典型物质:漂白粉、Na2O2、MnO2、H2O2等
2.常见的还原剂:
①活泼的金属单质:如
Na、Al、Zn、Fe、Mg等
②某些非金属单质:H2、C等
③元素处于低价态的物质:如
CO、SO2
、HCl、H2S、Na2SO3、FeCl2、KI等
三、氧化还原反应中转移电子数守恒应用
1、氧化剂得到的电子总数一定等于还原剂失去的电子总数。——转移电子数守恒。
思考:
Al与盐酸反应,2
mol铝反应时,(Al
→
Al3+),失去的电子物质的量是____mol,反应时(
2H+
→
H2),则生成H2的物质的量是
mol
6
3
某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2
mol该离子恰好能使0.6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为(
)
A
.+1
B.
+2
C
.
+3
D.
+4
C
自己总结:常见氧化剂对应还原产物,还原剂对应氧化产物。
Cl2→Cl-
MnO4-
→Mn2+
HNO3
→NO
Fe3+
→Fe2+
O2
→OH-(或H2O)
KClO3
→KCl
等
S2-
→S
SO2(或SO32-)
→SO42-
Fe2+
→Fe3+
I-
→I2
等
(2)Zn与稀硫酸反应生成的氢气正好需要32克氧气才能完全反应生成水,计算发生反应的Zn的质量?
化学方程式:
Zn+H2SO4==ZnSO4+H2↑
2H2+O2===2H2O
点燃
解:有质量守恒可知:
O2
~
2H2
~
2Zn
32
65×2
答:略
Zn+H2SO4==ZnSO4+H2↑
2H2+O2===2H2O
点燃
分析:
反应前的物质是
Zn
H2SO4
O2
反应后的物质
ZnSO4
H2O
化合价变化
0
0
+1
+6
+2
-2
+1
整个反应中
失电子物质
得电子物质
Zn
2个
O2
4个
在化学反应中一定存在转移电子守恒
解:由转移电子守恒可知
氧气得到的电子为:
32
32
×4
==
4
金属锌的质量:
4
2
×65
==130(克)
答:略。
2、氧化还原反应的简单配平:
配平原则:转移电子数守恒、质量守恒
FeCl2
+
Cl2
==
FeCl3
失e-
得2e-
×2
2
2
×1
1
-2
+6
0
+4
得2电子
H2S
+
H2SO4(浓)
=
S↓+
SO2↑+
H2O
失2个电子
×1
×1
2
3、同一种元素参加氧化还原反应时:
化合价最近和化合价归中原理
H2S
+
H2SO4(浓)
=
S↓+
SO2↑+
2H2O
-2
+6
0
+4
还原剂
氧化剂
氧化产物、还原产物?
氧化产物
还原产物
失电子
氧化反应
得电子
还原反应
KClO3
+
6HCl
=
KCl
+
3Cl2↑
+
3H2O
+5
-1
-1
0
KCl中的氯元素来自KClO3?还是HCl?
失5e-
氧化反应
得5e-
还原反应
还原剂
氧化剂
氧化产物
还原产物
3、氧化还原反应中离子不能大量共存:
常见具有氧化性的离子和具有还原性的离子在水溶液中不能大量共存。发生氧化还原反应。
常见氧化性离子:
Fe3+
MnO4-
ClO-
NO3-(H+)
常见还原性离子:
Fe2+
S2-
HS-
SO32-
HSO3-
I-
注意:氧化性Fe3+和还原性Fe2+,同种元素若发生氧化还原反应时,一定要满足化合价归中原则。
因为不能归中,所以Fe3+和Fe2+可以共存。
已知浓硫酸有强氧化性,SO2有强还原性,SO2气体能否用浓硫酸干燥?
能
课堂练习:下列溶液中的离子组,因为发生氧化还原反应而不能大量共存的(
)
A、Cu2+
OH-
Na+
NO3-
B、
Fe2+
H+
NO3-
Cl-
C、MnO4-
K+
Na+
SO32-
D、H+
Cl-
HCO3-
K+
B
C
某无色溶液中,存在如下离子组合,其中因发生氧化还原反应而不能大量共存的(
)
A、Fe3+
Cu2+
Cl-
CO32-
B、MnO4-
S2-
K+
Na+
C、I-
Na+
H+
NO3-
D、Ba2+
OH-
HCO3-
Cl-
C
四、
氧化还原反应方程式的类型,分析其特点和配平方法。
1、单纯的氧化还原反应:
如Zn+H2SO4=ZnSO4+
H2↑
2、氧化还原反应中有酸性作用:
MnO2+4HCl==MnCl2+2H2O+Cl2↑
盐酸的作用:
2摩尔做还原剂
、2摩尔只起酸的作用
3、歧化反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O
(1)配平基准物质:
NaCl+NaClO3
(2)氧化剂和还原剂之比:
以基准物质为准,5
:1
(3)单质的岐化反应,产物中一定有负化合价,此单质一定是非金属。
4、归中反应:2Na2S+Na2SO3+6HCl=6NaCl+3S↓+3H2O
(1)配平基准物质:
Na2S+Na2SO3
(2)氧化产物和还原产物之比:
2
:1
(3)有单质生成的归中反应,反应物中一定有负化合价,此单质一定是非金属。
5、多种氧化剂和还原剂并存的反应:
如:S+KNO3+C——K2S+N2+CO2
首先要找到二者之间的比例关系,然后把这两个物质按照此比例当作一种物质,进行配平。
S+2KNO3+3C=K2S+N2+3CO2
常见问题:
(1)1摩尔硫氧化多少碳?
(2)1摩尔碳能还原多少硫?
2
(3)3摩尔碳被氧化有多少硫被还原?
1
1/2
6、氧化还原反应中的分解反应:
2NH4NO3=2N2+4H2O+O2
(1)分解反应物前面系数规定为一,观察配平。
(2)NH4NO3----N2+H2O+HNO3
分解反应物前面系数规定为一,最麻烦的物质前面系数规定为X,观察配平。
5NH4NO3===4N2+9H2O+2HNO3
7、化合价有多种的反应:Fe3O4+4H2=3Fe+4H2O
利用平均化合价配平。
8、化合价不能确定的反应:FeC3+8HNO3=Fe(NO3)3+3CO2+5NO+4H2O
利用化合价归0法
9、离子方程式中的氧化还原反应:
2MnO4-+5H2S+6H+=2Mn2++5S+8H2O
(1)写出氧化剂、还原剂、氧化产物、还原产物。
MnO4-
+
H2S
——
Mn2+
+
S
由转移电子数相同配平。
2
5
2
5
步骤:
(2)注意溶液的酸碱性
a、酸性条件下,电荷小的一边加H+,另一边加H2O
2MnO4-+5H2S+H+——2Mn2++5S+H2O
根据加水的一边电荷不变,由电荷守恒,配平。
2MnO4-+5H2S+6H+=2Mn2++5S+8H2O
b、碱性条件下,电荷多的一边加OH-
,另一边加H2O
2MnO4-+5S2-+H2O——2Mn2++5S+OH-
根据加水的一边电荷不变,由电荷守恒,配平。
2MnO4-+5S2-+8H2O==2Mn2++5S+16OH-
氧化还原反应(1课时)
学习目标:
1.
从得氧和失氧的分类标准认识氧化还原反应的概念。
2.
从化合价变化的分类标准认识氧化反应、还原
反应的特征
3.
从化合价升降、电子的得失或电子对的偏移角度
理解氧化还原反应
(一)
揭示课堂目标
一、氧化还原反应定义
1.氧化反应和还原反应
从得氧和失氧角度认识氧化还原反应:
(1).
初中化学中,
(填“得”或“失”下同)氧的反应
属于氧化反应;____
氧的反应属于还原反应。
思考:2CuO+
C==2Cu+
CO2
——————(填物质的名称,同)发生氧化反应,
发生还原反应。
得
失
碳
氧化铜
注意:氧化反应和还原反应是一个反应对立
统一的两个方面。
在这个反应中,同时进行了氧化反应和还原反应,像这样的反应,我们称之为氧化还原反应。
2、从化合价升降角度认识氧化还原反应
标出氧化铜与碳反应的化合价并分析变化
2CuO
+
C
==
2Cu
+
CO2
+2
-2
0
0
-2
+4
①碳元素发生
,化合价
(填“升高”或“降低”)。
氧化反应
升高
②铜元素发生
反应,化合价
(填“升高”或“降低”)
降低
还原
③总结:化合价升高的反应叫氧化反应,化合价降低的反应叫还原反应,有化合价升降的反应就是氧化还原反应。
C生成CO2的反应化合价升高是氧化反应
CuO生成Cu的反应化合价降低是还原反应
3.化合价的规律:
一价氢氯钾钠银
二价氧钙钡镁锌
三铝四硅五氮磷
二三铁,二四碳,
二四六硫都齐全
铜汞二价最常见
单质为零要记清
负一氢氧硝酸根 负二碳酸硫酸根
正一价的是铵根
1.
在化合物中金属元素的价态一定为正价,氧元素的价态一般为-2价,氢元素一般+1价
2.
非金属元素一般有一种负价,且负价得绝对值等于8-最外层电子数,
3.
常用元素化合价最高正价一般为最外层电子数(氧、氟)
化合物元素的化合价最高为+7价,
最低价为-4价
5、化合物中元素化合价之和等于0
化合物中元素化合价的判断方法:
1.
先确定只有唯一化合价的元素的化合价,比如:H、O、Na等
2.
再根据化合价总和为0的规律去求出那些变价元素的化合价。
3.
K、Ca、Na、Mg、Al、Zn、Ba在化合物中就一种价态,N
为-3、+1
—
+5;
S
为-2、+4、+6;
Cl为-1、+1、+3
+5、+7
Mn为
+2、+4、+6、+7
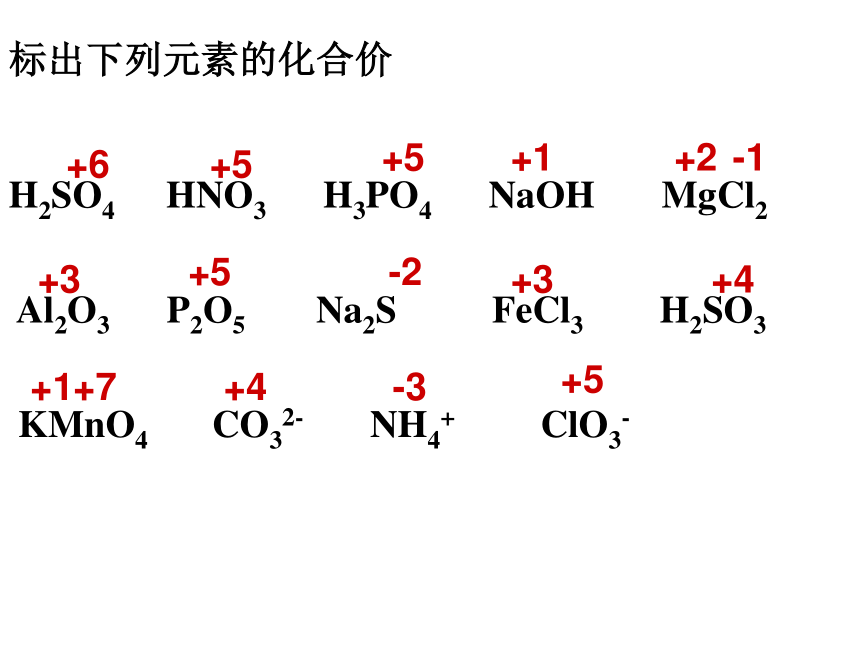
标出下列元素的化合价
H2SO4
HNO3
H3PO4
NaOH
MgCl2
Al2O3
P2O5
Na2S
FeCl3
H2SO3
KMnO4
CO32-
NH4+
ClO3-
+6
+5
+5
+1
+2
-1
+3
+5
-2
+3
+4
+1
+7
+4
-3
+5
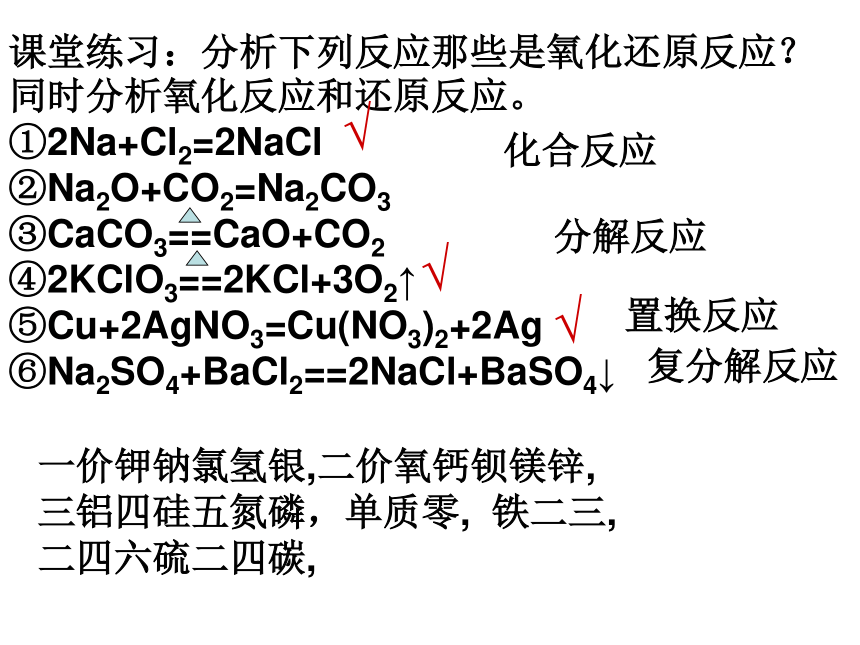
课堂练习:分析下列反应那些是氧化还原反应?同时分析氧化反应和还原反应。
①2Na+Cl2=2NaCl
②Na2O+CO2=Na2CO3
③CaCO3==CaO+CO2
④2KClO3==2KCl+3O2↑
⑤Cu+2AgNO3=Cu(NO3)2+2Ag
⑥Na2SO4+BaCl2==2NaCl+BaSO4↓
一价钾钠氯氢银,二价氧钙钡镁锌,
三铝四硅五氮磷,单质零,??铁二三,
二四六硫二四碳,
√
√
√
化合反应
分解反应
置换反应
复分解反应
总结:氧化还原与四个基本反应的关系
化合反应
分解反应
置换反应
复分解反应
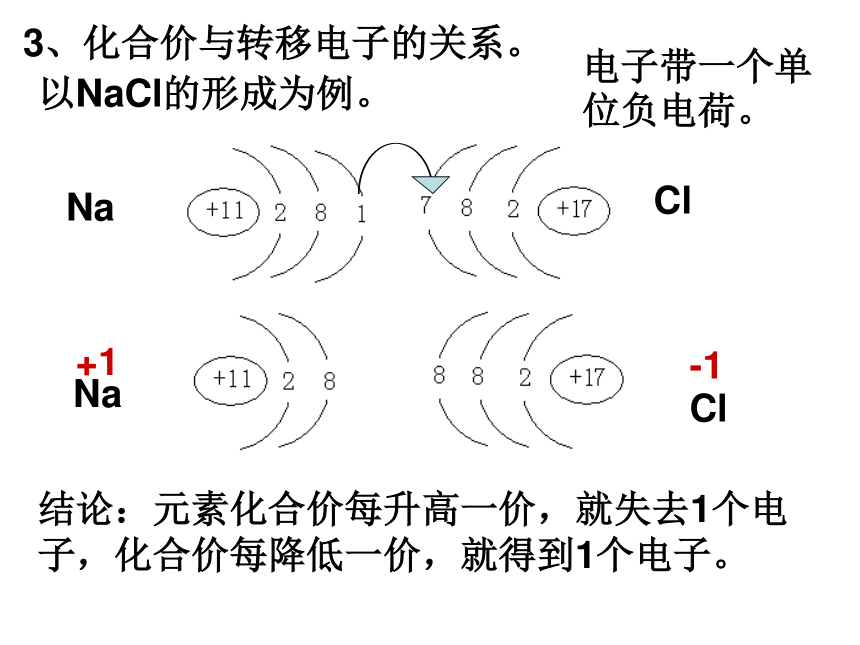
3、化合价与转移电子的关系。
以NaCl的形成为例。
Na
Cl
Na
Cl
+1
-1
结论:元素化合价每升高一价,就失去1个电子,化合价每降低一价,就得到1个电子。
电子带一个单位负电荷。
4、氧化还原反应的实质。
①氧化反应元素的化合价升高,
电子。
②还原反应元素的化合价降低,
电子
失去
得到
③氧化还原反应就是有化合价变化的反应,一定有电子的
。
得失
化学上叫电子的转移
氧化还原反应的实质就是:电子的转移。
总结:氧化反应和还原反应的特征和实质
(1)
特征:反应前后元素
发
生了变化
(2)
本质:发生
转移
的化合价
电子的
达标练习:初中学习的化学反应四种基本类型:分解反应、化合反应、置换反应、复分解反应。其中一定是氧化还原反应的是
。一定不是氧化还原反应的是
。
置换反应
复分解反应
2、分析下列反应指出哪些是氧化还原反应。
3.H2O(g)+C
CO+H2
高温
1.H2+CuO
==
H2O
+
Cu
高温
高温
分析氧化反应和还原反应
指出哪些物质得到或失去电子
0
+2
+1
0
+3
+2
0
+4
+1
0
+2
0
0
0
+1
-2
0
0
+4
-2
①氧化反应元素的化合价升高,
电子。
②还原反应元素的化合价降低,
电子
失去
得到
2、氧化剂和还原剂
氧化剂:得电子的物质是氧化剂。
还原剂:失电子的物质是还原剂。
不是元素
Fe2O3
+
3CO
===
2Fe
+
3CO2
高温
+3
+2
0
+4
Fe2O3中Fe元素化合价从+3价变成了0价,化合价降低,得电子,Fe2O3是氧化剂。
CO中C元素化合价从+2价变成了+4价,化合价升高,失电子,CO是还原剂。
氧化剂(Fe2O3)发生还原反应,被还原。
还原剂(CO)发生氧化反应,被氧化。
课堂练习:指出下列反应的氧化剂和还原剂,氧化反应和还原反应。
Fe+CuS04====FeS04+Cu
Mg+2HCl===MgCl2+H2
0
0
0
0
+2
+2
+2
+1
氧化剂
还原剂
CuS04
Cu
发生还原反应
Fe
FeS04
发生氧化反应
氧化剂
还原剂
HCl
H2
发生还原反应
Mg
MgCl2
发生氧化反应
三、氧化还原反应总结
得、降、氧
升、失、还
得到电子,化合价降低,是氧化剂。失去电子,化合价升高,是还原剂
被还原
被氧化
课堂练习:指出下列氧化还原反应的氧化剂和还原剂。
①S+O2==SO2
②2Na+Cl2==2NaCl
③Cu+2AgNO3==Cu(NO3)2+2Ag
④2H2O==2H2+O2
⑤2H2S+SO2==3S+2H2O
氧化剂
还原剂
O2
S
Cl2
Na
AgNO3
Cu
H2O
H2O
SO2
H2S
得、降、氧
升、失、还
氧化剂被还原,发生还原反应,其产物叫还原产物。还原剂被氧化,发生氧化反应,其产物叫氧化产物。
C
CaCO3
CO2
D
H2
H2O
A
KCl
AgCl
B
CuSO4
Cu
1、下列变化中,元素化合价升高的是
(四)课堂检测和巩固:
D
B
AB
▲
氧化还原反应的特征:
▲
氧化还原反应的本质:
元素化合价发生了变化
电子发生转移
总结:
▲熟记概念:得、降、氧
升、失、还
化合价——得失电子——氧化剂和还原剂
氧化剂——被还原——发生还原反应——产物是还原产物
还原剂——被氧化——发生氧化反应——产物是氧化产物。
作业:
1、完善笔记。
2、预习第二课时。
3、完成课时作业(1)
第三节
氧化还原反应
第二课时
学习目标:
1.应用电子转移的观点进一步理解氧化还原反应。
2.认识氧化还原反应中各有关物质的相互关系
3.掌握常见氧化剂和还原剂的判断
(一)
揭示课堂目标
一、氧化还原反应表示方法。
1、双线桥表示法
①写出正确的氧化还原化学方程式。
CuO
+
H2
==
Cu
+
H2O
②标出反应前后元素化合价的变化
CuO
+
H2
==
Cu
+
H2O
+2
0
0
+1
化合价降低2价
得2e-
氧化剂
被还原
化合价升高2价
失2e-
被氧化
还原剂
③标出得失电子数,指明氧化剂和还原剂及反应
注意:箭头出入方向
还原产物
氧化产物
同一元素
课堂练习:用双线桥表示下列氧化还原反应,并指出氧化剂和还原剂
Zn
+
H2SO4
==
ZnSO4
+
H2↑
MnO2
+
4HCl(浓)
==
MnCl2
+
Cl2↑
+
2H2O
得2e-
还原反应
失2e-
氧化反应
氧化剂
还原剂
得2e-
被还原
失2e-
被氧化
氧化剂
还原剂
还原产物
氧化产物
还原产物
氧化产物
2、单线桥表示法
①写出正确的氧化还原化学方程式。
②标出反应前后元素化合价的变化
0
+1
2Na
+
2H2O
===
2NaOH
+
H2↑
2Na
+
2H2O
===
2NaOH
+
H2↑
+1
0
③标出得失电子数,指明氧化剂和还原剂
注意:箭头出入方向
2e-
氧化剂
还原剂
失电子元素指向得电子元素
课堂练习:用单线桥表示转移电子和氧化剂、还原剂。
Zn
+
H2SO4
==
ZnSO4
+
H2↑
SO2
+
2H2S
=
3S
+
2H2O
2KMnO4
==
K2MnO4+MnO2
+O2
↑
2e-
氧化剂
还原剂
4e-
还原剂
氧化剂
4e-
还原剂
氧化剂
二、氧化性和还原性。
氧化剂:
在化学反应中
电子(或电子对偏向)的物质叫氧化剂,在反应时氧化剂所含某一元素的化合价
。反应时本身被
。
1.氧化剂和还原剂
得到
降低
还原
氧化剂得到电子的能力或性质叫氧化性,因此氧化剂都具有氧化性。
还原剂:
在化学反应中
电子(或电子对偏远)的物质叫还原剂,在反应时还原剂所含某一元素的化合价
。反应时本身被
。
失去
升高
氧化
还原剂失去电子的能力或性质叫还原性,因此还原剂都具有还原性。
2、氧化性和还原性比较。
氧化剂+还原剂
===
氧化产物+还原产物
氧化性:氧化剂
>
氧化产物;
还原性:还原剂
>
还原产物
思考:
对Zn
+
CuCl2
===
ZnCl2
+
Cu反应而言,氧化剂
。还原剂
。
氧化产物
。还原产物
。
还原性:
>____________
氧化性:
>____________
CuCl2
Zn
ZnCl2
Cu
Zn
Cu
CuCl2
ZnCl2
氧化性:氧化剂
氧化性>还原剂的氧化性;
还原性:还原剂还原性
>
氧化剂的还原性。
还原性:
>____________
氧化性:
>____________
Zn
CuCl2
CuCl2
Zn
应用:X2+2Y-=Y2+2X-
,Y2+2Z-=2Y-+Z2
则氧化性由强到弱的顺序
X2
Y2
Z2
比较:Z-
Y-
X-的还原性
氧化性比较先找氧化剂。
还原性比较先找还原剂。
>
>
>
>
规律(2)金属元素还原性大小顺序:
金属活动性
K,
Ca,
Na,
Mg,
Al,
Zn,
Fe,
Sn,
Pb
(H+)
Cu,
Fe3+,
Hg,
Ag,
Pt,
Au。
K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Sn2+,Pb2+
(H+)
Cu2+,
Fe3+,Hg2+,Ag+,
Pt+,
Au+。
还原性渐弱
氧化性渐强
金属活动性
还原性渐弱
氧化性渐强
分析下列化学反应能发生的是(
)
A、Cu+2Ag+
=Cu2++2Ag
B、
Cu+Fe2+
=Fe+Cu2+
√
规律(3)氧化还原反应发生的原因是:
强制弱。
所有氧化能力强的氧化剂都可以在一定条件下制取氧化能力弱的氧化剂。(非金属元素的比较)
所有还原能力强的还原剂都可以在一定条件下制取还原能力弱的还原剂。(金属元素的比较)
分析下列化学反应能发生的是(
)
A、Cu+2Ag+
=Cu2++2Ag
B、
Cu+Fe2+
=Fe+Cu2+
√
F2,
KMnO4,
O2,
Cl2,
Br2,
Fe3+,
I2,
S
氧化性渐弱
F-,
Mn2+,
H2O(OH-),
Cl-,
Br-,
Fe2+,
I-,
S2-
还原性渐强
离子的氧化性,还原性正相反
规律(4)具有多种化合价的元素
元素处于中间价态时,一般既有氧化性又有还原性
2Na+S==Na2S
S+O2==SO2
2SO2+O2====2SO3
催化剂
元素处于最低价态时,只有还原性。如:Na
元素处于最高价态时,只有氧化性。如:Fe3+
C
2.在Fe2+、Fe3+、S
I
--、H+中只能作氧化
剂的是
,只能作还原剂的
是
,
既能作氧化剂又能作还原剂
的是
。
3.下列对还原剂的说法:①反应中得电子的物质
②反应中失电子的物质
③反应过程中有元素化合价升高的物质
④反应过程中有元素化合价降低的物质。正确的组合是(
)
A.②③
B.①④
C.①③
D.②④
(四)课堂检测
Fe3+
H+
I
--
Fe2+
S
A
常见的氧化剂和还原剂:
1.常见的氧化剂:
①活泼的非金属单质:如
Cl2、O2、O3等
②元素处于高价态的物质:如
浓硫酸、HNO3
、KMnO4、KClO3、FeCl3等
③某些典型物质:漂白粉、Na2O2、MnO2、H2O2等
2.常见的还原剂:
①活泼的金属单质:如
Na、Al、Zn、Fe、Mg等
②某些非金属单质:H2、C等
③元素处于低价态的物质:如
CO、SO2
、HCl、H2S、Na2SO3、FeCl2、KI等
小结:
1、双线桥、单线桥表示氧化还原反应的方法。
2、氧化性、还原性比较。
3、转移电子数守恒的应用。
4、常见氧化剂和还原剂。
作业:
1、完善笔记。
2、作业第二课时。
氧化还原反应知识扩展(第三课时)
常见的氧化剂和还原剂:
1.常见的氧化剂:
①活泼的非金属单质:如
Cl2、O2、O3等
②元素处于高价态的物质:如
浓硫酸、HNO3
、KMnO4、KClO3、FeCl3等
③某些典型物质:漂白粉、Na2O2、MnO2、H2O2等
2.常见的还原剂:
①活泼的金属单质:如
Na、Al、Zn、Fe、Mg等
②某些非金属单质:H2、C等
③元素处于低价态的物质:如
CO、SO2
、HCl、H2S、Na2SO3、FeCl2、KI等
三、氧化还原反应中转移电子数守恒应用
1、氧化剂得到的电子总数一定等于还原剂失去的电子总数。——转移电子数守恒。
思考:
Al与盐酸反应,2
mol铝反应时,(Al
→
Al3+),失去的电子物质的量是____mol,反应时(
2H+
→
H2),则生成H2的物质的量是
mol
6
3
某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2
mol该离子恰好能使0.6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为(
)
A
.+1
B.
+2
C
.
+3
D.
+4
C
自己总结:常见氧化剂对应还原产物,还原剂对应氧化产物。
Cl2→Cl-
MnO4-
→Mn2+
HNO3
→NO
Fe3+
→Fe2+
O2
→OH-(或H2O)
KClO3
→KCl
等
S2-
→S
SO2(或SO32-)
→SO42-
Fe2+
→Fe3+
I-
→I2
等
(2)Zn与稀硫酸反应生成的氢气正好需要32克氧气才能完全反应生成水,计算发生反应的Zn的质量?
化学方程式:
Zn+H2SO4==ZnSO4+H2↑
2H2+O2===2H2O
点燃
解:有质量守恒可知:
O2
~
2H2
~
2Zn
32
65×2
答:略
Zn+H2SO4==ZnSO4+H2↑
2H2+O2===2H2O
点燃
分析:
反应前的物质是
Zn
H2SO4
O2
反应后的物质
ZnSO4
H2O
化合价变化
0
0
+1
+6
+2
-2
+1
整个反应中
失电子物质
得电子物质
Zn
2个
O2
4个
在化学反应中一定存在转移电子守恒
解:由转移电子守恒可知
氧气得到的电子为:
32
32
×4
==
4
金属锌的质量:
4
2
×65
==130(克)
答:略。
2、氧化还原反应的简单配平:
配平原则:转移电子数守恒、质量守恒
FeCl2
+
Cl2
==
FeCl3
失e-
得2e-
×2
2
2
×1
1
-2
+6
0
+4
得2电子
H2S
+
H2SO4(浓)
=
S↓+
SO2↑+
H2O
失2个电子
×1
×1
2
3、同一种元素参加氧化还原反应时:
化合价最近和化合价归中原理
H2S
+
H2SO4(浓)
=
S↓+
SO2↑+
2H2O
-2
+6
0
+4
还原剂
氧化剂
氧化产物、还原产物?
氧化产物
还原产物
失电子
氧化反应
得电子
还原反应
KClO3
+
6HCl
=
KCl
+
3Cl2↑
+
3H2O
+5
-1
-1
0
KCl中的氯元素来自KClO3?还是HCl?
失5e-
氧化反应
得5e-
还原反应
还原剂
氧化剂
氧化产物
还原产物
3、氧化还原反应中离子不能大量共存:
常见具有氧化性的离子和具有还原性的离子在水溶液中不能大量共存。发生氧化还原反应。
常见氧化性离子:
Fe3+
MnO4-
ClO-
NO3-(H+)
常见还原性离子:
Fe2+
S2-
HS-
SO32-
HSO3-
I-
注意:氧化性Fe3+和还原性Fe2+,同种元素若发生氧化还原反应时,一定要满足化合价归中原则。
因为不能归中,所以Fe3+和Fe2+可以共存。
已知浓硫酸有强氧化性,SO2有强还原性,SO2气体能否用浓硫酸干燥?
能
课堂练习:下列溶液中的离子组,因为发生氧化还原反应而不能大量共存的(
)
A、Cu2+
OH-
Na+
NO3-
B、
Fe2+
H+
NO3-
Cl-
C、MnO4-
K+
Na+
SO32-
D、H+
Cl-
HCO3-
K+
B
C
某无色溶液中,存在如下离子组合,其中因发生氧化还原反应而不能大量共存的(
)
A、Fe3+
Cu2+
Cl-
CO32-
B、MnO4-
S2-
K+
Na+
C、I-
Na+
H+
NO3-
D、Ba2+
OH-
HCO3-
Cl-
C
四、
氧化还原反应方程式的类型,分析其特点和配平方法。
1、单纯的氧化还原反应:
如Zn+H2SO4=ZnSO4+
H2↑
2、氧化还原反应中有酸性作用:
MnO2+4HCl==MnCl2+2H2O+Cl2↑
盐酸的作用:
2摩尔做还原剂
、2摩尔只起酸的作用
3、歧化反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O
(1)配平基准物质:
NaCl+NaClO3
(2)氧化剂和还原剂之比:
以基准物质为准,5
:1
(3)单质的岐化反应,产物中一定有负化合价,此单质一定是非金属。
4、归中反应:2Na2S+Na2SO3+6HCl=6NaCl+3S↓+3H2O
(1)配平基准物质:
Na2S+Na2SO3
(2)氧化产物和还原产物之比:
2
:1
(3)有单质生成的归中反应,反应物中一定有负化合价,此单质一定是非金属。
5、多种氧化剂和还原剂并存的反应:
如:S+KNO3+C——K2S+N2+CO2
首先要找到二者之间的比例关系,然后把这两个物质按照此比例当作一种物质,进行配平。
S+2KNO3+3C=K2S+N2+3CO2
常见问题:
(1)1摩尔硫氧化多少碳?
(2)1摩尔碳能还原多少硫?
2
(3)3摩尔碳被氧化有多少硫被还原?
1
1/2
6、氧化还原反应中的分解反应:
2NH4NO3=2N2+4H2O+O2
(1)分解反应物前面系数规定为一,观察配平。
(2)NH4NO3----N2+H2O+HNO3
分解反应物前面系数规定为一,最麻烦的物质前面系数规定为X,观察配平。
5NH4NO3===4N2+9H2O+2HNO3
7、化合价有多种的反应:Fe3O4+4H2=3Fe+4H2O
利用平均化合价配平。
8、化合价不能确定的反应:FeC3+8HNO3=Fe(NO3)3+3CO2+5NO+4H2O
利用化合价归0法
9、离子方程式中的氧化还原反应:
2MnO4-+5H2S+6H+=2Mn2++5S+8H2O
(1)写出氧化剂、还原剂、氧化产物、还原产物。
MnO4-
+
H2S
——
Mn2+
+
S
由转移电子数相同配平。
2
5
2
5
步骤:
(2)注意溶液的酸碱性
a、酸性条件下,电荷小的一边加H+,另一边加H2O
2MnO4-+5H2S+H+——2Mn2++5S+H2O
根据加水的一边电荷不变,由电荷守恒,配平。
2MnO4-+5H2S+6H+=2Mn2++5S+8H2O
b、碱性条件下,电荷多的一边加OH-
,另一边加H2O
2MnO4-+5S2-+H2O——2Mn2++5S+OH-
根据加水的一边电荷不变,由电荷守恒,配平。
2MnO4-+5S2-+8H2O==2Mn2++5S+16OH-
