气体的制取与净化
图片预览



文档简介
(共26张PPT)
气体的制备与净化
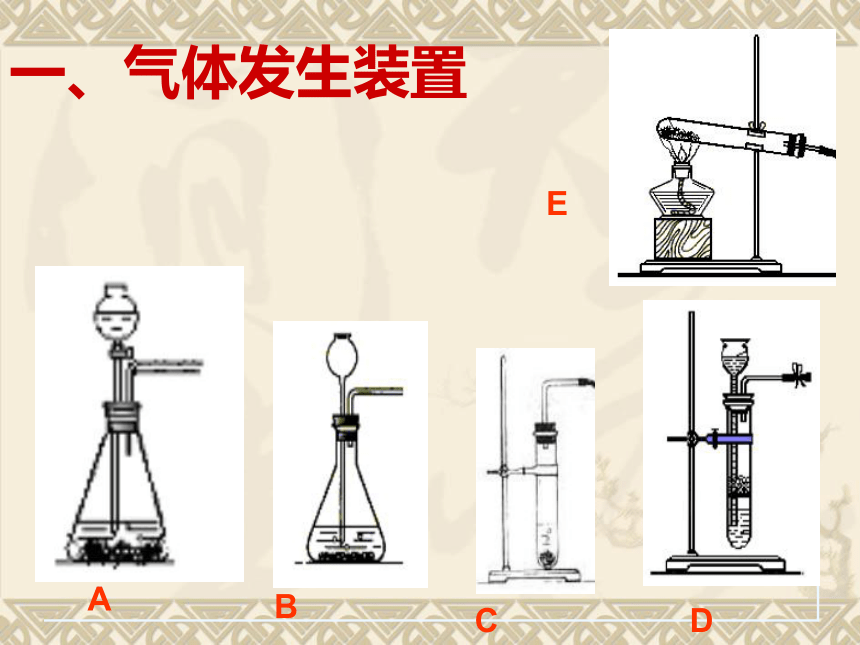
一、气体发生装置
A
B
D
C
E
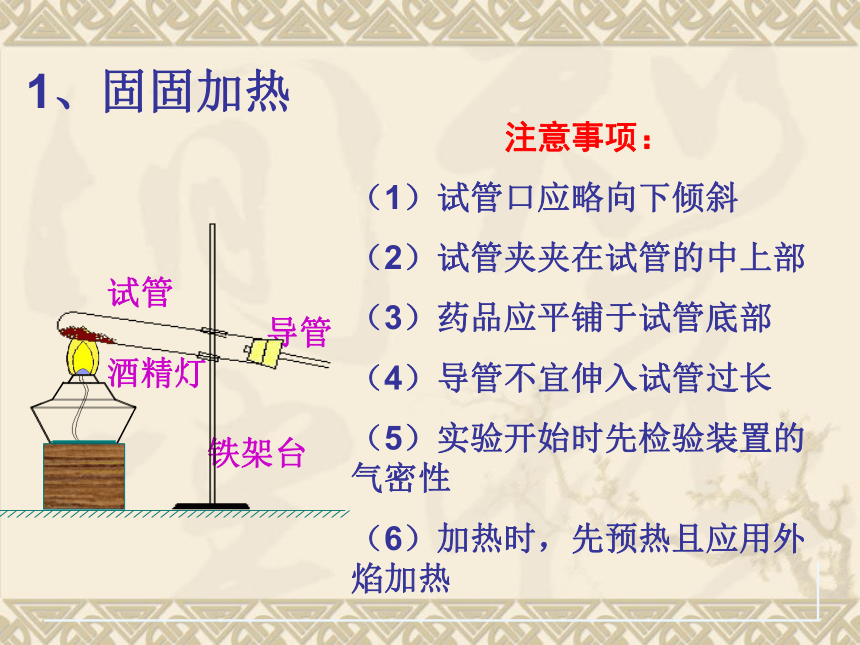
试管
导管
酒精灯
铁架台
注意事项:
(1)试管口应略向下倾斜
(2)试管夹夹在试管的中上部
(3)药品应平铺于试管底部
(4)导管不宜伸入试管过长
(5)实验开始时先检验装置的 气密性
(6)加热时,先预热且应用外焰加热
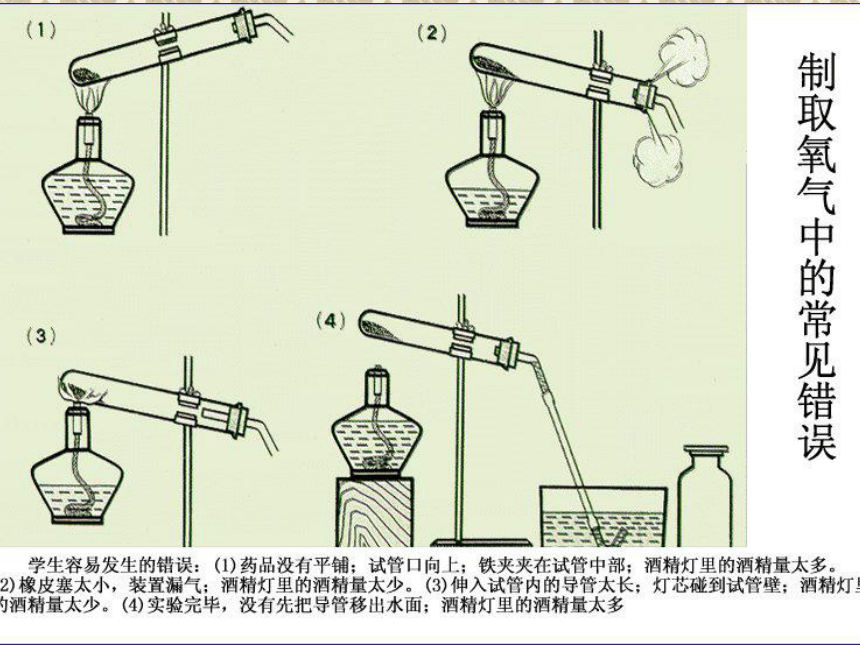
1、固固加热
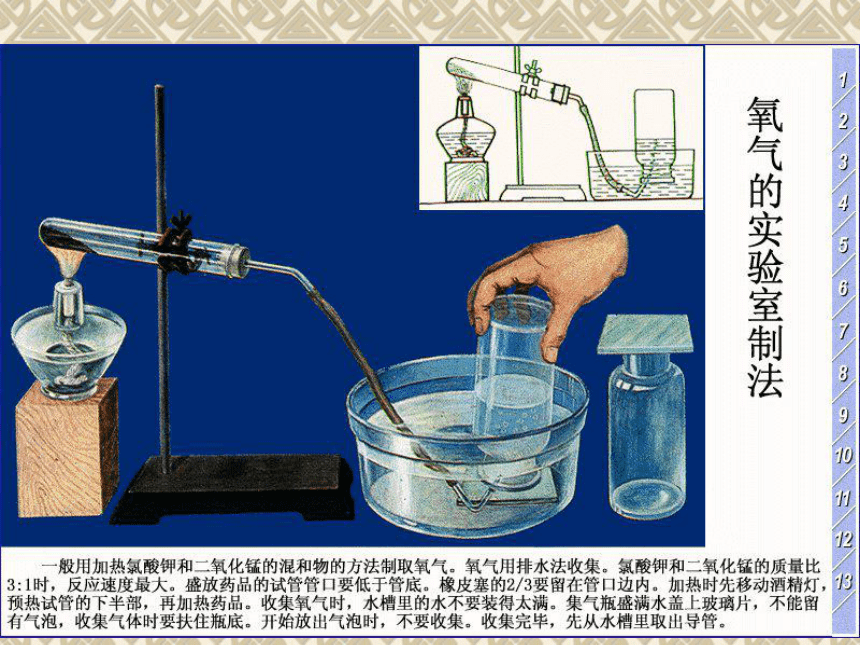
该装置可用于制备O2
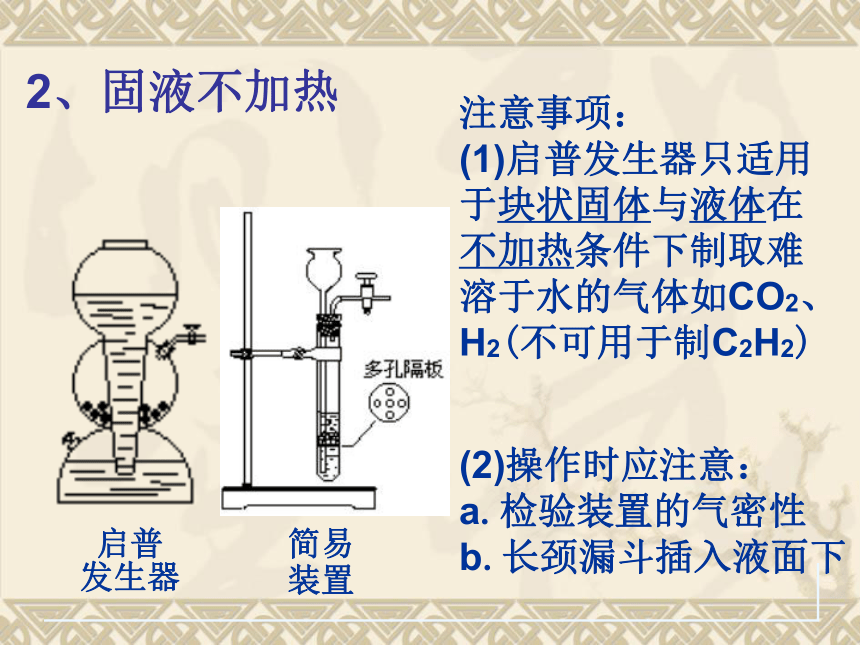
启普
发生器
简易
装置
注意事项:
(1)启普发生器只适用于块状固体与液体在不加热条件下制取难溶于水的气体如CO2、H2(不可用于制C2H2)
(2)操作时应注意:
a.检验装置的气密性
b.长颈漏斗插入液面下
2、固液不加热
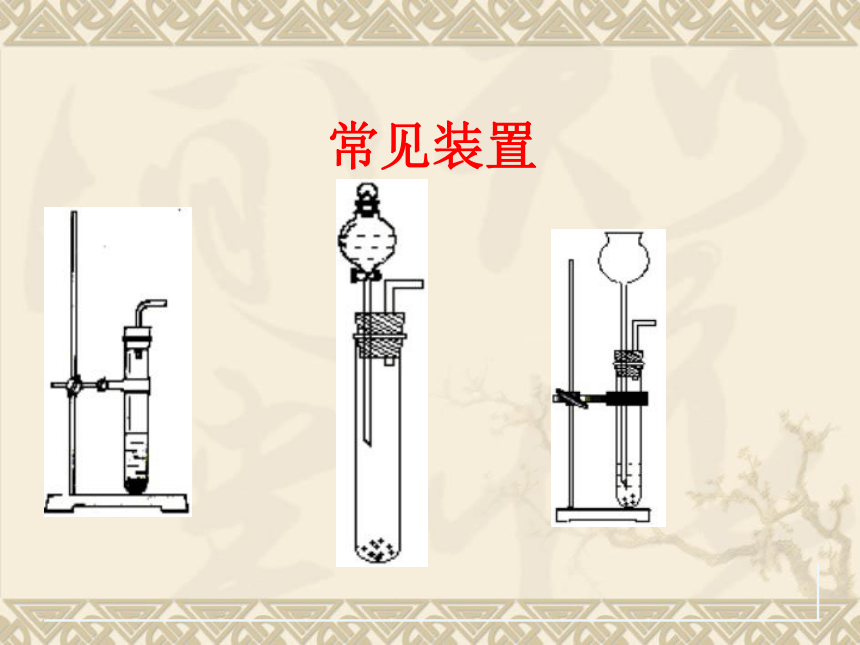
常见装置
可用于制备O2 、 CO2、 H2、 NH3
氢
气体收集装置的设计原则:
根据气体的溶解性或密度
二、收集装置
装置类型 排水法 向上排气法 向下排气法
示意图
气体性质 难溶或微溶于水的气体 密度大于空 气的气体 密度小于空气的气体
实例 H2,O2,NO,
C2H2,N2,CO CO2,Cl2,HCl H2,NH3
(量气装置)
气体净化装置的设计原则:
根据净化药品的状态和净化条件
三、净化装置
干燥剂的选择及使用原则
选择原则
①气体在被干燥的过程中要不能被减少
②不要引入新的杂质。
洗气瓶
进气管应“长进
短出”
干燥管
应大口方向进
气,小口方向
出气
液体试剂
固体试剂
常见干燥剂及使用装置
液态干燥剂 固态干燥剂
装
置
常见干燥剂
可干燥
气体
不可干燥 气体
→ →
浓硫酸
无水CaCl2
碱石灰
H2,O2, Cl2, SO2,
CO, N2, CH4
O2,Cl2,HCl,SO2, H2,CO,N2,CH4
H2,O2, N2,
CH4, NH3
H2S, NH3, HBr, HI
H2S,SO2, CO2,NO2, Cl2
NH3
1、 燃烧法
如CH4、H2、CO等。
2、碱液吸收法
如Cl2、H2S、CO2、SO2、NO2等。
3、水溶解法
如HCl、NH3等。
四、除尾气装置
4、袋装储存法
NO等
思考:
分析右图装置有哪些作用?
1、净化气体
2、收集气体(密度比空气大)
4、排水集气法收集气体
3、收集气体(密度比空气小)
用稀盐酸和锌粒反应制取氢气时,常常混有氯化氢、水蒸气等杂质。设计实验证明并除去杂质,取得纯净干燥的氢气。
无水硫酸铜
a
b
c
d
e
f
g
h
A
B
C
D
E
1、要制备纯净干燥的氢气,各仪器的连接顺序是(按接口字母)___________________
2、C装置中发生的现象是__________作用是__________
3、D装置中发生的现象是__________作用是____________
a→f →g →e →d →b →c →h
产生白色沉淀
检验并除去氯化氢气体
白色固体变蓝色
证明水蒸气存在并吸收水蒸气
练一练:
为了验证某混合气体由H2、CO和HCl三种气体组成,请从下图中选择适当的装置设计一实验,并回答问题(假设每步均完全反应):
1、首先你想证明哪种气体是否存在?
2、装置连接的顺序是 。
3、 A装置在实验过程中玻璃管中现象
C-B-A-E-D
管壁有水珠产生,黑色变红色
气体的制备与净化
一、气体发生装置
A
B
D
C
E
试管
导管
酒精灯
铁架台
注意事项:
(1)试管口应略向下倾斜
(2)试管夹夹在试管的中上部
(3)药品应平铺于试管底部
(4)导管不宜伸入试管过长
(5)实验开始时先检验装置的 气密性
(6)加热时,先预热且应用外焰加热
1、固固加热
该装置可用于制备O2
启普
发生器
简易
装置
注意事项:
(1)启普发生器只适用于块状固体与液体在不加热条件下制取难溶于水的气体如CO2、H2(不可用于制C2H2)
(2)操作时应注意:
a.检验装置的气密性
b.长颈漏斗插入液面下
2、固液不加热
常见装置
可用于制备O2 、 CO2、 H2、 NH3
氢
气体收集装置的设计原则:
根据气体的溶解性或密度
二、收集装置
装置类型 排水法 向上排气法 向下排气法
示意图
气体性质 难溶或微溶于水的气体 密度大于空 气的气体 密度小于空气的气体
实例 H2,O2,NO,
C2H2,N2,CO CO2,Cl2,HCl H2,NH3
(量气装置)
气体净化装置的设计原则:
根据净化药品的状态和净化条件
三、净化装置
干燥剂的选择及使用原则
选择原则
①气体在被干燥的过程中要不能被减少
②不要引入新的杂质。
洗气瓶
进气管应“长进
短出”
干燥管
应大口方向进
气,小口方向
出气
液体试剂
固体试剂
常见干燥剂及使用装置
液态干燥剂 固态干燥剂
装
置
常见干燥剂
可干燥
气体
不可干燥 气体
→ →
浓硫酸
无水CaCl2
碱石灰
H2,O2, Cl2, SO2,
CO, N2, CH4
O2,Cl2,HCl,SO2, H2,CO,N2,CH4
H2,O2, N2,
CH4, NH3
H2S, NH3, HBr, HI
H2S,SO2, CO2,NO2, Cl2
NH3
1、 燃烧法
如CH4、H2、CO等。
2、碱液吸收法
如Cl2、H2S、CO2、SO2、NO2等。
3、水溶解法
如HCl、NH3等。
四、除尾气装置
4、袋装储存法
NO等
思考:
分析右图装置有哪些作用?
1、净化气体
2、收集气体(密度比空气大)
4、排水集气法收集气体
3、收集气体(密度比空气小)
用稀盐酸和锌粒反应制取氢气时,常常混有氯化氢、水蒸气等杂质。设计实验证明并除去杂质,取得纯净干燥的氢气。
无水硫酸铜
a
b
c
d
e
f
g
h
A
B
C
D
E
1、要制备纯净干燥的氢气,各仪器的连接顺序是(按接口字母)___________________
2、C装置中发生的现象是__________作用是__________
3、D装置中发生的现象是__________作用是____________
a→f →g →e →d →b →c →h
产生白色沉淀
检验并除去氯化氢气体
白色固体变蓝色
证明水蒸气存在并吸收水蒸气
练一练:
为了验证某混合气体由H2、CO和HCl三种气体组成,请从下图中选择适当的装置设计一实验,并回答问题(假设每步均完全反应):
1、首先你想证明哪种气体是否存在?
2、装置连接的顺序是 。
3、 A装置在实验过程中玻璃管中现象
C-B-A-E-D
管壁有水珠产生,黑色变红色
