高中化学人教版选修3第二章第二节 分子的立体结构 分析晶体的结构和性质特点 课件(86张PPT)
文档属性
| 名称 | 高中化学人教版选修3第二章第二节 分子的立体结构 分析晶体的结构和性质特点 课件(86张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 10.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-22 00:00:00 | ||
图片预览










文档简介
(共86张PPT)
物质结构与性质
选修3
微粒为分子:分子间作用力(或范德华力)或氢键;
微粒为原子:极性共价键或非极性共价键;
微粒为离子:离子键。
复习总结:
微粒间作用
构成物质的微粒主要有三种:原子、离子和分子,金属单质是由金属阳离子和自由电子构成的,大部分非金属单质和大部分的共价化合物是由分子构成的,金刚石和单质硅是由原子直接构成的,离子化合物是由离子构成的。
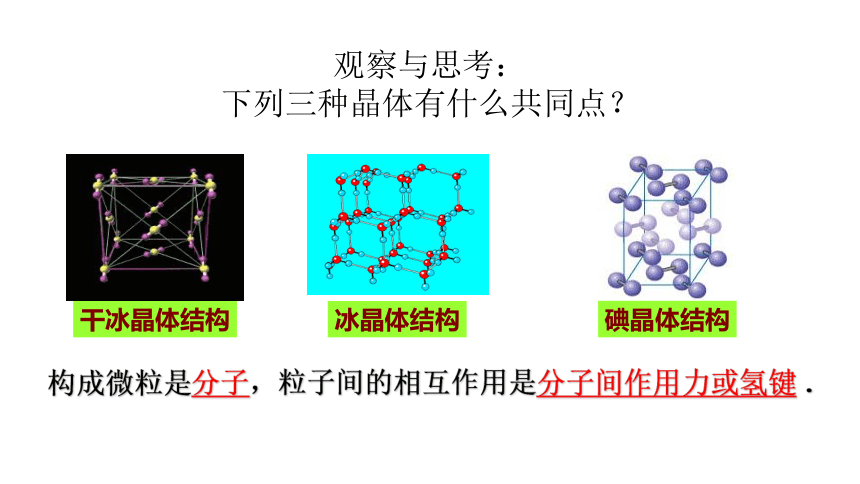
观察与思考:
下列三种晶体有什么共同点?
碘晶体结构
干冰晶体结构
冰晶体结构
构成微粒是分子,粒子间的相互作用是分子间作用力或氢键
.
分子晶体
一、概念:分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体。(或者说只含分子的晶体)
注意:
构成粒子:分子(构成分子的原子间以共价键结合)
有单个分子存在,化学式就是分子式。
稀有气体分子为单原子分子,无共价键。
分子晶体粒子间的相互作用
分子晶体中的分子内原子间的相互作用是共价键。
因为共价键具有饱和性,而分子又都是原子通过共价键结合而成的,因此分子与分子之间不会有强烈的相互作用,导致分子晶体中的分子间的相互作用比化学键弱得多,这种相互作用称为分子间作用力,又称范德瓦耳斯力。
分子晶体在气化或熔化时破坏的作用力为:分子间作用力。
二、分子晶体的物理特性:
(1)熔、沸点较低,易升华。
常温下为气态的物质一定是分子晶体;
常温下为液态的物质大部分是分子晶体;
稀有气体是分子晶体,C60是分子晶体。
(2)较小的硬度(多数分子晶体在常温时为气态或液态)
(3)一般都是绝缘体,固态或熔融状态不导电。
(4)溶解性与溶质、溶剂的分子的极性相关——相似相溶,氢键。
原因:分子间作用力很弱
(1)所有非金属氢化物:
H2O,
H2S,
NH3,
CH4,
HX
(2)
部分非金属单质:
X2,
N2,
O2,
H2,
S8,
P4,
C60
(3)
部分非金属氧化物:
CO2,
SO2,
N2O4,
P4O6,
P4O10
(4)
几乎所有的酸:
H2SO4,
HNO3,
H3PO4
(5)
大多数有机物:
乙醇,冰醋酸,蔗糖
三、典型的分子晶体
【巩固练习】
1.下列晶体由原子直接构成,且属于分子晶体的是
(
)
A.固态氢
B.固态氖
C.白磷
D.三氧化硫
2.
共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是
(
)
A.
干冰
B.
氯化钠
C.
氢氧化钠
D.
碘
B
B
【巩固练习】
3.
支持固态氨是分子晶体的事实是
(
)
A.
氮原子不能形成阳离子
B.
铵离子不能单独存在
C.
常温下,氨是气态物质
D.
氨极易溶于水
C
物质结构与性质
选修3
学段学科——高中
四、分子晶体熔、沸点高低的比较规律
分子晶体要熔化或汽化都需要克服分子间的作用力。分子间作用力越大,物质熔化和汽化时需要的能量就越多,物质的熔、沸点就越高。
因此,比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范力和氢键)的大小。
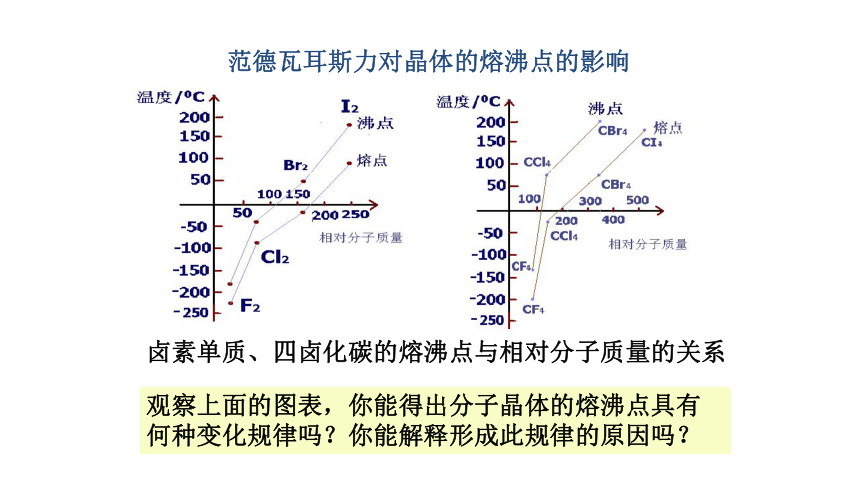
范德瓦耳斯力对晶体的熔沸点的影响
观察上面的图表,你能得出分子晶体的熔沸点具有何种变化规律吗?你能解释形成此规律的原因吗?
比较下列物质熔沸点的高低
1、CH3CH2CH2CH3
CH3CH2CH2CH2CH3
2、ClCH2CHClCCl3
ClCH2CHClCH2CHClCCl3
3、O2
S
Se
Te
Po
一般来说,结构和组成相似的物质,相对分子量越大,分子间作用力越大,物质的熔沸点越高。但也有一些反常情况,例如:H2O、H2S、H2Se、H2Te
等的结构和组成相似,但相对分子量小的H2O熔沸点却比H2S、H2Se、H2Te的熔沸点高,除此之外,还有一些物质也有这种情况出现,请大家观察下表。
问题:这是由于什么原因造成的呢?
(1)组成和结构相似的物质,
___________________________________
烷烃、烯烃、炔烃、饱和一元醇、醛、羧酸等同系物的沸点均随着碳原子数的增加而升高。
分子间有氢键的物质(HF、H2O、NH3等)熔、沸点反常增大。
形成分子内氢键的物质,其熔、沸点低于形成分子间氢键的物质。(如邻羟基苯甲醛的熔沸点低于对羟基苯甲醛的熔沸点)
分子量越大,熔沸点越高。
(2)在烷烃的同分异构体中,一般来说,支链数越多,______________。如沸点:正戊烷
>
异戊烷
>
新戊烷;芳香烃及其衍生物苯环上的同分异构体一般按照“____________________”的顺序。
注意:分子的稳定性则决定于共价键的强弱.
熔沸点越低
邻位
>
间位
>
对位
物质结构与性质
选修3
学段学科——高中
五、分子晶体的结构特征和结构模型
(1)只有范德华力,无分子间氢键-分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰
、I2、O2)
(2)有分子间氢键-不具有分子密堆积特征(如:HF
、冰、NH3
)
分子的密堆积
(与CO2分子距离最近的CO2分子共有12个
)
干冰的晶体结构图
分子的密堆积
(与每个分子距离最近的相同分子共有12个
)
氧(O2)的晶体结构
碳60的晶胞
冰中1个水分子周围有4个水分子
冰的结构
氢键具有方向性
分子的非密堆积
冰中1个水分子周围有4个水分子形成什么空间构型?
笼状化合物
〖思考〗为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。
由于分子间作用力特别是氢键的方向性,导致晶体冰中有相当大的空隙,所以相同状况下体积较大
由于CO2分子的相对分子质量>H2O,所以干冰的密度大。
〖归纳要点〗分子的密度取决于晶体的体积,取决于紧密堆积程度,分子晶体的紧密堆积由以下两个因素决定:
(1)范德华力
(2)分子间氢键
物质结构与性质
选修3
学段学科——高中
晶体结构的计算类型:
晶体结构是近几年来高考考查的重点和热点,特别是晶体结构的计算更是其中的重中之重,它体现了高考考试说明中提出的“将化学问题抽象为数学问题,利用数学工具,通过计算推理解决化学问题的能力”的要求。
晶体结构的计算通常有以下类型:
晶体结构的计算类型:
一.晶体中距离最近的微粒数的计算
二.晶体中结构单元微粒实际数目的计算、各种晶体化学式的确定
三.晶体中化学键数目的计算
四.综合计算
分子晶体中距离最近的微粒数的计算
例1:二氧化碳晶体中,与二氧化碳分子距离最近的二氧化碳分子有
个
解析:在图1
的二氧化碳分子晶体结构中,8个二氧化碳分子处于正方体的8个顶点上,还有6个处于正方体的六个面的面心上。此时可选定面心的二氧化碳分子为基准,设正方体的边长为a,则二氧化碳分子间的最近距离为
,从图中看有8个,它们分别位于该侧
面的四个顶点及与之相连的四个面的面心上。
例2:(改自97高考)1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体,如下图,该结构的建立基于以下考虑:C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;碳与碳之间既有单键又有双键,每个碳原子仍然满足四个价键饱和;多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2。
请回答:
(1)一个C60分子中有多少个五边形和多少个六边形?
(2)一个C60分子中有多少个C=C?
(3)已知C70分子的结构模型也遵循C60的那些规律,请确定C70分子结构中上述几项参数。
晶体中化学键数目的计算
解析:(1)设C60分子中含有x个五边形和y个六边形。先求欧拉定理中棱边数:每个顶点伸出三条棱,而每条棱又总是由两个顶点共有,所以,每个顶点单独伸出的棱有3×1/2=1.5条,60个顶点共伸出的棱为60×1.5=90条。至此,依据欧拉定理可写出:60+x+y-90=2
①
为了求出x和y,还要建立一个方程式。因为五边形和六边形构成多面体时是共用棱边和顶点的,所以,还可以根据棱边数守恒和顶点数守恒写出两个方程式。
棱边数守恒:
每条棱是由两个多面体共用的,所以,一个五边形单独占有的棱边数为5/2=2.5条,一个六边形单独占有的棱边数为6/2=3条,所以,2.5x+3y=90
②
至此联立①②可以解得:x=12,y=20。
顶点数守恒:
每个顶点是由三个多面体共有,所以,一个五边形单独占有的顶点数为5/3个,一个六边形单独占有的顶点数为6/3=2个,所以,5/3x+2y=60
③,联立①③也可以解出x、y,但只联立②③不可以解出。
(2)首先要明确一个概念:在图中顶点间形成的棱都以单线标出,但有的是表示单键,有的是表示
双键。从空间结构来说,每个碳原子连接三条棱,而从化学价键来说,每个碳原子连接四条键。(一个双键也只是一条连线)。如下图。设一个C60分子中含的C-C单键数和C=C双键数分别为a、b,则根据棱边守恒有:a+b=90
④
再利用键线守恒列一个方程式。每个原子连接四条键线而每条键线被两个原子所共有,所以,每个原子单独占有的键线数为4/2=2,所以,60个碳原子共有键线120条:a+2b=120
⑤
联立④⑤解得:a=60,b=30。即C60中含的双键数为30。
(3)设C70分子结构中的五边形和六边形的个数分别为m、n,设C-C单键数和C=C双键数分别为p、q,则:一个C70分子中的棱边总数为70×1.5=105;依据欧拉定理有:70+m+n-105=2
⑥;
依据顶点数守恒有:5/3m+2n=70
⑦;联立⑥⑦得:m=12,n=25。
根据棱边守恒又写出:p+q=105
⑧;
根据键线守恒有:p+2q=70×2=140
⑨;联立⑧⑨得:p=70,q=35。即C70中含的双键数为35。
物质结构与性质
选修3
学段学科——高中
分子晶体的物理特性:
(1)熔、沸点较低,易升华。
(2)较小的硬度(多数分子晶体在常温时为气态或液态)
(3)一般都是绝缘体,固态或熔融状态不导电。
(4)溶解性与溶质、溶剂的分子的极性相关。
【思考与交流】
CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。
碳元素和硅元素处于元素周期表中同一主族,为什么CO2晶体的熔、沸点很低,而SiO2晶体的熔沸点很高?
原子晶体的概念
我们已经知道CO2是分子晶体,而C和Si都是第四主族元素,它们的原子结构和单质的性质很相似,为什么SiO2不是分子晶体呢?
CO2
和SiO2的结构不相同。
二氧化硅的晶体结构
二氧化碳的晶体结构
微粒之间的作用:
气化或熔化时破坏的作用力:
SiO2只有共价键,CO2分子内为共价键,分子间为范德华力。
SiO2气化或熔化时破坏共价键,CO2气化或熔化时破坏范德华力。
原子晶体
分子晶体
原子晶体(共价晶体)
1.概念:
相邻原子间以共价键相结合而形成空间立体网状结构的晶体.
构成原子晶体的粒子是原子,原子间以较强的共价键相结合。
金刚石
常见原子晶体
(1)某些非金属单质:硼(B)、硅(Si)、锗(Ge)、金刚石(C)等
(2)某些非金属化合物:SiC、BN等
(3)某些氧化物:SiO2、
等
109?28?
共价键
硅晶体结构示意图
作为晶体管材料
180?
109?28?
Si
O
共价键
二氧化硅晶体结构示意图
〖思考〗以金刚石为例,说明原子晶体的微观结构与分子晶体有哪些不同?
组成微粒不同,原子晶体中只存在原子,没有分子
粒子间相互作用不同,原子晶体中存在的是共价键
原子晶体的结构特点
1、原子晶体中构成晶体的粒子是原子,离子晶体中构成晶体的粒子是离子,分子晶体中构成晶体的粒子是分子。
2、原子晶体中不存在单个分子。
3、原子晶体中所有原子间均具有较强的共价键,而且形成空间网状结构,所有原子的相对位置比较固定。
在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体的:
(1)熔点和沸点高
(2)硬度大
(3)一般不导电
(4)且难溶于一些常见的溶剂
(5)原子晶体一般密度较大,难压缩、难挥发;
2.原子晶体的物理特性
原子晶体具备以上物理性质的原因:_
_____________________
原子晶体的化学式是否可以代表其分子式____________
原因_
__________________
原子晶体中存在较强的共价键不易被破坏。
否
原子晶体是一个三维的网状结构,无小分子存在。
【拓展提高】
1.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
(1)氮化硅晶体属于_________晶体。
(2)已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式_______.
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的氮化硅。反应的化学方程式为_______________________.
原子
Si3N4
3SiCl4+2N2+6H2=Si3N4+12HCl
物质结构与性质
选修3
学段学科——高中
对比分子晶体和原子晶体的数据,原子晶体有何物理特性?
原子晶体与分子晶体的比较
分
子
晶
体
原子晶体
构成微粒
分
子
原
子
晶体内相互作用力
分子间作用力
(含极性、氢键)
共价键
硬度、熔沸点
低
高
熔、沸点
变化规律
1、对于组成结构相似的物质,相对分子质量
2、极性分子非极性分子
3、氢键作用
键长
键能
化学式能否表示分子结构
能
不能
〖思考〗为何CO2熔沸点低?而破坏CO2分子却比SiO2更难?
因为CO2是分子晶体,SiO2是原子晶体,所以熔化时CO2是破坏范德华力而熔化SiO2时是破坏共价键。所以SiO2熔沸点高。
破坏CO2分子与SiO2时,都是破坏共价健,而C-O键能>Si-O键能,所以CO2分子更稳定。
归纳:非金属单质是原子晶体还是分子晶体,可从以下角度进行分析判断:
(1)依据组成晶体的粒子和粒子间的作用判断
构成原子晶体的粒子是_________,微粒间的作用是________________________;
构成分子晶体的粒子是_________,微粒间的作用是________________________。
(2)记忆常见的、典型的原子晶体
a、单质:______________________________________
b、化合物:____________________________________
原子
共价键
分子
分子间作用力(某些含有氢键)
金刚石、晶体硅、晶体硼
SiO2、SiC、BN
原子晶体和分子晶体的区分方法
(3)依据晶体的熔点判断
原子晶体熔、沸点高,常在1000℃以上;
分子晶体熔、沸点低,常在数百度以下至很低的温度。
(4)依据导电性判断
分子晶体为非导体,但部分分子晶体溶于水后能导电;
原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断
原子晶体硬度大,分子晶体硬度小且较脆。
在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体的:
(1)熔点和沸点高
(2)硬度大
(3)一般不导电
(4)且难溶于一些常见的溶剂
(5)原子晶体一般密度较大,难压缩、难挥发;
原子晶体的物理特性
原子晶体具备以上物理性质的原因:_
_____________________
原子晶体中存在较强的共价键不易被破坏。
原子晶体的熔沸点普遍比较高,一般在10000c以上。但同样属于原子晶体的金刚石、晶体硅、二氧化硅等的熔沸点又有差异,那么原子晶体熔沸点又怎样进行比较呢?
SiO2的晶体结构
原子晶体结构特点
微粒之间的作用:
气化或熔化时破坏的作用力:
共价键
共价键
金刚石晶体结构
(原子半径越小,键长越短,键能越大,共价键越稳定,晶体熔沸点越高,硬度越大)
原子晶体熔沸点高低的比较方法
三者都是原子晶体,形成晶体的粒子均是原子,粒子间的相互作用为共价键,所以熔点和硬度的大小由共价键的强弱决定,而共价键强弱和键长、键能有关。
结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高。金刚石
>
碳化硅
>
晶体硅
学与问
1、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?
2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?
不对,“具有共价键”并不是判断原子晶体的唯一条件,分子晶体的分子内部也有共价键。对原子晶体的认识除了要求“具有共价键”外,还要求形成晶体的粒子是原子。
例题1、氮化硅是一种新合成的材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的作用力与氮化硅熔化所克服的微粒间的作用力都相同的是
(
)
A、硝石和金刚石
B、晶体硅和水晶
C、冰和干冰
D、萘和蒽
B
例题2.
碳化硅(SiC)具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石②晶体硅③碳化硅中,它们的熔点从高到低的顺序是
(
)
A.
①③②
B.
②③①
C.
③①②
D.
②①③
A
物质结构与性质
选修3
学段学科——高中
晶体结构的计算类型:
晶体结构是近几年来高考考查的重点和热点,特别是晶体结构的计算更是其中的重中之重,它体现了高考考试说明中提出的“将化学问题抽象为数学问题,利用数学工具,通过计算推理解决化学问题的能力”的要求,是高考向“3+X”综合发展的趋势。在高考的第二轮复习中有必要加以归纳整理。晶体结构的计算通常有以下类型:
晶体结构的计算类型:
一.晶体中距离最近的微粒数的计算
二.晶体中结构单元微粒实际数目的计算、离子晶体化学式的确定
三.晶体中化学键数目的计算
四.综合计算
109?28?
共价键
思考:在金刚石晶体中,每个碳与周围多少个碳原子成键?形成怎样的空间结构?最小碳环由多少个碳原子组成?它们是否在同一平面内?
在金刚石晶体中,碳原子个数与C-C键数之比为多少?
①每个C原子以sp3杂化,分别与4个相邻的C原子形成4个σ键,金刚石晶体中所有的C-C键长相等,键角相等(
109°28′);
②每个C原子均可与相邻的4个C构成实心的正四面体,向空间无限延伸得到立体网状的金刚石晶体;
③在金刚石晶体中最小的环是六元环,且6个C原子不在同一平面内;
④晶体中每个C原子参与4条C-C键的形成,在每条键中的贡献一半,故C原子个数与C-C键数之比为1:2
即n(C):n(C-C)=1:2
设晶胞边长为a,则
1号碳的坐标为(a/4,
3a/4,
a/4),
2号碳的坐标为(3a/4,
a/4,
a/4),
3号碳的坐标为(a/4,
a/4,
3a/4),
4号碳的坐标为(3a/4,
3a/4,
3a/4)。
180?
109?28?
Si
o
共价键
①每个Si原子均以sp3杂化,1个Si原子与4个O原子成键,形成4个Si-O键。同时每个O原子与2个Si原子成键;二氧化硅晶体是由Si原子和O原子按1:2比例构成的立体网状晶体;
②晶体中的最小的环是由6个Si原子和6个O原子组成的十二元环,且不在同一平面内;
③1molSiO2中含有1molSi原子,2mol
O原子,4mol
Si-O键。
例题1.单质硼有无定形和晶体两种,参考下表数据
晶体硼的晶体类型属于_______晶体,理由是____________。
原子
熔点高、硬度大
金刚石
晶体硅
晶体硼
熔点
>3823
1683
2573
沸点
5100
2628
2823
硬度
10
7.0
9.5
例题2.如图所示,晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,其中含有20个等边三角形和一定数目的顶点,每个顶点上各有1个原子。观察图形可知,这个基本结构单元由___________个硼原子组成,键与键之间的夹角
是_______,共含有___________B-B键
例题3.在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C—C键间的夹角是
(
)
A.6个120°
B.5个108°
C.4个109°28′
D.6个109°28′
D
4.
2003年美国《科学》杂志报道:在超高压下,科学家用激光器将CO2加热到1800K,成功制得了类似石英的CO2原子晶体。下列关于CO2晶体的叙述中不正确的是(
)
A.
晶体中C、O原子个数比为1∶2
B.
该晶体的熔点、沸点高、硬度大
C.
晶体中C—O—C键角为109°28,
D.
晶体中C、O原子最外层都满足8电子结构
C
物质结构与性质
选修3
学段学科——高中
石墨是一种结晶形碳,有天然出产的矿物。铁黑色至深钢灰色。质软具滑腻感,可沾污手指成灰黑色。化学性质不活泼。具有耐腐蚀性,在空气或氧气中强热可以燃烧生成二氧化碳。
有金属光泽,并可以作电极,因此它具有金属晶体的性质。
晶体呈现六方晶系,成叶片状、鳞片状和致密块状。有很高的熔沸点,可用于制造坩埚,因此它具有原子晶体的性质。
石墨硬度很小,可用作润滑剂、铅笔芯等,密度也较小为:2.25g/cm3,因此它具有原子晶体的性质。
所以说石墨是一种混合型晶体。
知识拓展-石墨
石墨晶体结构
石墨晶体是层状结构,每一层内,C原子排成正六边形(如图所示)
1.层与层之间是范德华力,所以,具有分子晶体的性质,硬度很小。
2.层内是共价键,并且是网状结构,所以又具有原子晶体的性质,熔沸点高。
3.层与层之间还有自由移动的电子,所以也具有金属的性质,能导电。
石墨(混合型晶体、过渡型晶体)
石墨(混合型晶体、过渡型晶体)
1、石墨为什么很软?
2、石墨的熔沸点为什么很高(高于金刚石)?
3、石墨属于哪类晶体?为什么?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,各层碳原子之间存在很强的共价键(大π键),故熔沸点很高。
石墨为混合键型晶体。
石墨晶体结构
关于石墨晶体结构的计算
问题:
(1)平均每个正六边形占有的C原子数为几个?占有的C-C键数有几个?
(2)在每一层内C原子数与C-C键数之比为多少?
解析:
(1)每个正六边形由6个C原子组成,每个C原子同时被3个正六边形共用,因此平均每个正六边形占有的C原子数为6×1/3=2。
(2)每个正六边形由6个C-C键组成,每个C-C键同时被2个正六边形共用,因此平均每个正六边形占有的C-C键为6×1/2=3。
思考:石墨中的碳原子是哪种杂化类型?
在石墨的单元结构中,键角为120o,所以C的杂化类型为SP2杂化,杂化轨道中S成分占1/3。而在金刚石的单元结构中,键角为109.5o,C的杂化类型为SP3杂化,杂化轨道中S成分占1/4。S成分越大,化学键的键长越短,键能就越大,所以石墨比金刚石的熔沸点高,稳定性好。由石墨转化为金刚石为吸热反应。
例题.石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是(
)
A.
10个
B.
18个
C.
24个
D.
14个
D
物质结构与性质
选修3
微粒为分子:分子间作用力(或范德华力)或氢键;
微粒为原子:极性共价键或非极性共价键;
微粒为离子:离子键。
复习总结:
微粒间作用
构成物质的微粒主要有三种:原子、离子和分子,金属单质是由金属阳离子和自由电子构成的,大部分非金属单质和大部分的共价化合物是由分子构成的,金刚石和单质硅是由原子直接构成的,离子化合物是由离子构成的。
观察与思考:
下列三种晶体有什么共同点?
碘晶体结构
干冰晶体结构
冰晶体结构
构成微粒是分子,粒子间的相互作用是分子间作用力或氢键
.
分子晶体
一、概念:分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体。(或者说只含分子的晶体)
注意:
构成粒子:分子(构成分子的原子间以共价键结合)
有单个分子存在,化学式就是分子式。
稀有气体分子为单原子分子,无共价键。
分子晶体粒子间的相互作用
分子晶体中的分子内原子间的相互作用是共价键。
因为共价键具有饱和性,而分子又都是原子通过共价键结合而成的,因此分子与分子之间不会有强烈的相互作用,导致分子晶体中的分子间的相互作用比化学键弱得多,这种相互作用称为分子间作用力,又称范德瓦耳斯力。
分子晶体在气化或熔化时破坏的作用力为:分子间作用力。
二、分子晶体的物理特性:
(1)熔、沸点较低,易升华。
常温下为气态的物质一定是分子晶体;
常温下为液态的物质大部分是分子晶体;
稀有气体是分子晶体,C60是分子晶体。
(2)较小的硬度(多数分子晶体在常温时为气态或液态)
(3)一般都是绝缘体,固态或熔融状态不导电。
(4)溶解性与溶质、溶剂的分子的极性相关——相似相溶,氢键。
原因:分子间作用力很弱
(1)所有非金属氢化物:
H2O,
H2S,
NH3,
CH4,
HX
(2)
部分非金属单质:
X2,
N2,
O2,
H2,
S8,
P4,
C60
(3)
部分非金属氧化物:
CO2,
SO2,
N2O4,
P4O6,
P4O10
(4)
几乎所有的酸:
H2SO4,
HNO3,
H3PO4
(5)
大多数有机物:
乙醇,冰醋酸,蔗糖
三、典型的分子晶体
【巩固练习】
1.下列晶体由原子直接构成,且属于分子晶体的是
(
)
A.固态氢
B.固态氖
C.白磷
D.三氧化硫
2.
共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是
(
)
A.
干冰
B.
氯化钠
C.
氢氧化钠
D.
碘
B
B
【巩固练习】
3.
支持固态氨是分子晶体的事实是
(
)
A.
氮原子不能形成阳离子
B.
铵离子不能单独存在
C.
常温下,氨是气态物质
D.
氨极易溶于水
C
物质结构与性质
选修3
学段学科——高中
四、分子晶体熔、沸点高低的比较规律
分子晶体要熔化或汽化都需要克服分子间的作用力。分子间作用力越大,物质熔化和汽化时需要的能量就越多,物质的熔、沸点就越高。
因此,比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范力和氢键)的大小。
范德瓦耳斯力对晶体的熔沸点的影响
观察上面的图表,你能得出分子晶体的熔沸点具有何种变化规律吗?你能解释形成此规律的原因吗?
比较下列物质熔沸点的高低
1、CH3CH2CH2CH3
CH3CH2CH2CH2CH3
2、ClCH2CHClCCl3
ClCH2CHClCH2CHClCCl3
3、O2
S
Se
Te
Po
一般来说,结构和组成相似的物质,相对分子量越大,分子间作用力越大,物质的熔沸点越高。但也有一些反常情况,例如:H2O、H2S、H2Se、H2Te
等的结构和组成相似,但相对分子量小的H2O熔沸点却比H2S、H2Se、H2Te的熔沸点高,除此之外,还有一些物质也有这种情况出现,请大家观察下表。
问题:这是由于什么原因造成的呢?
(1)组成和结构相似的物质,
___________________________________
烷烃、烯烃、炔烃、饱和一元醇、醛、羧酸等同系物的沸点均随着碳原子数的增加而升高。
分子间有氢键的物质(HF、H2O、NH3等)熔、沸点反常增大。
形成分子内氢键的物质,其熔、沸点低于形成分子间氢键的物质。(如邻羟基苯甲醛的熔沸点低于对羟基苯甲醛的熔沸点)
分子量越大,熔沸点越高。
(2)在烷烃的同分异构体中,一般来说,支链数越多,______________。如沸点:正戊烷
>
异戊烷
>
新戊烷;芳香烃及其衍生物苯环上的同分异构体一般按照“____________________”的顺序。
注意:分子的稳定性则决定于共价键的强弱.
熔沸点越低
邻位
>
间位
>
对位
物质结构与性质
选修3
学段学科——高中
五、分子晶体的结构特征和结构模型
(1)只有范德华力,无分子间氢键-分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰
、I2、O2)
(2)有分子间氢键-不具有分子密堆积特征(如:HF
、冰、NH3
)
分子的密堆积
(与CO2分子距离最近的CO2分子共有12个
)
干冰的晶体结构图
分子的密堆积
(与每个分子距离最近的相同分子共有12个
)
氧(O2)的晶体结构
碳60的晶胞
冰中1个水分子周围有4个水分子
冰的结构
氢键具有方向性
分子的非密堆积
冰中1个水分子周围有4个水分子形成什么空间构型?
笼状化合物
〖思考〗为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。
由于分子间作用力特别是氢键的方向性,导致晶体冰中有相当大的空隙,所以相同状况下体积较大
由于CO2分子的相对分子质量>H2O,所以干冰的密度大。
〖归纳要点〗分子的密度取决于晶体的体积,取决于紧密堆积程度,分子晶体的紧密堆积由以下两个因素决定:
(1)范德华力
(2)分子间氢键
物质结构与性质
选修3
学段学科——高中
晶体结构的计算类型:
晶体结构是近几年来高考考查的重点和热点,特别是晶体结构的计算更是其中的重中之重,它体现了高考考试说明中提出的“将化学问题抽象为数学问题,利用数学工具,通过计算推理解决化学问题的能力”的要求。
晶体结构的计算通常有以下类型:
晶体结构的计算类型:
一.晶体中距离最近的微粒数的计算
二.晶体中结构单元微粒实际数目的计算、各种晶体化学式的确定
三.晶体中化学键数目的计算
四.综合计算
分子晶体中距离最近的微粒数的计算
例1:二氧化碳晶体中,与二氧化碳分子距离最近的二氧化碳分子有
个
解析:在图1
的二氧化碳分子晶体结构中,8个二氧化碳分子处于正方体的8个顶点上,还有6个处于正方体的六个面的面心上。此时可选定面心的二氧化碳分子为基准,设正方体的边长为a,则二氧化碳分子间的最近距离为
,从图中看有8个,它们分别位于该侧
面的四个顶点及与之相连的四个面的面心上。
例2:(改自97高考)1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体,如下图,该结构的建立基于以下考虑:C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;碳与碳之间既有单键又有双键,每个碳原子仍然满足四个价键饱和;多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2。
请回答:
(1)一个C60分子中有多少个五边形和多少个六边形?
(2)一个C60分子中有多少个C=C?
(3)已知C70分子的结构模型也遵循C60的那些规律,请确定C70分子结构中上述几项参数。
晶体中化学键数目的计算
解析:(1)设C60分子中含有x个五边形和y个六边形。先求欧拉定理中棱边数:每个顶点伸出三条棱,而每条棱又总是由两个顶点共有,所以,每个顶点单独伸出的棱有3×1/2=1.5条,60个顶点共伸出的棱为60×1.5=90条。至此,依据欧拉定理可写出:60+x+y-90=2
①
为了求出x和y,还要建立一个方程式。因为五边形和六边形构成多面体时是共用棱边和顶点的,所以,还可以根据棱边数守恒和顶点数守恒写出两个方程式。
棱边数守恒:
每条棱是由两个多面体共用的,所以,一个五边形单独占有的棱边数为5/2=2.5条,一个六边形单独占有的棱边数为6/2=3条,所以,2.5x+3y=90
②
至此联立①②可以解得:x=12,y=20。
顶点数守恒:
每个顶点是由三个多面体共有,所以,一个五边形单独占有的顶点数为5/3个,一个六边形单独占有的顶点数为6/3=2个,所以,5/3x+2y=60
③,联立①③也可以解出x、y,但只联立②③不可以解出。
(2)首先要明确一个概念:在图中顶点间形成的棱都以单线标出,但有的是表示单键,有的是表示
双键。从空间结构来说,每个碳原子连接三条棱,而从化学价键来说,每个碳原子连接四条键。(一个双键也只是一条连线)。如下图。设一个C60分子中含的C-C单键数和C=C双键数分别为a、b,则根据棱边守恒有:a+b=90
④
再利用键线守恒列一个方程式。每个原子连接四条键线而每条键线被两个原子所共有,所以,每个原子单独占有的键线数为4/2=2,所以,60个碳原子共有键线120条:a+2b=120
⑤
联立④⑤解得:a=60,b=30。即C60中含的双键数为30。
(3)设C70分子结构中的五边形和六边形的个数分别为m、n,设C-C单键数和C=C双键数分别为p、q,则:一个C70分子中的棱边总数为70×1.5=105;依据欧拉定理有:70+m+n-105=2
⑥;
依据顶点数守恒有:5/3m+2n=70
⑦;联立⑥⑦得:m=12,n=25。
根据棱边守恒又写出:p+q=105
⑧;
根据键线守恒有:p+2q=70×2=140
⑨;联立⑧⑨得:p=70,q=35。即C70中含的双键数为35。
物质结构与性质
选修3
学段学科——高中
分子晶体的物理特性:
(1)熔、沸点较低,易升华。
(2)较小的硬度(多数分子晶体在常温时为气态或液态)
(3)一般都是绝缘体,固态或熔融状态不导电。
(4)溶解性与溶质、溶剂的分子的极性相关。
【思考与交流】
CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。
碳元素和硅元素处于元素周期表中同一主族,为什么CO2晶体的熔、沸点很低,而SiO2晶体的熔沸点很高?
原子晶体的概念
我们已经知道CO2是分子晶体,而C和Si都是第四主族元素,它们的原子结构和单质的性质很相似,为什么SiO2不是分子晶体呢?
CO2
和SiO2的结构不相同。
二氧化硅的晶体结构
二氧化碳的晶体结构
微粒之间的作用:
气化或熔化时破坏的作用力:
SiO2只有共价键,CO2分子内为共价键,分子间为范德华力。
SiO2气化或熔化时破坏共价键,CO2气化或熔化时破坏范德华力。
原子晶体
分子晶体
原子晶体(共价晶体)
1.概念:
相邻原子间以共价键相结合而形成空间立体网状结构的晶体.
构成原子晶体的粒子是原子,原子间以较强的共价键相结合。
金刚石
常见原子晶体
(1)某些非金属单质:硼(B)、硅(Si)、锗(Ge)、金刚石(C)等
(2)某些非金属化合物:SiC、BN等
(3)某些氧化物:SiO2、
等
109?28?
共价键
硅晶体结构示意图
作为晶体管材料
180?
109?28?
Si
O
共价键
二氧化硅晶体结构示意图
〖思考〗以金刚石为例,说明原子晶体的微观结构与分子晶体有哪些不同?
组成微粒不同,原子晶体中只存在原子,没有分子
粒子间相互作用不同,原子晶体中存在的是共价键
原子晶体的结构特点
1、原子晶体中构成晶体的粒子是原子,离子晶体中构成晶体的粒子是离子,分子晶体中构成晶体的粒子是分子。
2、原子晶体中不存在单个分子。
3、原子晶体中所有原子间均具有较强的共价键,而且形成空间网状结构,所有原子的相对位置比较固定。
在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体的:
(1)熔点和沸点高
(2)硬度大
(3)一般不导电
(4)且难溶于一些常见的溶剂
(5)原子晶体一般密度较大,难压缩、难挥发;
2.原子晶体的物理特性
原子晶体具备以上物理性质的原因:_
_____________________
原子晶体的化学式是否可以代表其分子式____________
原因_
__________________
原子晶体中存在较强的共价键不易被破坏。
否
原子晶体是一个三维的网状结构,无小分子存在。
【拓展提高】
1.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
(1)氮化硅晶体属于_________晶体。
(2)已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式_______.
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的氮化硅。反应的化学方程式为_______________________.
原子
Si3N4
3SiCl4+2N2+6H2=Si3N4+12HCl
物质结构与性质
选修3
学段学科——高中
对比分子晶体和原子晶体的数据,原子晶体有何物理特性?
原子晶体与分子晶体的比较
分
子
晶
体
原子晶体
构成微粒
分
子
原
子
晶体内相互作用力
分子间作用力
(含极性、氢键)
共价键
硬度、熔沸点
低
高
熔、沸点
变化规律
1、对于组成结构相似的物质,相对分子质量
2、极性分子非极性分子
3、氢键作用
键长
键能
化学式能否表示分子结构
能
不能
〖思考〗为何CO2熔沸点低?而破坏CO2分子却比SiO2更难?
因为CO2是分子晶体,SiO2是原子晶体,所以熔化时CO2是破坏范德华力而熔化SiO2时是破坏共价键。所以SiO2熔沸点高。
破坏CO2分子与SiO2时,都是破坏共价健,而C-O键能>Si-O键能,所以CO2分子更稳定。
归纳:非金属单质是原子晶体还是分子晶体,可从以下角度进行分析判断:
(1)依据组成晶体的粒子和粒子间的作用判断
构成原子晶体的粒子是_________,微粒间的作用是________________________;
构成分子晶体的粒子是_________,微粒间的作用是________________________。
(2)记忆常见的、典型的原子晶体
a、单质:______________________________________
b、化合物:____________________________________
原子
共价键
分子
分子间作用力(某些含有氢键)
金刚石、晶体硅、晶体硼
SiO2、SiC、BN
原子晶体和分子晶体的区分方法
(3)依据晶体的熔点判断
原子晶体熔、沸点高,常在1000℃以上;
分子晶体熔、沸点低,常在数百度以下至很低的温度。
(4)依据导电性判断
分子晶体为非导体,但部分分子晶体溶于水后能导电;
原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断
原子晶体硬度大,分子晶体硬度小且较脆。
在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体的:
(1)熔点和沸点高
(2)硬度大
(3)一般不导电
(4)且难溶于一些常见的溶剂
(5)原子晶体一般密度较大,难压缩、难挥发;
原子晶体的物理特性
原子晶体具备以上物理性质的原因:_
_____________________
原子晶体中存在较强的共价键不易被破坏。
原子晶体的熔沸点普遍比较高,一般在10000c以上。但同样属于原子晶体的金刚石、晶体硅、二氧化硅等的熔沸点又有差异,那么原子晶体熔沸点又怎样进行比较呢?
SiO2的晶体结构
原子晶体结构特点
微粒之间的作用:
气化或熔化时破坏的作用力:
共价键
共价键
金刚石晶体结构
(原子半径越小,键长越短,键能越大,共价键越稳定,晶体熔沸点越高,硬度越大)
原子晶体熔沸点高低的比较方法
三者都是原子晶体,形成晶体的粒子均是原子,粒子间的相互作用为共价键,所以熔点和硬度的大小由共价键的强弱决定,而共价键强弱和键长、键能有关。
结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高。金刚石
>
碳化硅
>
晶体硅
学与问
1、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?
2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?
不对,“具有共价键”并不是判断原子晶体的唯一条件,分子晶体的分子内部也有共价键。对原子晶体的认识除了要求“具有共价键”外,还要求形成晶体的粒子是原子。
例题1、氮化硅是一种新合成的材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的作用力与氮化硅熔化所克服的微粒间的作用力都相同的是
(
)
A、硝石和金刚石
B、晶体硅和水晶
C、冰和干冰
D、萘和蒽
B
例题2.
碳化硅(SiC)具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石②晶体硅③碳化硅中,它们的熔点从高到低的顺序是
(
)
A.
①③②
B.
②③①
C.
③①②
D.
②①③
A
物质结构与性质
选修3
学段学科——高中
晶体结构的计算类型:
晶体结构是近几年来高考考查的重点和热点,特别是晶体结构的计算更是其中的重中之重,它体现了高考考试说明中提出的“将化学问题抽象为数学问题,利用数学工具,通过计算推理解决化学问题的能力”的要求,是高考向“3+X”综合发展的趋势。在高考的第二轮复习中有必要加以归纳整理。晶体结构的计算通常有以下类型:
晶体结构的计算类型:
一.晶体中距离最近的微粒数的计算
二.晶体中结构单元微粒实际数目的计算、离子晶体化学式的确定
三.晶体中化学键数目的计算
四.综合计算
109?28?
共价键
思考:在金刚石晶体中,每个碳与周围多少个碳原子成键?形成怎样的空间结构?最小碳环由多少个碳原子组成?它们是否在同一平面内?
在金刚石晶体中,碳原子个数与C-C键数之比为多少?
①每个C原子以sp3杂化,分别与4个相邻的C原子形成4个σ键,金刚石晶体中所有的C-C键长相等,键角相等(
109°28′);
②每个C原子均可与相邻的4个C构成实心的正四面体,向空间无限延伸得到立体网状的金刚石晶体;
③在金刚石晶体中最小的环是六元环,且6个C原子不在同一平面内;
④晶体中每个C原子参与4条C-C键的形成,在每条键中的贡献一半,故C原子个数与C-C键数之比为1:2
即n(C):n(C-C)=1:2
设晶胞边长为a,则
1号碳的坐标为(a/4,
3a/4,
a/4),
2号碳的坐标为(3a/4,
a/4,
a/4),
3号碳的坐标为(a/4,
a/4,
3a/4),
4号碳的坐标为(3a/4,
3a/4,
3a/4)。
180?
109?28?
Si
o
共价键
①每个Si原子均以sp3杂化,1个Si原子与4个O原子成键,形成4个Si-O键。同时每个O原子与2个Si原子成键;二氧化硅晶体是由Si原子和O原子按1:2比例构成的立体网状晶体;
②晶体中的最小的环是由6个Si原子和6个O原子组成的十二元环,且不在同一平面内;
③1molSiO2中含有1molSi原子,2mol
O原子,4mol
Si-O键。
例题1.单质硼有无定形和晶体两种,参考下表数据
晶体硼的晶体类型属于_______晶体,理由是____________。
原子
熔点高、硬度大
金刚石
晶体硅
晶体硼
熔点
>3823
1683
2573
沸点
5100
2628
2823
硬度
10
7.0
9.5
例题2.如图所示,晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,其中含有20个等边三角形和一定数目的顶点,每个顶点上各有1个原子。观察图形可知,这个基本结构单元由___________个硼原子组成,键与键之间的夹角
是_______,共含有___________B-B键
例题3.在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C—C键间的夹角是
(
)
A.6个120°
B.5个108°
C.4个109°28′
D.6个109°28′
D
4.
2003年美国《科学》杂志报道:在超高压下,科学家用激光器将CO2加热到1800K,成功制得了类似石英的CO2原子晶体。下列关于CO2晶体的叙述中不正确的是(
)
A.
晶体中C、O原子个数比为1∶2
B.
该晶体的熔点、沸点高、硬度大
C.
晶体中C—O—C键角为109°28,
D.
晶体中C、O原子最外层都满足8电子结构
C
物质结构与性质
选修3
学段学科——高中
石墨是一种结晶形碳,有天然出产的矿物。铁黑色至深钢灰色。质软具滑腻感,可沾污手指成灰黑色。化学性质不活泼。具有耐腐蚀性,在空气或氧气中强热可以燃烧生成二氧化碳。
有金属光泽,并可以作电极,因此它具有金属晶体的性质。
晶体呈现六方晶系,成叶片状、鳞片状和致密块状。有很高的熔沸点,可用于制造坩埚,因此它具有原子晶体的性质。
石墨硬度很小,可用作润滑剂、铅笔芯等,密度也较小为:2.25g/cm3,因此它具有原子晶体的性质。
所以说石墨是一种混合型晶体。
知识拓展-石墨
石墨晶体结构
石墨晶体是层状结构,每一层内,C原子排成正六边形(如图所示)
1.层与层之间是范德华力,所以,具有分子晶体的性质,硬度很小。
2.层内是共价键,并且是网状结构,所以又具有原子晶体的性质,熔沸点高。
3.层与层之间还有自由移动的电子,所以也具有金属的性质,能导电。
石墨(混合型晶体、过渡型晶体)
石墨(混合型晶体、过渡型晶体)
1、石墨为什么很软?
2、石墨的熔沸点为什么很高(高于金刚石)?
3、石墨属于哪类晶体?为什么?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,各层碳原子之间存在很强的共价键(大π键),故熔沸点很高。
石墨为混合键型晶体。
石墨晶体结构
关于石墨晶体结构的计算
问题:
(1)平均每个正六边形占有的C原子数为几个?占有的C-C键数有几个?
(2)在每一层内C原子数与C-C键数之比为多少?
解析:
(1)每个正六边形由6个C原子组成,每个C原子同时被3个正六边形共用,因此平均每个正六边形占有的C原子数为6×1/3=2。
(2)每个正六边形由6个C-C键组成,每个C-C键同时被2个正六边形共用,因此平均每个正六边形占有的C-C键为6×1/2=3。
思考:石墨中的碳原子是哪种杂化类型?
在石墨的单元结构中,键角为120o,所以C的杂化类型为SP2杂化,杂化轨道中S成分占1/3。而在金刚石的单元结构中,键角为109.5o,C的杂化类型为SP3杂化,杂化轨道中S成分占1/4。S成分越大,化学键的键长越短,键能就越大,所以石墨比金刚石的熔沸点高,稳定性好。由石墨转化为金刚石为吸热反应。
例题.石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是(
)
A.
10个
B.
18个
C.
24个
D.
14个
D
