人教版高二化学选修4第四章第3节 电解池(共19张PPT)
文档属性
| 名称 | 人教版高二化学选修4第四章第3节 电解池(共19张PPT) | 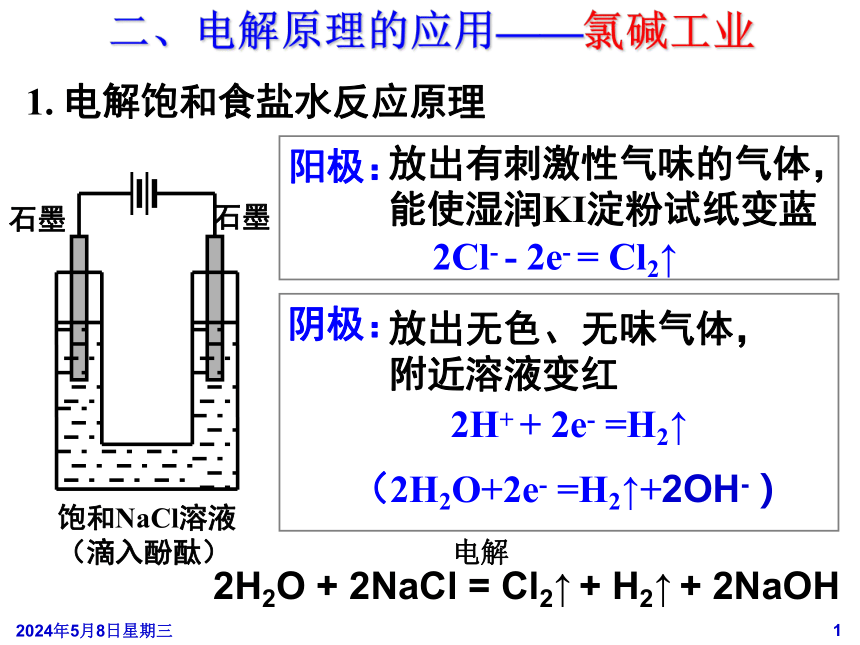 | |
| 格式 | zip | ||
| 文件大小 | 493.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-22 21:57:19 | ||
图片预览




文档简介
(共19张PPT)
阳极:
放出有刺激性气味的气体,
能使湿润KI淀粉试纸变蓝
放出无色、无味气体,
附近溶液变红
2Cl-
-
2e-
=
Cl2↑
(2H2O+2e-
=H2↑+2OH-)
石墨
饱和NaCl溶液
(滴入酚酞)
1.
电解饱和食盐水反应原理
二、电解原理的应用——氯碱工业
阴极:
石墨
2H2O
+
2NaCl
=
Cl2↑
+
H2↑
+
2NaOH
电解
13
六月
2020
1
2H+
+
2e-
=H2↑
Na+
+
精制
饱和NaCl
水
(含少量NaOH)
Cl2
NaOH
溶液
淡盐水
阳极:金属钛网
(涂有钛钌等氧化物)
阴极碳钢网
(涂有镍涂层)
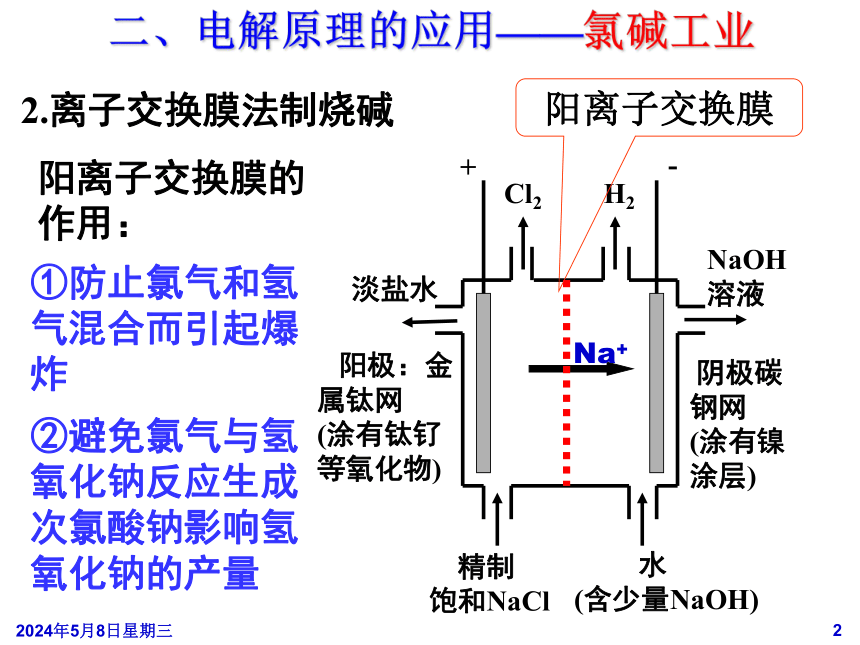
二、电解原理的应用——氯碱工业
2.离子交换膜法制烧碱
-
H2
阳离子交换膜
阳离子交换膜的作用:
①防止氯气和氢气混合而引起爆炸
②避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠的产量
13
六月
2020
2
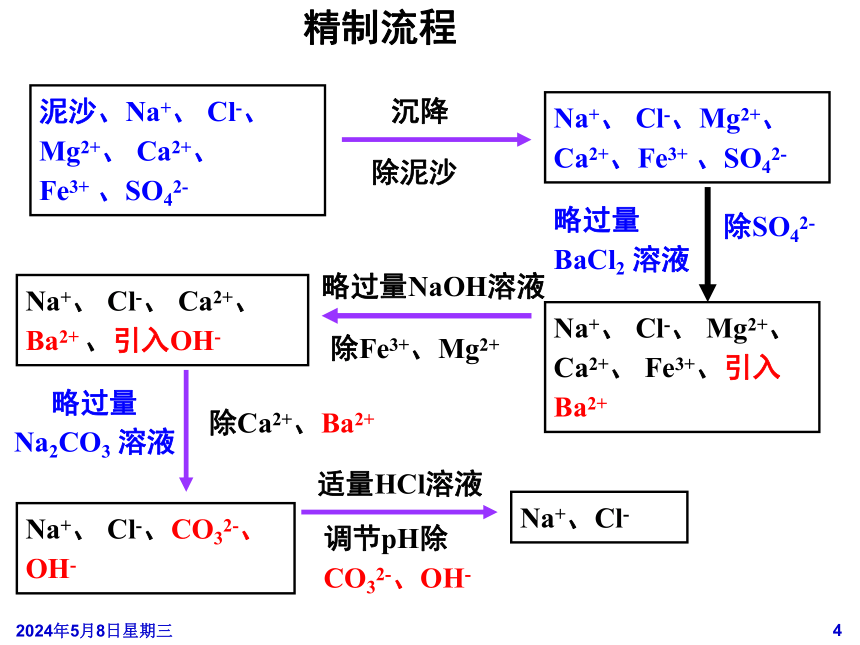
3、食盐水的精制
由于粗盐中含有泥沙、Ca2+
、Mg2+、
Fe3+、
SO42-等杂质,会在碱液中形成沉淀从而损坏离子交换膜,那么如何除去这些杂质呢?
3.
所有试剂只有过量才能除尽,你能设计一个合理的顺序逐一除杂吗?
2.
用什么试剂除去Ca2+
、Mg2+、
Fe3+
、SO42—
1.
用什么方法除去泥沙?
思考:
13
六月
2020
3
泥沙、Na+、
Cl-、
Mg2+、
Ca2+、
Fe3+
、SO42-
Na+、
Cl-、Mg2+、
Ca2+、Fe3+
、SO42-
Na+、
Cl-、
Mg2+、
Ca2+、
Fe3+、引入Ba2+
Na+、
Cl-、
Ca2+、
Ba2+
、引入OH-
Na+、
Cl-、CO32-、
OH-
Na+、Cl-
沉降
除泥沙
略过量BaCl2
溶液
除SO42-
略过量Na2CO3
溶液
除Ca2+、Ba2+
略过量NaOH溶液
除Fe3+、Mg2+
适量HCl溶液
调节pH除CO32-、OH-
精制流程
13
六月
2020
4
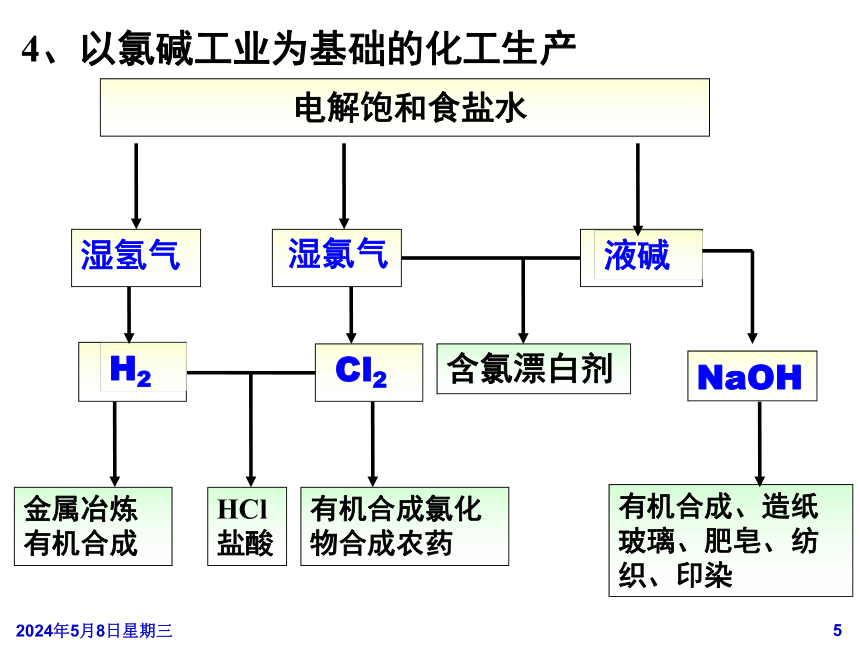
含氯漂白剂
有机合成、造纸
玻璃、肥皂、纺织、印染
有机合成氯化
物合成农药
金属冶炼
有机合成
HCl
盐酸
电解饱和食盐水
H2
NaOH
湿氯气
湿氢气
液碱
Cl2
4、以氯碱工业为基础的化工生产
13
六月
2020
5
13
六月
2020
13
六月
2020
⑴概念:
应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
⑵目的:
使金属增强抗腐蚀能力,增加美观和表面硬度
⑶电镀池形成条件
思考:在铁制品表面上镀铜,应如何选择阴、阳极材料和电解质溶液?
镀层金属通常是一些在空气或溶液里不易起变化的金属或合金。
二、电解原理的应用——电镀
2、电镀
13
六月
2020
8
“一多(阴极)、一少(阳极)、一不变(电镀液的组成及酸碱性保持不变)”
铁制品
纯Cu
+
-
含Cu2+的溶液
①镀件作阴极
②镀层金属作阳极
③含镀层金属阳离子的盐溶液作电镀液
Cu
-
2e-
=
Cu2+
Cu2+
+
2e-
=
Cu
⑷电镀的特点:
⑶电镀池形成条件
13
六月
2020
9
①粗铜的精炼
以粗铜为阳极,以纯铜
为阴极,
以CuSO4溶液
为电解液进行电解。
②电解后CuSO4浓度的变化
CuSO4浓度减小
阳极:
Zn
-2e-=Zn2+
Fe-2e-=Fe2+
Ni
-2e-=Ni2+
Cu-2e-=Cu2+
阴极:
Cu2+
+2e-=Cu
CuSO4溶液
二、电解原理的应用
(3)电解精炼铜
13
六月
2020
10
粗铜
Cu
Zn
Fe
Ni
Ag
Au
纯铜
Cu
二、电解原理的应用——电解精炼铜
13
六月
2020
11
钠的冶炼
二、电解原理的应用——电冶金
电解是最强有力的氧化还原手段,用于
冶炼Na、Ca、Mg、Al这样活泼的金属
通电
2Cl--2e-=Cl2↑
2NaCl(熔融)===2Na+Cl2↑
2Na++2e-=2Na
13
六月
2020
12
阳极:
阴极:
总反应:
(熔融NaCl作电解质)
铝的冶炼
二、电解原理的应用——电冶金
C
Fe
通电
阴极:
4Al
3+
+
12
e-
=4Al
阳极:
6O
2-
-12e
-
=3O2↑
总反应:
2Al2O3(熔融)===4Al+3O2↑
13
六月
2020
13
熔融Al2O3
(熔融Al2O3作电解质)
13
六月
2020
小结:电解原理的应用
1、氯碱工业原理
+
-
H2O含少量NaOH
NaOH溶液
淡盐水
精制饱和NaCl
Cl2
H2
Cl-
H+
Na+
OH-
Na+交换膜
+
_
13
六月
2020
①电极:
阳极——镀层金属
阴极——待镀金属制品
硫酸铜溶液
②电镀液:含有镀层金属离子的电解质溶液。
③电解质溶液:溶液中CuSO4的浓度保持不变。
2、电镀
待镀制品
铜片
电解后CuSO4浓度的变化
CuSO4浓度减小
阳极:
Zn
-2e-=Zn2+
Fe-2e-=Fe2+
Ni
-2e-=Ni2+
Cu-2e-=Cu2+
阴极:
Cu2+
+2e-=Cu
CuSO4溶液
3、电解精炼铜
13
六月
2020
16
粗铜
Cu
Zn
Fe
Ni
Ag
Au
纯铜
Cu
钠的冶炼
电解是最强有力的氧化还原手段,用于
冶炼Na、Ca、Mg、Al这样活泼的金属
通电
2Cl--2e-=Cl2↑
2NaCl(熔融)===2Na+Cl2↑
2Na++2e-=2Na
13
六月
2020
17
阳极:
阴极:
总反应:
4、电冶金
(熔融NaCl作电解质)
铝的冶炼
C
Fe
通电
阴极:
4Al
3+
+
12
e-
=4Al
阳极:
6O
2-
-12e
-
=3O2↑
总反应:
2Al2O3(熔融)===4Al+3O2↑
13
六月
2020
18
熔融Al2O3
(熔融Al2O3作电解质)
精制饱和
NaCl
水(含少
量NaOH)
-
Na+
+
Cl2
溶液A
淡盐水
H2
阳离子交换膜
(1)溶液A的溶质是
;
(2)电解饱和食盐水的离子方程式是
;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用________;
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
NaOH
2Cl-+2H2O====2OH-+H2↑+Cl2↑
电解
氯气与水反应:Cl2+H2O
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
13
六月
2020
19
阳极:
放出有刺激性气味的气体,
能使湿润KI淀粉试纸变蓝
放出无色、无味气体,
附近溶液变红
2Cl-
-
2e-
=
Cl2↑
(2H2O+2e-
=H2↑+2OH-)
石墨
饱和NaCl溶液
(滴入酚酞)
1.
电解饱和食盐水反应原理
二、电解原理的应用——氯碱工业
阴极:
石墨
2H2O
+
2NaCl
=
Cl2↑
+
H2↑
+
2NaOH
电解
13
六月
2020
1
2H+
+
2e-
=H2↑
Na+
+
精制
饱和NaCl
水
(含少量NaOH)
Cl2
NaOH
溶液
淡盐水
阳极:金属钛网
(涂有钛钌等氧化物)
阴极碳钢网
(涂有镍涂层)
二、电解原理的应用——氯碱工业
2.离子交换膜法制烧碱
-
H2
阳离子交换膜
阳离子交换膜的作用:
①防止氯气和氢气混合而引起爆炸
②避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠的产量
13
六月
2020
2
3、食盐水的精制
由于粗盐中含有泥沙、Ca2+
、Mg2+、
Fe3+、
SO42-等杂质,会在碱液中形成沉淀从而损坏离子交换膜,那么如何除去这些杂质呢?
3.
所有试剂只有过量才能除尽,你能设计一个合理的顺序逐一除杂吗?
2.
用什么试剂除去Ca2+
、Mg2+、
Fe3+
、SO42—
1.
用什么方法除去泥沙?
思考:
13
六月
2020
3
泥沙、Na+、
Cl-、
Mg2+、
Ca2+、
Fe3+
、SO42-
Na+、
Cl-、Mg2+、
Ca2+、Fe3+
、SO42-
Na+、
Cl-、
Mg2+、
Ca2+、
Fe3+、引入Ba2+
Na+、
Cl-、
Ca2+、
Ba2+
、引入OH-
Na+、
Cl-、CO32-、
OH-
Na+、Cl-
沉降
除泥沙
略过量BaCl2
溶液
除SO42-
略过量Na2CO3
溶液
除Ca2+、Ba2+
略过量NaOH溶液
除Fe3+、Mg2+
适量HCl溶液
调节pH除CO32-、OH-
精制流程
13
六月
2020
4
含氯漂白剂
有机合成、造纸
玻璃、肥皂、纺织、印染
有机合成氯化
物合成农药
金属冶炼
有机合成
HCl
盐酸
电解饱和食盐水
H2
NaOH
湿氯气
湿氢气
液碱
Cl2
4、以氯碱工业为基础的化工生产
13
六月
2020
5
13
六月
2020
13
六月
2020
⑴概念:
应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
⑵目的:
使金属增强抗腐蚀能力,增加美观和表面硬度
⑶电镀池形成条件
思考:在铁制品表面上镀铜,应如何选择阴、阳极材料和电解质溶液?
镀层金属通常是一些在空气或溶液里不易起变化的金属或合金。
二、电解原理的应用——电镀
2、电镀
13
六月
2020
8
“一多(阴极)、一少(阳极)、一不变(电镀液的组成及酸碱性保持不变)”
铁制品
纯Cu
+
-
含Cu2+的溶液
①镀件作阴极
②镀层金属作阳极
③含镀层金属阳离子的盐溶液作电镀液
Cu
-
2e-
=
Cu2+
Cu2+
+
2e-
=
Cu
⑷电镀的特点:
⑶电镀池形成条件
13
六月
2020
9
①粗铜的精炼
以粗铜为阳极,以纯铜
为阴极,
以CuSO4溶液
为电解液进行电解。
②电解后CuSO4浓度的变化
CuSO4浓度减小
阳极:
Zn
-2e-=Zn2+
Fe-2e-=Fe2+
Ni
-2e-=Ni2+
Cu-2e-=Cu2+
阴极:
Cu2+
+2e-=Cu
CuSO4溶液
二、电解原理的应用
(3)电解精炼铜
13
六月
2020
10
粗铜
Cu
Zn
Fe
Ni
Ag
Au
纯铜
Cu
二、电解原理的应用——电解精炼铜
13
六月
2020
11
钠的冶炼
二、电解原理的应用——电冶金
电解是最强有力的氧化还原手段,用于
冶炼Na、Ca、Mg、Al这样活泼的金属
通电
2Cl--2e-=Cl2↑
2NaCl(熔融)===2Na+Cl2↑
2Na++2e-=2Na
13
六月
2020
12
阳极:
阴极:
总反应:
(熔融NaCl作电解质)
铝的冶炼
二、电解原理的应用——电冶金
C
Fe
通电
阴极:
4Al
3+
+
12
e-
=4Al
阳极:
6O
2-
-12e
-
=3O2↑
总反应:
2Al2O3(熔融)===4Al+3O2↑
13
六月
2020
13
熔融Al2O3
(熔融Al2O3作电解质)
13
六月
2020
小结:电解原理的应用
1、氯碱工业原理
+
-
H2O含少量NaOH
NaOH溶液
淡盐水
精制饱和NaCl
Cl2
H2
Cl-
H+
Na+
OH-
Na+交换膜
+
_
13
六月
2020
①电极:
阳极——镀层金属
阴极——待镀金属制品
硫酸铜溶液
②电镀液:含有镀层金属离子的电解质溶液。
③电解质溶液:溶液中CuSO4的浓度保持不变。
2、电镀
待镀制品
铜片
电解后CuSO4浓度的变化
CuSO4浓度减小
阳极:
Zn
-2e-=Zn2+
Fe-2e-=Fe2+
Ni
-2e-=Ni2+
Cu-2e-=Cu2+
阴极:
Cu2+
+2e-=Cu
CuSO4溶液
3、电解精炼铜
13
六月
2020
16
粗铜
Cu
Zn
Fe
Ni
Ag
Au
纯铜
Cu
钠的冶炼
电解是最强有力的氧化还原手段,用于
冶炼Na、Ca、Mg、Al这样活泼的金属
通电
2Cl--2e-=Cl2↑
2NaCl(熔融)===2Na+Cl2↑
2Na++2e-=2Na
13
六月
2020
17
阳极:
阴极:
总反应:
4、电冶金
(熔融NaCl作电解质)
铝的冶炼
C
Fe
通电
阴极:
4Al
3+
+
12
e-
=4Al
阳极:
6O
2-
-12e
-
=3O2↑
总反应:
2Al2O3(熔融)===4Al+3O2↑
13
六月
2020
18
熔融Al2O3
(熔融Al2O3作电解质)
精制饱和
NaCl
水(含少
量NaOH)
-
Na+
+
Cl2
溶液A
淡盐水
H2
阳离子交换膜
(1)溶液A的溶质是
;
(2)电解饱和食盐水的离子方程式是
;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用________;
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
NaOH
2Cl-+2H2O====2OH-+H2↑+Cl2↑
电解
氯气与水反应:Cl2+H2O
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
13
六月
2020
19
