人教版高二化学选修4第四章 第二节 化学电源(共24张PPT)
文档属性
| 名称 | 人教版高二化学选修4第四章 第二节 化学电源(共24张PPT) | 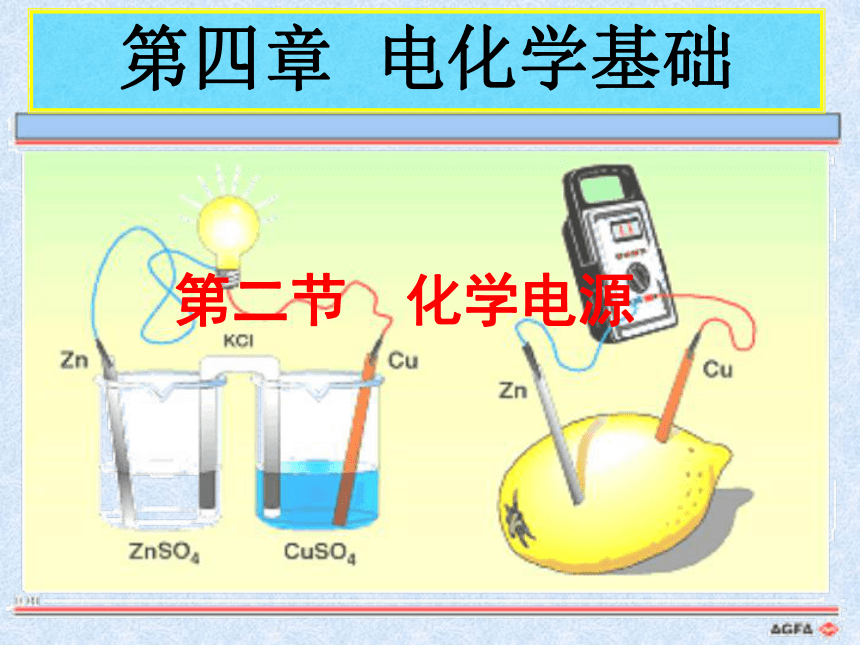 | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-22 21:58:22 | ||
图片预览






文档简介
(共24张PPT)
第四章
电化学基础
第二节
化学电源
一次电池
二次电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
燃料电池
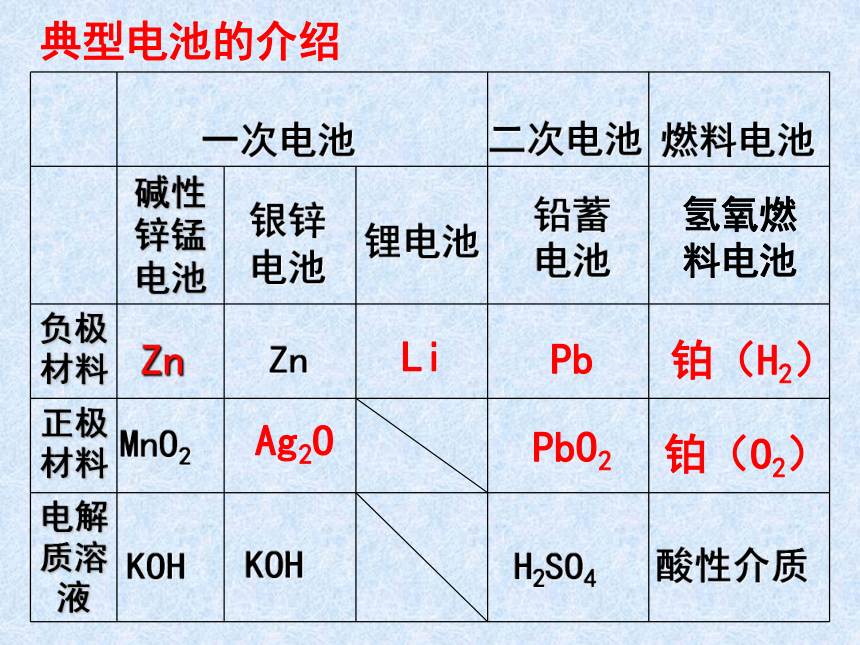
典型电池的介绍
Zn
Pb
Li
铂(H2)
PbO2
Ag2O
铂(O2)
一次电池
银锌电池
二次电池
燃料电池
锂电池
H2SO4
铅蓄电池
氢氧燃料电池
Zn
KOH
KOH
酸性介质
MnO2
碱性锌锰电池
负极材料
正极材料
电解质溶液
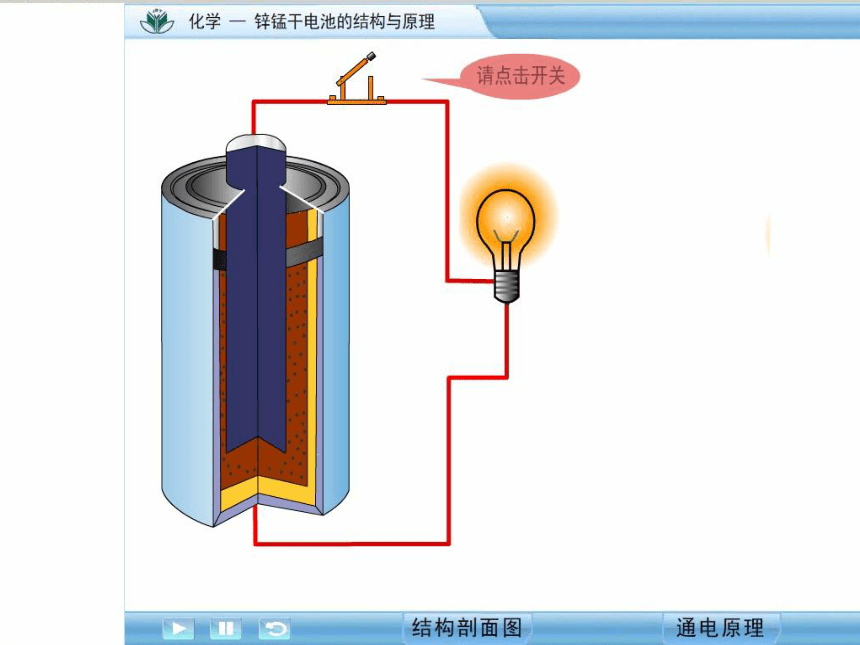
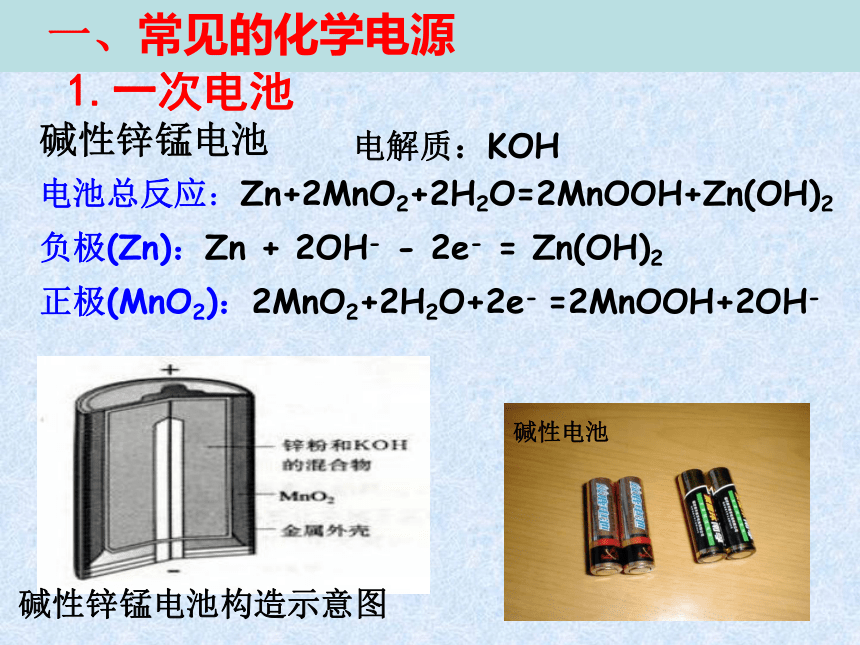
碱性锌锰电池构造示意图
碱性锌锰电池
一、常见的化学电源
电解质:KOH
1.一次电池
碱性锌锰电池构造示意图
正极(MnO2):2MnO2+2H2O+2e-
=2MnOOH+2OH-
碱性锌锰电池
电解质:KOH
负极(Zn):Zn
+
2OH-
-
2e-
=
Zn(OH)2
电池总反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
1.一次电池
一、常见的化学电源
(1)正负极材料
正极:PbO2
负极:Pb
电解质:
H2SO4溶液
2.二次电池
铅蓄电池
放电过程总反应:
Pb(s)+PbO2(s)+2H2SO4=2PbSO4(s)+2H2O
Pb(s)
+
SO42-
-2e-
=PbSO4
(s)
正极:
PbO2(s)
+
4H++SO42-
+2e-
=2PbSO4
(s)
+2H2O
(氧化反应)
(还原反应)
负极:
①放电过程
铅蓄电池充电的反应则是上述反应的逆过程
Pb(s)+PbO2(s)+2H2SO4
2PbSO4(s)+2H2O(l)
②充电过程
PbSO4
(s)
+2e-
=Pb(s)
+
SO42-
还原反应
阴极:
阳极:
PbSO4
(s)+2H2O
-2e-
=
PbO2(s)
+
4H+
+
SO42-
氧化反应
接电源负极
接电源正极
充电过程总反应:
2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4
铅蓄电池的充放电过程:
3、燃料电池
氢氧燃料电池
酸性介质H+
3、燃料电池
负极(Pt):2H2-4e-=4H+
正极(Pt):O2+4H++4e-=2H2O
电池总反应:2H2+O2=2H2O
氢氧燃料电池
酸性介质H+
水
果
电
池
锌片
铜片
LED灯
橙子
减
少
污
染
节
约
资
源
二、废弃电池的回收利用刻不容缓
随堂检测:
1.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li
+
MnO2=LiMnO2,下列说法正确的是(
)
A、
Li是正极,电极反应为Li
-
e-
=
Li+
B、
Li是负极,电极反应为Li
-
e-
=
Li+
C、
Li是负极,电极反应为MnO2
+
e-
=
MnO2–
D、
Li是负极,电极反应为Li
-2e-
=
Li2+
B
随堂检测:
2.氢氧燃料电池是一种高效、低污染的新型电池,主要用于航天领域。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极、活性炭电极等。该电池
为燃料,
为氧化剂,不但可用
性电解质(如稀H2SO4),还可用碱性电解质(如
KOH
)。当用碱性电解质时,电极反应为:
负极:____________________________________
正极:____________________________________
总反应式:___________________
氢气
氧气
酸
2H2+O2=2
H2O
2H2-
4e-+4OH-
=4
H2O
02+2H20+4e-
=40H-
书写电极反应式应注意以下几点:
1.负失正得,
3.正负相加,得总式。
2.看介质,三守恒。
三、展望化学电池的发展方向
主要方向:
绿色环保、质量轻、体积小、容量大、使用寿命长、价格便宜。
作业:
1.试写出甲烷燃料电池酸性介质、碱性介质下的电极反应式。
2.调查市场常见电池的种类、应用和回收价值。
水
果
电
池
锌片
铜片
LED灯
橙子
第四章
电化学基础
第二节
化学电源
一次电池
二次电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
燃料电池
典型电池的介绍
Zn
Pb
Li
铂(H2)
PbO2
Ag2O
铂(O2)
一次电池
银锌电池
二次电池
燃料电池
锂电池
H2SO4
铅蓄电池
氢氧燃料电池
Zn
KOH
KOH
酸性介质
MnO2
碱性锌锰电池
负极材料
正极材料
电解质溶液
碱性锌锰电池构造示意图
碱性锌锰电池
一、常见的化学电源
电解质:KOH
1.一次电池
碱性锌锰电池构造示意图
正极(MnO2):2MnO2+2H2O+2e-
=2MnOOH+2OH-
碱性锌锰电池
电解质:KOH
负极(Zn):Zn
+
2OH-
-
2e-
=
Zn(OH)2
电池总反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
1.一次电池
一、常见的化学电源
(1)正负极材料
正极:PbO2
负极:Pb
电解质:
H2SO4溶液
2.二次电池
铅蓄电池
放电过程总反应:
Pb(s)+PbO2(s)+2H2SO4=2PbSO4(s)+2H2O
Pb(s)
+
SO42-
-2e-
=PbSO4
(s)
正极:
PbO2(s)
+
4H++SO42-
+2e-
=2PbSO4
(s)
+2H2O
(氧化反应)
(还原反应)
负极:
①放电过程
铅蓄电池充电的反应则是上述反应的逆过程
Pb(s)+PbO2(s)+2H2SO4
2PbSO4(s)+2H2O(l)
②充电过程
PbSO4
(s)
+2e-
=Pb(s)
+
SO42-
还原反应
阴极:
阳极:
PbSO4
(s)+2H2O
-2e-
=
PbO2(s)
+
4H+
+
SO42-
氧化反应
接电源负极
接电源正极
充电过程总反应:
2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4
铅蓄电池的充放电过程:
3、燃料电池
氢氧燃料电池
酸性介质H+
3、燃料电池
负极(Pt):2H2-4e-=4H+
正极(Pt):O2+4H++4e-=2H2O
电池总反应:2H2+O2=2H2O
氢氧燃料电池
酸性介质H+
水
果
电
池
锌片
铜片
LED灯
橙子
减
少
污
染
节
约
资
源
二、废弃电池的回收利用刻不容缓
随堂检测:
1.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li
+
MnO2=LiMnO2,下列说法正确的是(
)
A、
Li是正极,电极反应为Li
-
e-
=
Li+
B、
Li是负极,电极反应为Li
-
e-
=
Li+
C、
Li是负极,电极反应为MnO2
+
e-
=
MnO2–
D、
Li是负极,电极反应为Li
-2e-
=
Li2+
B
随堂检测:
2.氢氧燃料电池是一种高效、低污染的新型电池,主要用于航天领域。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极、活性炭电极等。该电池
为燃料,
为氧化剂,不但可用
性电解质(如稀H2SO4),还可用碱性电解质(如
KOH
)。当用碱性电解质时,电极反应为:
负极:____________________________________
正极:____________________________________
总反应式:___________________
氢气
氧气
酸
2H2+O2=2
H2O
2H2-
4e-+4OH-
=4
H2O
02+2H20+4e-
=40H-
书写电极反应式应注意以下几点:
1.负失正得,
3.正负相加,得总式。
2.看介质,三守恒。
三、展望化学电池的发展方向
主要方向:
绿色环保、质量轻、体积小、容量大、使用寿命长、价格便宜。
作业:
1.试写出甲烷燃料电池酸性介质、碱性介质下的电极反应式。
2.调查市场常见电池的种类、应用和回收价值。
水
果
电
池
锌片
铜片
LED灯
橙子
