高中化学人教版选修4第二章第二节 影响化学反应速率的因素 课件(24张PPT)
文档属性
| 名称 | 高中化学人教版选修4第二章第二节 影响化学反应速率的因素 课件(24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-22 22:03:25 | ||
图片预览






文档简介
(共24张PPT)
第二节 影响化学反应速率的因素
影响化学反应速率的因素有哪些?
思考
选择1个你认为可能会影响化学反应速率的因素,利用现有的仪器和药品,设计实验。
【实验药品】
0.01
mol/L
酸性KMnO4
溶液,0.1
mol/L
H2C2O4
溶液,
0.2
mol/L
H2C2O4
溶液、铁钉、铁粉、1
mol/L
H2SO4
溶液,
4
mol/L
H2SO4
溶液,0.1
mol/L
Na2S2O3溶液、氧化铜粉末、二氧化锰粉末、3%
H2O2、蒸馏水、热水等
提示:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
Na2S2O3
+
H2SO4
=
Na2SO4
+
SO2
+
S↓+
H2O
实验探究
1、你的探究的是那种影响速率因素?
2、你研究哪一个反应?
3、你的实验方案是什么?
4、你准备记录什么数据或如何比较反应快慢?
交流设计
0.01
mol/L
酸性KMnO4
溶液,0.1
mol/L
H2C2O4
溶液,
0.2
mol/L
H2C2O4
溶液、铁钉、铁粉、1
mol/L
H2SO4
溶液,
4
mol/L
H2SO4
溶液,0.1
mol/L
Na2S2O3溶液、氧化铜粉末、二氧化锰粉末、3%
H2O2、蒸馏水、热水等
注意安全,小心玻璃仪器,小心部分溶液,小心热水等。
注意小组成员分共,确定推荐组长发言
注意操作细节,观察现象,得出结论
注意时间把握,准备与大家交流结果
友情提醒
进行实验
1、我的探究的是……
2、利用……反应
3、具体方法是……
4、结果……
说明……
汇报结果
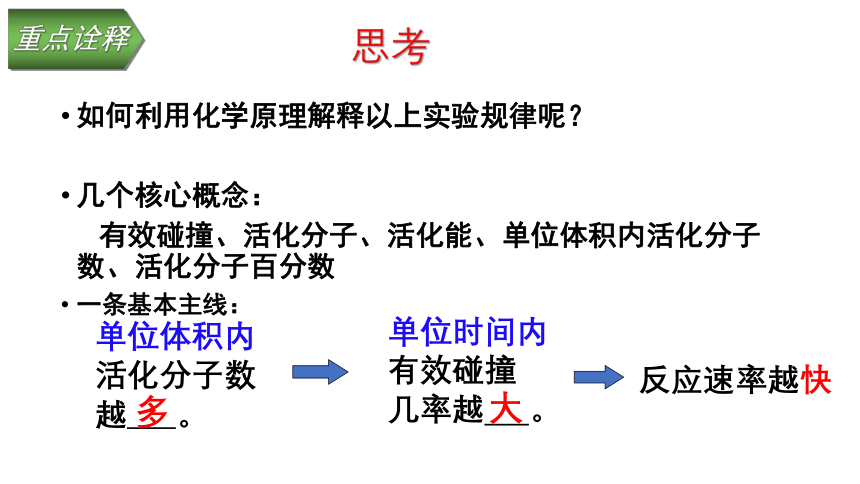
思考
如何利用化学原理解释以上实验规律呢?
几个核心概念:
有效碰撞、活化分子、活化能、单位体积内活化分子数、活化分子百分数
一条基本主线:
反应速率越快
单位时间内
有效碰撞
几率越
。
单位体积内
活化分子数越
。
大
多
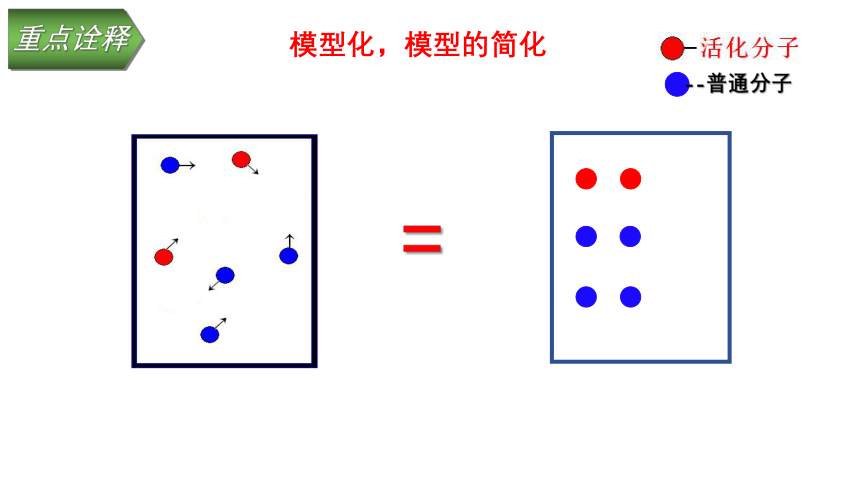
重点诠释
模型化,模型的简化
=
--普通分子
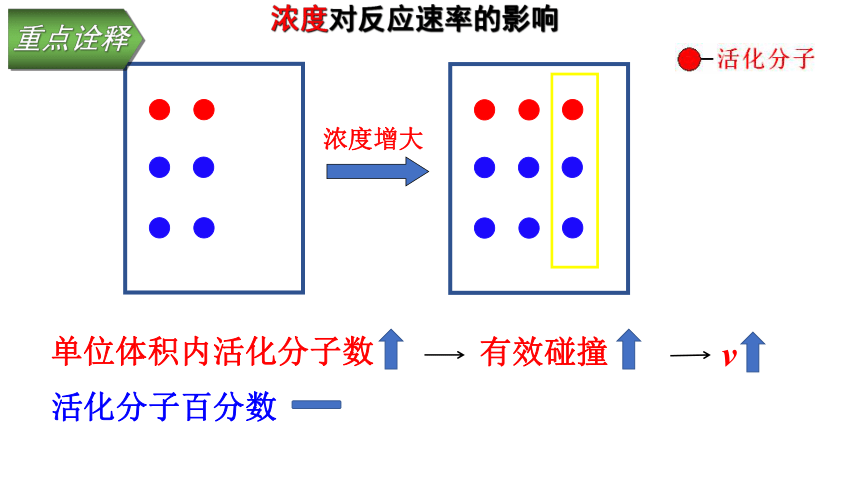
重点诠释
活化分子百分数
单位体积内活化分子数
浓度增大
v
有效碰撞
浓度对反应速率的影响
重点诠释
活化分子百分数
单位体积内活化分子数
温度升高
v
有效碰撞
温度对反应速率的影响
一方面
另一方面
重点诠释
活化分子百分数
单位体积内活化分子数
温度升高
v
有效碰撞
催化剂对反应速率的影响
重点诠释
增大压强,
化学反应速率如何改变呢?
浓度
温度
催化剂
问题1、缩小体积,增大压强,速率如何改变?
讨论:对于反应
难点突破
问题2、恒容条件下,充入He
气,增大压强,反应速率如何改变?
问题3、恒容条件下,中充入N2气,反应速率如何改变?
问题4、恒压条件下,中充入He气,反应速率如何改变?
问题1、缩小体积,增大压强,速率如何改变?
讨论:对于反应
难点突破
问题2、恒容条件下,充入He
气,增大压强,反应速率如何改变?
讨论:对于反应
活化分子
增大
压强
,
化学反应速率?
难点突破
问题3、恒容条件下,中充入N2气,反应速率如何改变?
问题4、恒压条件下,中充入He气,反应速率如何改变?
讨论:例1、对于反应
难点突破
例2.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率的影响是什么?
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
例3、对于反应:3Fe(s)+4H2O(g)
?
Fe3O4(s)+4H2(g)
改变其中一个反应条件对反应速率的影响状况。
瞬时速率
知识迁移
改变的条件
正反应速率
逆反应速率
1、增加Fe的量
2、增大水蒸气浓度
3、将容器体积缩小一半
4、保持体积不变,充氮气
5、保持压强不变,充氮气
6、升高温度
7、加催化剂
影响化学反应速率的因素
化学反应速率
内因(主因)
:反应物本身性质
外因
浓度
温度
催化剂
压强
……
本堂小结
1.同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的是( )
①锌粒 ②锌片 ③锌粉 ④5%的盐酸 ⑤10%的盐酸 ⑥15%的盐酸 ⑦加热 ⑧用冷水冷却 ⑨不断振荡 ⑩迅速混合后静置
A.②⑥⑦⑩
B.①④⑧⑩
C.③⑤⑦⑨
D.③⑥⑦⑨
D
随堂练习
2.在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度
③增大压强
④移去生成物
⑤加入正催化剂
A.①②③
B.①②③⑤
C.②⑤
D.①②③④⑤
C
3.下列有关有效碰撞理论和活化能的认识,正确的是
( )
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大。
B.温度升高,分子动能增加,单位体积内活化分子数增多,故反应速率增大。
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大。
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率。
B
4.在恒温、恒容的密闭容器中进行反应
2H2O2
?
2H2O+O2↑。若H2O2溶液的浓度由2.0
mol·L-1降到1.0
mol·L-1需10
s,那么H2O2浓度由1.0
mol·L-1降到0.5
mol·L-1所需的反应时间为( )。
A.5
s
B.大于5
s
C.小于5
s
D.无法判断
B
追求客观真理和知识是人的最高和永恒的目标。
------爱因斯坦
谢
谢
第二节 影响化学反应速率的因素
影响化学反应速率的因素有哪些?
思考
选择1个你认为可能会影响化学反应速率的因素,利用现有的仪器和药品,设计实验。
【实验药品】
0.01
mol/L
酸性KMnO4
溶液,0.1
mol/L
H2C2O4
溶液,
0.2
mol/L
H2C2O4
溶液、铁钉、铁粉、1
mol/L
H2SO4
溶液,
4
mol/L
H2SO4
溶液,0.1
mol/L
Na2S2O3溶液、氧化铜粉末、二氧化锰粉末、3%
H2O2、蒸馏水、热水等
提示:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
Na2S2O3
+
H2SO4
=
Na2SO4
+
SO2
+
S↓+
H2O
实验探究
1、你的探究的是那种影响速率因素?
2、你研究哪一个反应?
3、你的实验方案是什么?
4、你准备记录什么数据或如何比较反应快慢?
交流设计
0.01
mol/L
酸性KMnO4
溶液,0.1
mol/L
H2C2O4
溶液,
0.2
mol/L
H2C2O4
溶液、铁钉、铁粉、1
mol/L
H2SO4
溶液,
4
mol/L
H2SO4
溶液,0.1
mol/L
Na2S2O3溶液、氧化铜粉末、二氧化锰粉末、3%
H2O2、蒸馏水、热水等
注意安全,小心玻璃仪器,小心部分溶液,小心热水等。
注意小组成员分共,确定推荐组长发言
注意操作细节,观察现象,得出结论
注意时间把握,准备与大家交流结果
友情提醒
进行实验
1、我的探究的是……
2、利用……反应
3、具体方法是……
4、结果……
说明……
汇报结果
思考
如何利用化学原理解释以上实验规律呢?
几个核心概念:
有效碰撞、活化分子、活化能、单位体积内活化分子数、活化分子百分数
一条基本主线:
反应速率越快
单位时间内
有效碰撞
几率越
。
单位体积内
活化分子数越
。
大
多
重点诠释
模型化,模型的简化
=
--普通分子
重点诠释
活化分子百分数
单位体积内活化分子数
浓度增大
v
有效碰撞
浓度对反应速率的影响
重点诠释
活化分子百分数
单位体积内活化分子数
温度升高
v
有效碰撞
温度对反应速率的影响
一方面
另一方面
重点诠释
活化分子百分数
单位体积内活化分子数
温度升高
v
有效碰撞
催化剂对反应速率的影响
重点诠释
增大压强,
化学反应速率如何改变呢?
浓度
温度
催化剂
问题1、缩小体积,增大压强,速率如何改变?
讨论:对于反应
难点突破
问题2、恒容条件下,充入He
气,增大压强,反应速率如何改变?
问题3、恒容条件下,中充入N2气,反应速率如何改变?
问题4、恒压条件下,中充入He气,反应速率如何改变?
问题1、缩小体积,增大压强,速率如何改变?
讨论:对于反应
难点突破
问题2、恒容条件下,充入He
气,增大压强,反应速率如何改变?
讨论:对于反应
活化分子
增大
压强
,
化学反应速率?
难点突破
问题3、恒容条件下,中充入N2气,反应速率如何改变?
问题4、恒压条件下,中充入He气,反应速率如何改变?
讨论:例1、对于反应
难点突破
例2.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率的影响是什么?
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
例3、对于反应:3Fe(s)+4H2O(g)
?
Fe3O4(s)+4H2(g)
改变其中一个反应条件对反应速率的影响状况。
瞬时速率
知识迁移
改变的条件
正反应速率
逆反应速率
1、增加Fe的量
2、增大水蒸气浓度
3、将容器体积缩小一半
4、保持体积不变,充氮气
5、保持压强不变,充氮气
6、升高温度
7、加催化剂
影响化学反应速率的因素
化学反应速率
内因(主因)
:反应物本身性质
外因
浓度
温度
催化剂
压强
……
本堂小结
1.同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的是( )
①锌粒 ②锌片 ③锌粉 ④5%的盐酸 ⑤10%的盐酸 ⑥15%的盐酸 ⑦加热 ⑧用冷水冷却 ⑨不断振荡 ⑩迅速混合后静置
A.②⑥⑦⑩
B.①④⑧⑩
C.③⑤⑦⑨
D.③⑥⑦⑨
D
随堂练习
2.在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度
③增大压强
④移去生成物
⑤加入正催化剂
A.①②③
B.①②③⑤
C.②⑤
D.①②③④⑤
C
3.下列有关有效碰撞理论和活化能的认识,正确的是
( )
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大。
B.温度升高,分子动能增加,单位体积内活化分子数增多,故反应速率增大。
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大。
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率。
B
4.在恒温、恒容的密闭容器中进行反应
2H2O2
?
2H2O+O2↑。若H2O2溶液的浓度由2.0
mol·L-1降到1.0
mol·L-1需10
s,那么H2O2浓度由1.0
mol·L-1降到0.5
mol·L-1所需的反应时间为( )。
A.5
s
B.大于5
s
C.小于5
s
D.无法判断
B
追求客观真理和知识是人的最高和永恒的目标。
------爱因斯坦
谢
谢
