高中化学人教版选修4第二章第四节 化学反应进行的方向 课件(26张PPT)
文档属性
| 名称 | 高中化学人教版选修4第二章第四节 化学反应进行的方向 课件(26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 15.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-22 22:06:31 | ||
图片预览







文档简介
(共26张PPT)
化学反应进行的方向
选修四
第二章
第四节
在T、P一定的条件下,不借助光、电等外部力量就能自动进行的过程叫做自发过程,相反,不会自然发生的过程叫做非自发过程。
王磊等.化学反应原理(选修)[M].山东科学技术出版社.2007.35
探究任务:
在一定的温度、压强条件下,一个化学反应朝着什么样的方向自发进行?
爆炸反应中的能量变化是怎样的?
△H<0
放热反应
体系的能量降低
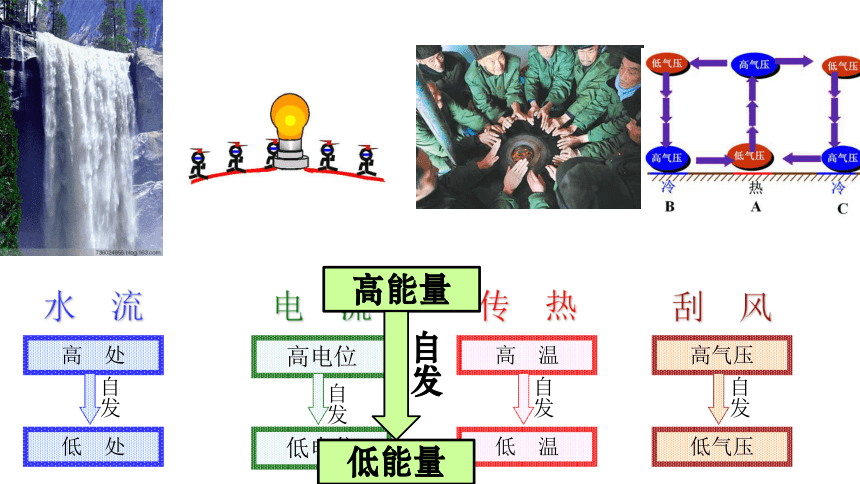
水 流
高 处
低 处
电 流
高电位
低电位
传 热
高 温
低 温
刮 风
高气压
低气压
自发
自发
自发
自发
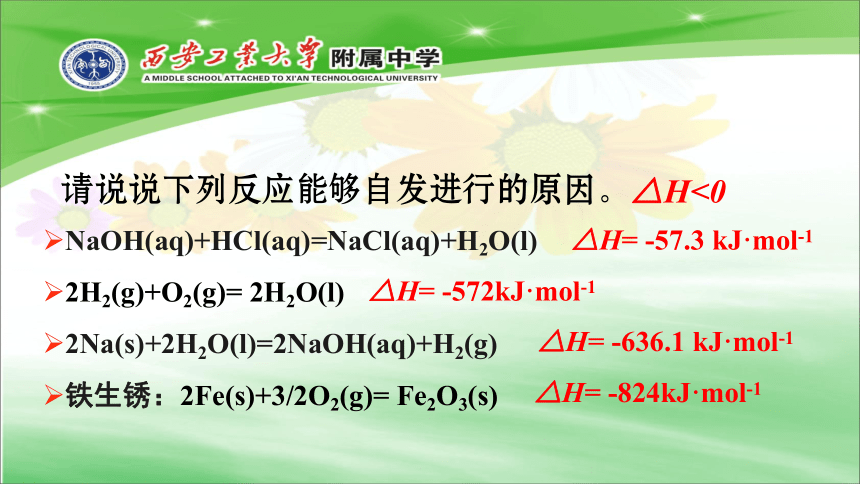
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
2H2(g)+O2(g)=
2H2O(l)
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)
铁生锈:2Fe(s)+3/2O2(g)=
Fe2O3(s)
请说说下列反应能够自发进行的原因。
△H<0
△H=
-57.3
kJ·mol-1
△H=
-572kJ·mol-1
△H=
-636.1
kJ·mol-1
△H=
-824kJ·mol-1
放热反应(△H<0
)具有自发的倾向
一、焓判据(能量判据)
【宏观能量】
19世纪,化学家们曾认为决定化学反应能否自发进行的因素是反应热:放热反应自发进行,吸热不能自发进行。是真的吗?
将一定量Ba(OH)2·8H2O晶体与一定量的NH4Cl晶体一起放入塑料袋中,揉搓使之混合均匀。片刻后,你发现了什么?
实验证伪:
2NH4Cl(s)+Ba(OH)2·
8H2O(s)
=2NH3(g)+BaCl2(s)+10H2O(l)
△H>0
2NH4Cl(s)+Ba(OH)2·
8H2O(s)
=2NH3(g)+BaCl2(s)+10H2O(l)
△H>0
△S
>0
试根据熵的定义判断下列过程中体系的熵变大于零还是小于零。
(1)水蒸气冷凝成水
(2)硫酸铜溶于水
(3)CaCO3(s)=CaO(s)+CO2(g)
(4)
2N2O5(g)=4NO2(g)+O2(g)
(5)2H2(g)+
O2(g)
=2H2O
(l)
△S<0
△S>0
△S>0
△S<0
知识巩固1
△S>0
熵增反应(△S>0
)具有自发的倾向
二、熵判据
【微观结构】
一定温度、压强下,熵增反应自发进行,熵减不能自发进行。是真的吗?
2H2(g)+O2(g)=
2H2O(l)
△S<0
NH3(g)+HCl(g)=
NH4Cl(s)
△S<0
实例证伪:
都可自发进行
根据《物理化学》相关章节介绍:判断反应方向有三种不同的前提情况:隔离体系、等温等容、等温等压。我们教材把这三种情况统称为一定条件,加热、点燃、高温是为了达到某一反应温度,都属于一定条件的范畴。
室温
冰融化
-10
℃
水结冰
H2O(l)
=
H2O
(s)
△H
<0
△S<0
H2O(s)
=
H2O
(l)
△H
>0
△S>0
寻找全面的判据:
三、复合判据(自由能判据)
△G=△H—T△S
△G<0
反应自发进行
吉布斯(美国)
自发进行
非自发进行
低温自发进行
高温自发进行
?H<0
?H<0
?H>0
?H>0
?S>0
?S>0
?S<0
?S<0
△G=△H—T△S
△G<0
反应自发进行
焓变
熵变
化学反应能否自发进行
判断下列反应什么条件下能自发进行?
(1)
钠与水反应
(2)
NH3(g)+HCl(g)
=NH4Cl(s)
C(s)+H2O(g)=CO(g)+H2(g)
(4)
2CO(g)=2C(s)+O2(g)
△H
<0
△S>0
自发进行
△H
<0
△S
<0
低温自发进行
△H
>0
△S>0
高温自发进行
△H
>0
△S<0
非自发进行
知识巩固2
应用举例
1.判断反应的自发性
汽车尾气中的主要污染物是NO和CO,它们是现代化城市中的大气污染物。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)=N2(g)+2CO2(g)
你能否判断该反应在室温下能自发进行吗?
根据计算,298K、100kPa下,△H=-746.8KJ·mol
-1
ΔS=-197.5J·mol-1·K-1
△G
=ΔH-T
ΔS
=-746.8KJ·mol-1+298K×197.5×10-3
KJ·mol-1·K-1
=-687.945
KJ.mol-1<0
可自发进行!
?H-T?S这个判据指出的是在T、P一定的条件下反应自动发生的趋势,即反应发生的可能性,并不能说明反应能否实际发生!
工业冶钛
①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
△H=+161.9KJ/mol
ΔS=-38.4
J·mol-1·K-1
②Mg+
TiCl4=Ti+
MgCl2
2C(s,石墨)+
O2(g)
=
2CO(g)
△H=-110.5KJ/mol
ΔS=+89.7
J·mol-1·K-1
TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)
△H=-59.2KJ/mol
ΔS=+1
41.0
J·mol-1·K-1
2.工业上“改造”反应
知识小结
放热倾向诚可贵,
混乱增大价亦高。
若为自由能之故,
二者结合不可抛。
自发反应
谢
谢!
化学反应进行的方向
选修四
第二章
第四节
在T、P一定的条件下,不借助光、电等外部力量就能自动进行的过程叫做自发过程,相反,不会自然发生的过程叫做非自发过程。
王磊等.化学反应原理(选修)[M].山东科学技术出版社.2007.35
探究任务:
在一定的温度、压强条件下,一个化学反应朝着什么样的方向自发进行?
爆炸反应中的能量变化是怎样的?
△H<0
放热反应
体系的能量降低
水 流
高 处
低 处
电 流
高电位
低电位
传 热
高 温
低 温
刮 风
高气压
低气压
自发
自发
自发
自发
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
2H2(g)+O2(g)=
2H2O(l)
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)
铁生锈:2Fe(s)+3/2O2(g)=
Fe2O3(s)
请说说下列反应能够自发进行的原因。
△H<0
△H=
-57.3
kJ·mol-1
△H=
-572kJ·mol-1
△H=
-636.1
kJ·mol-1
△H=
-824kJ·mol-1
放热反应(△H<0
)具有自发的倾向
一、焓判据(能量判据)
【宏观能量】
19世纪,化学家们曾认为决定化学反应能否自发进行的因素是反应热:放热反应自发进行,吸热不能自发进行。是真的吗?
将一定量Ba(OH)2·8H2O晶体与一定量的NH4Cl晶体一起放入塑料袋中,揉搓使之混合均匀。片刻后,你发现了什么?
实验证伪:
2NH4Cl(s)+Ba(OH)2·
8H2O(s)
=2NH3(g)+BaCl2(s)+10H2O(l)
△H>0
2NH4Cl(s)+Ba(OH)2·
8H2O(s)
=2NH3(g)+BaCl2(s)+10H2O(l)
△H>0
△S
>0
试根据熵的定义判断下列过程中体系的熵变大于零还是小于零。
(1)水蒸气冷凝成水
(2)硫酸铜溶于水
(3)CaCO3(s)=CaO(s)+CO2(g)
(4)
2N2O5(g)=4NO2(g)+O2(g)
(5)2H2(g)+
O2(g)
=2H2O
(l)
△S<0
△S>0
△S>0
△S<0
知识巩固1
△S>0
熵增反应(△S>0
)具有自发的倾向
二、熵判据
【微观结构】
一定温度、压强下,熵增反应自发进行,熵减不能自发进行。是真的吗?
2H2(g)+O2(g)=
2H2O(l)
△S<0
NH3(g)+HCl(g)=
NH4Cl(s)
△S<0
实例证伪:
都可自发进行
根据《物理化学》相关章节介绍:判断反应方向有三种不同的前提情况:隔离体系、等温等容、等温等压。我们教材把这三种情况统称为一定条件,加热、点燃、高温是为了达到某一反应温度,都属于一定条件的范畴。
室温
冰融化
-10
℃
水结冰
H2O(l)
=
H2O
(s)
△H
<0
△S<0
H2O(s)
=
H2O
(l)
△H
>0
△S>0
寻找全面的判据:
三、复合判据(自由能判据)
△G=△H—T△S
△G<0
反应自发进行
吉布斯(美国)
自发进行
非自发进行
低温自发进行
高温自发进行
?H<0
?H<0
?H>0
?H>0
?S>0
?S>0
?S<0
?S<0
△G=△H—T△S
△G<0
反应自发进行
焓变
熵变
化学反应能否自发进行
判断下列反应什么条件下能自发进行?
(1)
钠与水反应
(2)
NH3(g)+HCl(g)
=NH4Cl(s)
C(s)+H2O(g)=CO(g)+H2(g)
(4)
2CO(g)=2C(s)+O2(g)
△H
<0
△S>0
自发进行
△H
<0
△S
<0
低温自发进行
△H
>0
△S>0
高温自发进行
△H
>0
△S<0
非自发进行
知识巩固2
应用举例
1.判断反应的自发性
汽车尾气中的主要污染物是NO和CO,它们是现代化城市中的大气污染物。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)=N2(g)+2CO2(g)
你能否判断该反应在室温下能自发进行吗?
根据计算,298K、100kPa下,△H=-746.8KJ·mol
-1
ΔS=-197.5J·mol-1·K-1
△G
=ΔH-T
ΔS
=-746.8KJ·mol-1+298K×197.5×10-3
KJ·mol-1·K-1
=-687.945
KJ.mol-1<0
可自发进行!
?H-T?S这个判据指出的是在T、P一定的条件下反应自动发生的趋势,即反应发生的可能性,并不能说明反应能否实际发生!
工业冶钛
①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
△H=+161.9KJ/mol
ΔS=-38.4
J·mol-1·K-1
②Mg+
TiCl4=Ti+
MgCl2
2C(s,石墨)+
O2(g)
=
2CO(g)
△H=-110.5KJ/mol
ΔS=+89.7
J·mol-1·K-1
TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)
△H=-59.2KJ/mol
ΔS=+1
41.0
J·mol-1·K-1
2.工业上“改造”反应
知识小结
放热倾向诚可贵,
混乱增大价亦高。
若为自由能之故,
二者结合不可抛。
自发反应
谢
谢!
