人教版选修四 2.3 浓度对化学平衡影响的探究(共17张PPT)
文档属性
| 名称 | 人教版选修四 2.3 浓度对化学平衡影响的探究(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 612.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-23 14:15:32 | ||
图片预览





文档简介
(共17张PPT)
浓度对化学平衡影响的探究
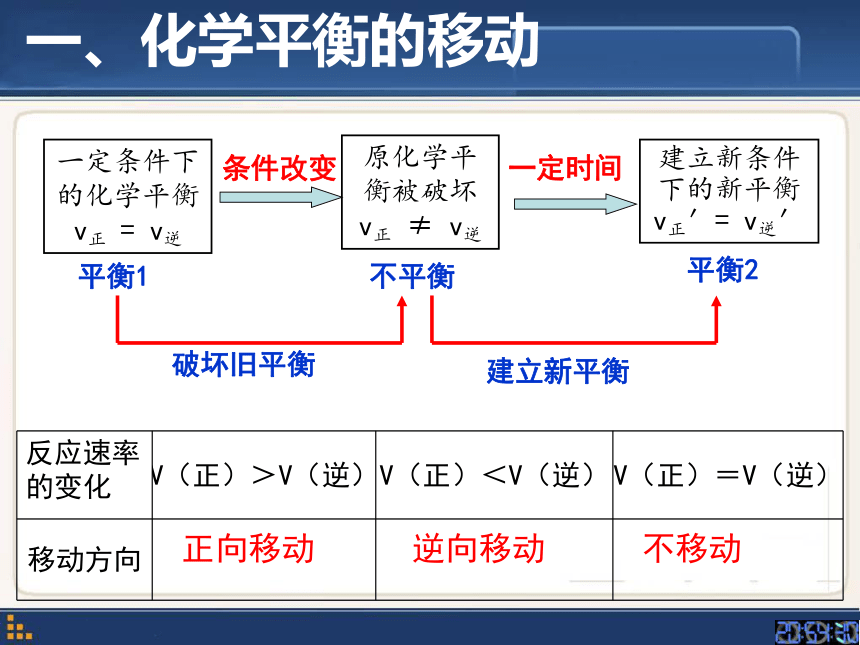
一、化学平衡的移动
不移动
正向移动
逆向移动
一定条件下的化学平衡
v正
=
v逆
原化学平衡被破坏
v正
≠
v逆
建立新条件下的新平衡
v正′=
v逆′
平衡2
平衡1
不平衡
反应速率
的变化
V(正)>V(逆)
V(正)<V(逆)
V(正)=V(逆)
移动方向
【讨论】哪些因素能通过改变化学反应速率以使化学平衡发生移动?
二、影响化学平衡的条件
实验探究:浓度对平衡移动的影响
药品:0.005mol/L
FeCl3
与0.01mol/L
KSCN的混合液(红色)、
1.0mol/L
FeCl3
、
1.0
mol/L
KSCN
、Fe粉、10%
NaOH、
蒸馏水
为了便于比较颜色的变化,要做对比实验
小组要明确分工(实验操作、现象记录、仪器药品处理、实验报告填写)
尊重实验事实,如实记录现象
时间约6分钟
温馨提示
若把上述可逆反应的反应物与生成物调换位置,如:
当达到平衡后,增大或减小生成物浓度,化学平衡将会向哪个方向移动呢?
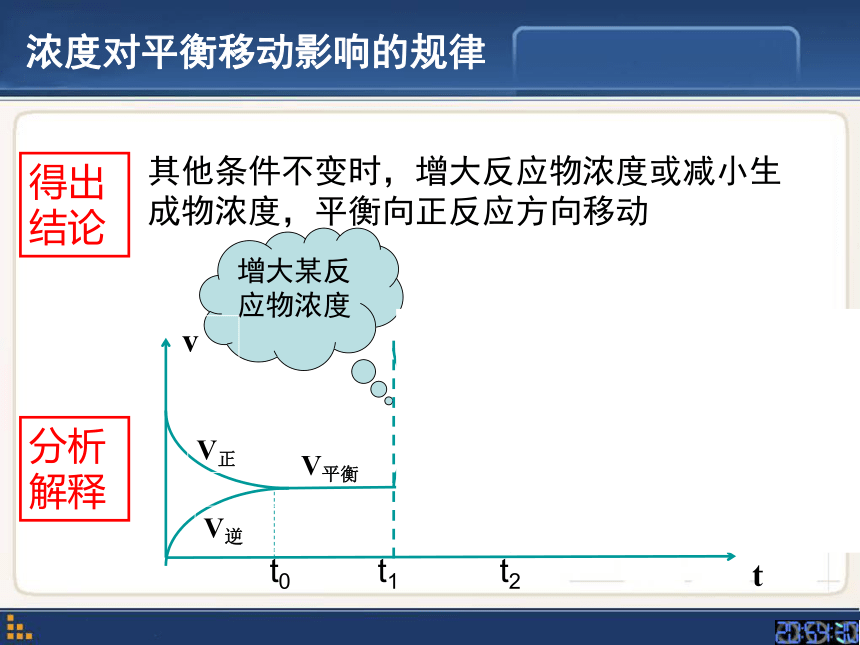
浓度对平衡移动影响的规律
其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动
分析解释
得出结论
增大某反应物浓度
瓶内的物质有:空气、水、亚甲基蓝、维生素C等
Vc可溶于水,具有强还原性,能与O2缓慢反应
【提出问题】为何瓶内液体经振荡--静置后颜色会反复变化?
蓝瓶子实验反应原理较为复杂,可简单表示如下:
沙场练兵
科学较真
振荡时O2溶于水,浓度增大,平衡正移,变为蓝色;
静置时O2被Vc消耗,浓度减小,平衡逆移,变为无色。
测定溶液中溶解氧浓度的变化
【猜想假设】
【实验方案】
反应
H2(g)+
I2
(g)
2
HI(g)
在698.6K时的各物质的初始浓度和平衡浓度的数据
2
初始浓度/mol·L-1
平衡浓度/mol·L-1
c(HI)
c(H2)c(I2)
c0(H2)
c0(I2)
c0(HI)
c(H2)
c(I2)
c(HI)
1
0.01067
0.01196
0
0.001831
0.003129
0.01767
54.50
2
0.01135
0.009044
0
0.003560
0.001250
0.01559
54.62
3
0
0
0.004489
0.0004798
0.0004798
0.003531
54.16
4
0
0
0.01069
0.001141
0.001141
0.008410
54.33
5
0.0100
0.0100
0.0100
0.0032
0.0032
0.02360
54.39
平均值
54.41
对于一般的可逆反应,aA+bB
cC+dD
在一定温度下的平衡体系:
化学平衡常数——K
在温度不变时,K为一常数,它用于定量地评价一个可逆反应在达平衡时限度,K值越大,化学反应的限度就越大。
分子是生成物的浓度幂之积
分母是反应物的浓度幂之积
浓度商——Q
cc
(C)
c
d(D)
平衡状态
任意状态
趋
向
趋
向
逆向移动
不移动
正向移动
相对大小
平衡移动方向
Q
>
K
Q
=
K
Q
<
K
(1)写出该反应的平衡常数表达式;
(2)达平衡后,加入蒸馏水稀释,使体积变为原来的两倍,
平衡将向哪个方向移动?
沙场练兵
无色
琥珀色
蓝色
【拓展视野】化学振荡与非平衡态
化学振荡仅发生在远离平衡态时。为什么会存在如此奇妙的化学振荡现象?请同学们课外查阅资料并加以讨论。
〖小结〗
浓度改变
V正≠V逆
平衡移动
1、科学知识:
2、哲学观点:动态平衡——运动是永恒的旋律
3、研究方法:控制变量,实验探究浓度对化学平衡的影响
4、科学之美:化学平衡常数具有高度凝炼的简约之美
Q≠K
接触室
2SO2(g)+O2(g)
2SO3(g)
(1)写出该反应的平衡常数表达式;
(2)达平衡后,若O2浓度和SO3浓度同时增大两倍,平衡将如何移动?
(3)请从浓度角度考虑如何提高SO3的产率?
沙场练兵
浓度对化学平衡影响的探究
一、化学平衡的移动
不移动
正向移动
逆向移动
一定条件下的化学平衡
v正
=
v逆
原化学平衡被破坏
v正
≠
v逆
建立新条件下的新平衡
v正′=
v逆′
平衡2
平衡1
不平衡
反应速率
的变化
V(正)>V(逆)
V(正)<V(逆)
V(正)=V(逆)
移动方向
【讨论】哪些因素能通过改变化学反应速率以使化学平衡发生移动?
二、影响化学平衡的条件
实验探究:浓度对平衡移动的影响
药品:0.005mol/L
FeCl3
与0.01mol/L
KSCN的混合液(红色)、
1.0mol/L
FeCl3
、
1.0
mol/L
KSCN
、Fe粉、10%
NaOH、
蒸馏水
为了便于比较颜色的变化,要做对比实验
小组要明确分工(实验操作、现象记录、仪器药品处理、实验报告填写)
尊重实验事实,如实记录现象
时间约6分钟
温馨提示
若把上述可逆反应的反应物与生成物调换位置,如:
当达到平衡后,增大或减小生成物浓度,化学平衡将会向哪个方向移动呢?
浓度对平衡移动影响的规律
其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动
分析解释
得出结论
增大某反应物浓度
瓶内的物质有:空气、水、亚甲基蓝、维生素C等
Vc可溶于水,具有强还原性,能与O2缓慢反应
【提出问题】为何瓶内液体经振荡--静置后颜色会反复变化?
蓝瓶子实验反应原理较为复杂,可简单表示如下:
沙场练兵
科学较真
振荡时O2溶于水,浓度增大,平衡正移,变为蓝色;
静置时O2被Vc消耗,浓度减小,平衡逆移,变为无色。
测定溶液中溶解氧浓度的变化
【猜想假设】
【实验方案】
反应
H2(g)+
I2
(g)
2
HI(g)
在698.6K时的各物质的初始浓度和平衡浓度的数据
2
初始浓度/mol·L-1
平衡浓度/mol·L-1
c(HI)
c(H2)c(I2)
c0(H2)
c0(I2)
c0(HI)
c(H2)
c(I2)
c(HI)
1
0.01067
0.01196
0
0.001831
0.003129
0.01767
54.50
2
0.01135
0.009044
0
0.003560
0.001250
0.01559
54.62
3
0
0
0.004489
0.0004798
0.0004798
0.003531
54.16
4
0
0
0.01069
0.001141
0.001141
0.008410
54.33
5
0.0100
0.0100
0.0100
0.0032
0.0032
0.02360
54.39
平均值
54.41
对于一般的可逆反应,aA+bB
cC+dD
在一定温度下的平衡体系:
化学平衡常数——K
在温度不变时,K为一常数,它用于定量地评价一个可逆反应在达平衡时限度,K值越大,化学反应的限度就越大。
分子是生成物的浓度幂之积
分母是反应物的浓度幂之积
浓度商——Q
cc
(C)
c
d(D)
平衡状态
任意状态
趋
向
趋
向
逆向移动
不移动
正向移动
相对大小
平衡移动方向
Q
>
K
Q
=
K
Q
<
K
(1)写出该反应的平衡常数表达式;
(2)达平衡后,加入蒸馏水稀释,使体积变为原来的两倍,
平衡将向哪个方向移动?
沙场练兵
无色
琥珀色
蓝色
【拓展视野】化学振荡与非平衡态
化学振荡仅发生在远离平衡态时。为什么会存在如此奇妙的化学振荡现象?请同学们课外查阅资料并加以讨论。
〖小结〗
浓度改变
V正≠V逆
平衡移动
1、科学知识:
2、哲学观点:动态平衡——运动是永恒的旋律
3、研究方法:控制变量,实验探究浓度对化学平衡的影响
4、科学之美:化学平衡常数具有高度凝炼的简约之美
Q≠K
接触室
2SO2(g)+O2(g)
2SO3(g)
(1)写出该反应的平衡常数表达式;
(2)达平衡后,若O2浓度和SO3浓度同时增大两倍,平衡将如何移动?
(3)请从浓度角度考虑如何提高SO3的产率?
沙场练兵
