海水资源的开发与利用
图片预览







文档简介
(共45张PPT)
第二课时
海水资源的开发和利用
从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中
是“历史留给人类的资源储备”
海洋是美丽的,
也是富饶的
海底石油: 1350亿吨
天然气:140万亿立方米
镁、钾、铀、锶等矿物:
5亿亿吨(液体矿山)
锰结核:3万亿吨
可供人类利用的鱼虾贝藻为每年6亿吨,现在捕捞量为每年9000万吨
波浪能:700亿千瓦 潮汐能:27亿千瓦
重水:200万吨 水:13亿亿吨
我们面临的问题:
地球表面虽然有71%被水覆盖,但其中97.2%是海水,
在2.8%的淡水中,又有69%是人类难以利用的两极冰盖。
人类可用淡水只占全球水总量的0.77%
一、海水水资源的利用——海水淡化
1、使海水淡化的途径
通过海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
2、海水淡化的方法及其特点
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
其中蒸馏法的历史最久,技术和工艺也比较完善,但成本较高。
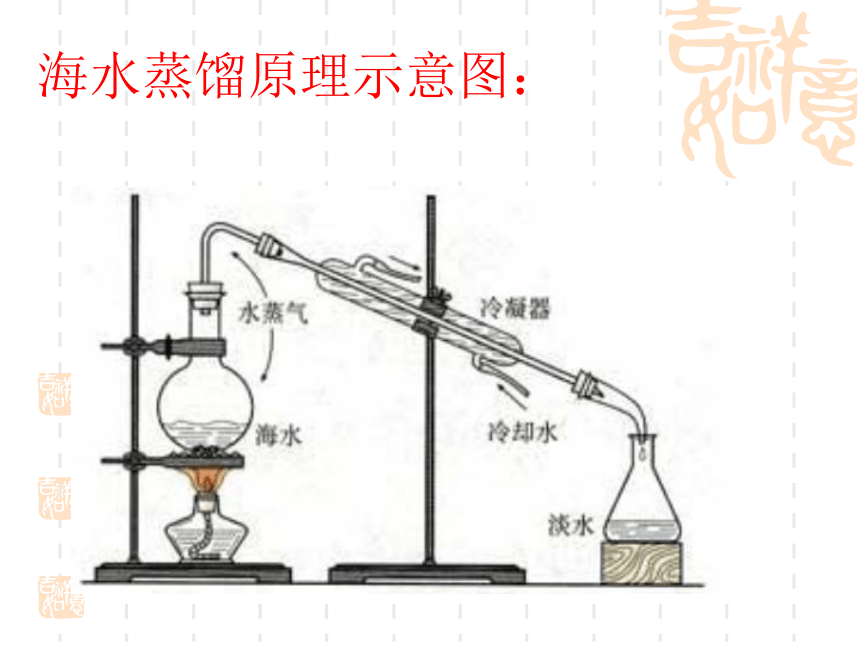
海水蒸馏原理示意图:
太阳能蒸发海水示意图:
二、海水化学资源的开发利用
海水综合利用的重要方向是:海水淡化同化工生产结合、同能源技术结合。如从海水中制得的氯化钠除食用外,还用作工业原料。从海水中制取镁、钾、溴及其化工产品,是在传统制盐工业上的发展。
从海水中获得其他物质和能量具有广阔的前景。例如,铀和重水目前是核能开发中的重要原料。化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能等也是越来越受到重视和开发的新型能源。
煮
海
为
盐
1、从海水中提取NaCl
粗盐中的杂质:
除杂试剂:
①Na2CO3 ②NaOH ③BaCl2
试剂加入顺序:
②③①
③②①
③①②
试剂加入顺序基本原则:
泥沙、Ca2+、Mg2+、SO42-
先加BaCl2,后加Na2CO3
粗盐的提纯:
2、海水中提取溴的实验方法
(1)用蒸馏法将海水浓缩。用硫酸将浓缩的海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。
(3)向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内。
(4)向吸收塔中溶液内通入适量的氯气。
(5)用CCl4萃取吸收塔中溶液里的溴单质。
主要流程:
海水
浓缩
酸化
浓缩海水Br-
通入
氯气
海水Cl-Br2
通入空气
水蒸气(吹入)
吸收塔SO2
反应后
富集溴
HBr、SO42-
通入Cl2
Cl-Br2
分离
溴单质
化学方程式:
2NaBr + Cl2 === Br2 +2NaCl
Br2 + SO2 + 2H2O === 2HBr + H2SO4
2HBr + Cl2 === Br2 + 2HCl
加碘食盐
缺碘导致大脖子病
海带
海带灰
灼烧
溶解过滤
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
3、海带中提取碘的实验方法
主要流程:
反应离子方程式:2I- + 2H+ +H2O2 I2+2H2O
1、水资源非常重要,联合国确定2003年为国际淡水年,以下关于水的说法错误的是( )
A、蒸馏法是海水淡化的方法之一;
B、淡水的密度小于海水的密度;
C、融化的雪水中矿物质含量比深井水中的少;
D、0℃以上,温度越高,水的密度越小。
D
随堂训练
2、下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是( )
A、碘水 B、溴水
C、氯化钾溶液 D、氯气
A、I2+2KBr=2KI+Br2
3、下列化学方程式正确的是( )
D、Br2+2KI=2KBr+I2
C、I2+2KCl=2KI+Cl2
C
D
B、Br2+2KCl=2KBr+Cl2
4、医生建议因缺少某种元素而患甲状腺肿大的病人多食海带,这是由于海带中含有较丰富的( )
A、碘元素 B、铁元素
C、钾元素 D、锌元素
A
5、一位海上遇难的水手,随着木排在海上漂流。他用完了淡水,感到异常口渴,但他不喝海水,因为他知道海水会致命,主要原因是( )
A、海水有苦涩味,根本喝不下去;
B、海水中含有多种盐,能使肠胃腐烂致人死亡;
C、海水中有许多微生物,有些微生物能致人死亡;
D、海水会造成人体水分从血液和组织内脱离出来,进入肠胃中,使人脱水死亡。
D
6、海水中含有MgCl2,从海水中提取Mg,最适宜的方法是( )
A、海水 Mg(OH)2 Mg
B、海水 MgCl2溶液 MgCl2(熔融) Mg
C、海水 Mg(OH)2 MgO Mg
D、海水 Mg(OH)2 MgCl2溶液 MgCl2(熔融) Mg
NaOH
电解
电解
HCl
电解
石灰乳
灼烧
石灰乳
HCl
电解
D
物质 氧化镁(MgO) 氯化镁(MgCl2)
熔点 2825℃ 714℃
证明海带中含有碘,有以下步骤
7、在检验海带中碘元素的实验中,有以下步骤:①灼烧海带至完全生成灰,停止加热,冷却;②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;③用剪刀剪碎海带,用酒精润湿,放入坩埚中; ④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤.
(1)合理的步骤是____________ ,
(2)证明含碘的步骤是_______ ,
现象是_____________________ ,
反应的离子方程式是 __________________________ 。
③①④②
②
滴入淀粉溶液,溶液变蓝
2I- + 2H+ +H2O2 I2+2H2O
第二课时
海水资源的开发和利用
从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中
是“历史留给人类的资源储备”
海洋是美丽的,
也是富饶的
海底石油: 1350亿吨
天然气:140万亿立方米
镁、钾、铀、锶等矿物:
5亿亿吨(液体矿山)
锰结核:3万亿吨
可供人类利用的鱼虾贝藻为每年6亿吨,现在捕捞量为每年9000万吨
波浪能:700亿千瓦 潮汐能:27亿千瓦
重水:200万吨 水:13亿亿吨
我们面临的问题:
地球表面虽然有71%被水覆盖,但其中97.2%是海水,
在2.8%的淡水中,又有69%是人类难以利用的两极冰盖。
人类可用淡水只占全球水总量的0.77%
一、海水水资源的利用——海水淡化
1、使海水淡化的途径
通过海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
2、海水淡化的方法及其特点
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
其中蒸馏法的历史最久,技术和工艺也比较完善,但成本较高。
海水蒸馏原理示意图:
太阳能蒸发海水示意图:
二、海水化学资源的开发利用
海水综合利用的重要方向是:海水淡化同化工生产结合、同能源技术结合。如从海水中制得的氯化钠除食用外,还用作工业原料。从海水中制取镁、钾、溴及其化工产品,是在传统制盐工业上的发展。
从海水中获得其他物质和能量具有广阔的前景。例如,铀和重水目前是核能开发中的重要原料。化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能等也是越来越受到重视和开发的新型能源。
煮
海
为
盐
1、从海水中提取NaCl
粗盐中的杂质:
除杂试剂:
①Na2CO3 ②NaOH ③BaCl2
试剂加入顺序:
②③①
③②①
③①②
试剂加入顺序基本原则:
泥沙、Ca2+、Mg2+、SO42-
先加BaCl2,后加Na2CO3
粗盐的提纯:
2、海水中提取溴的实验方法
(1)用蒸馏法将海水浓缩。用硫酸将浓缩的海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。
(3)向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内。
(4)向吸收塔中溶液内通入适量的氯气。
(5)用CCl4萃取吸收塔中溶液里的溴单质。
主要流程:
海水
浓缩
酸化
浓缩海水Br-
通入
氯气
海水Cl-Br2
通入空气
水蒸气(吹入)
吸收塔SO2
反应后
富集溴
HBr、SO42-
通入Cl2
Cl-Br2
分离
溴单质
化学方程式:
2NaBr + Cl2 === Br2 +2NaCl
Br2 + SO2 + 2H2O === 2HBr + H2SO4
2HBr + Cl2 === Br2 + 2HCl
加碘食盐
缺碘导致大脖子病
海带
海带灰
灼烧
溶解过滤
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
3、海带中提取碘的实验方法
主要流程:
反应离子方程式:2I- + 2H+ +H2O2 I2+2H2O
1、水资源非常重要,联合国确定2003年为国际淡水年,以下关于水的说法错误的是( )
A、蒸馏法是海水淡化的方法之一;
B、淡水的密度小于海水的密度;
C、融化的雪水中矿物质含量比深井水中的少;
D、0℃以上,温度越高,水的密度越小。
D
随堂训练
2、下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是( )
A、碘水 B、溴水
C、氯化钾溶液 D、氯气
A、I2+2KBr=2KI+Br2
3、下列化学方程式正确的是( )
D、Br2+2KI=2KBr+I2
C、I2+2KCl=2KI+Cl2
C
D
B、Br2+2KCl=2KBr+Cl2
4、医生建议因缺少某种元素而患甲状腺肿大的病人多食海带,这是由于海带中含有较丰富的( )
A、碘元素 B、铁元素
C、钾元素 D、锌元素
A
5、一位海上遇难的水手,随着木排在海上漂流。他用完了淡水,感到异常口渴,但他不喝海水,因为他知道海水会致命,主要原因是( )
A、海水有苦涩味,根本喝不下去;
B、海水中含有多种盐,能使肠胃腐烂致人死亡;
C、海水中有许多微生物,有些微生物能致人死亡;
D、海水会造成人体水分从血液和组织内脱离出来,进入肠胃中,使人脱水死亡。
D
6、海水中含有MgCl2,从海水中提取Mg,最适宜的方法是( )
A、海水 Mg(OH)2 Mg
B、海水 MgCl2溶液 MgCl2(熔融) Mg
C、海水 Mg(OH)2 MgO Mg
D、海水 Mg(OH)2 MgCl2溶液 MgCl2(熔融) Mg
NaOH
电解
电解
HCl
电解
石灰乳
灼烧
石灰乳
HCl
电解
D
物质 氧化镁(MgO) 氯化镁(MgCl2)
熔点 2825℃ 714℃
证明海带中含有碘,有以下步骤
7、在检验海带中碘元素的实验中,有以下步骤:①灼烧海带至完全生成灰,停止加热,冷却;②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;③用剪刀剪碎海带,用酒精润湿,放入坩埚中; ④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤.
(1)合理的步骤是____________ ,
(2)证明含碘的步骤是_______ ,
现象是_____________________ ,
反应的离子方程式是 __________________________ 。
③①④②
②
滴入淀粉溶液,溶液变蓝
2I- + 2H+ +H2O2 I2+2H2O
同课章节目录
- 第一章 环境与环境问题
- 第一节 环境概述
- 第二节 环境问题概述
- 第三节 人类与环境
- 第二章 自然资源保护
- 第一节 自然资源与主要的资源问题
- 第二节 非可再生资源的利用与保护--以能源矿产(石油、煤炭)为例
- 第三节 可再生资源的利用与保护-以土地资源为例
- 第三章 生态环境保护
- 第一节 生态系统与生态平衡
- 第二节 主要的生态环境问题
- 第三节 生态环境保护
- 第四章 环境污染及其防治
- 第一节 水污染及其防治
- 第二节 大气污染及其防治
- 第三节 固体废弃物污染及其防治
- 第四节 噪声污染及其防治
- 第五章 环境管理
- 第一节 环境管理概述
- 第二节 中国环境管理政策体系
- 第三节 中国环境法规体系
- 第四节 环境保护任重道远
