人教版高中化学选修五 第4章生命中的基础有机化学物质章末复习(共37张PPT)
文档属性
| 名称 | 人教版高中化学选修五 第4章生命中的基础有机化学物质章末复习(共37张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-24 00:00:00 | ||
图片预览








文档简介
(共37张PPT)
生命中的基础有机化学物质
章末复习
人教版
选修5
第四章
1.
知道油脂的概念和存在。
2.
掌握油脂的结构特点和化学性质。
3.了解肥皂的去污原理及合成洗涤剂。
学习重点:油脂的化学性质。
第一节:
油脂
酯
碳碳双键
【随堂训练】
1.判断正误:
(1)单甘油酯一定是纯净物,混甘油酯一定是混合物。
(2)天然油脂没有固定的熔沸点
(3)油脂都不能使溴水褪色
(4)食用油属于酯类,石蜡油属于烃类
(5)精制的色拉油是纯净物
(错)
(对)
(错)
(对)
(错)
2、下列各组中属于同系物的是(
)
A.乙二醇、丙三醇
B.油酸、丙烯酸
C.硬脂酸、软脂酸
D.甲酸乙酯、硬脂酸甘油酯
BC
1.
知道糖类的组成和分类。
2.
掌握糖类的结构特点和化学性质。
3.知道糖类的互相转化。
学习重点:糖类的化学性质。
第二节:
糖类
糖类
注意:糖类也可以相互转化
练一练:
1、下列物质具有相同的最简式的组是(
)
A、乙醛
葡萄糖
B、乙酸
乙醛
C、乙醇
葡萄糖
D、甲酸甲酯
葡萄糖
2、葡萄糖所不具有的性质是(
)
A、和H2发生加成反应
B、和银氨溶液发生氧化反应
C、和酸发生酯化反应
D、和NaOH溶液反应
D
D
3、向淀粉中加入少量稀硫酸,并加热使之发生水解,为测定水解程度所需下列试剂是:①氢氧化钠溶液
②银氨溶液
③新制氢氧化铜
④碘水
⑤氯化钡溶液
A、①⑤
B、②④
C、①③④
D、②③④
4、下列各有机物中不含有醇羟基的是
A、苯甲酸
B、纤维素
C、淀粉
D、葡萄糖
√
√
1.
知道蛋白质的结构与性质。
2.
掌握氨基酸的结构特点和化学性质。
3.知道常见的几种氨基酸。
学习重点:蛋白质和氨基酸的化学性质。
第三节:蛋白质和核酸
定义
分类:几种常见氨基酸
物理性质
化学性质
氨基酸的两性:羧基显酸性
氨基显碱性
成肽反应:肽键
【课堂练习】
1、下列过程中,不可逆的是(
)
A.蛋白质的盐析
B.酯的水解
C.蛋白质的变性
D.氯化铁的水解
2、欲将蛋白质从水中析出而又不改变它的性
质应加入(
)
A.甲醛溶液
B.CuSO4溶液
C.饱和Na2SO4溶液
D.浓硫酸
C
C
3、下图表示蛋白质分子结构的一部分,图中A、B、C、D标出了分子中不同的键,当蛋白质发生水解时,断裂的键是(
)
C
4、为鉴别某白色纺织品的成分是蚕丝还是“人造丝”,可选用的方法是(
)
A、滴加浓硝酸
B、滴加浓硫酸
C、滴加酒精
D、灼烧
AD
5、误食重金属盐会使人中毒,可以
用以解毒急救的措施是(
)
A、服大量食盐水
B、服葡萄糖水
C、服鸡蛋清
D、服新鲜牛奶
CD
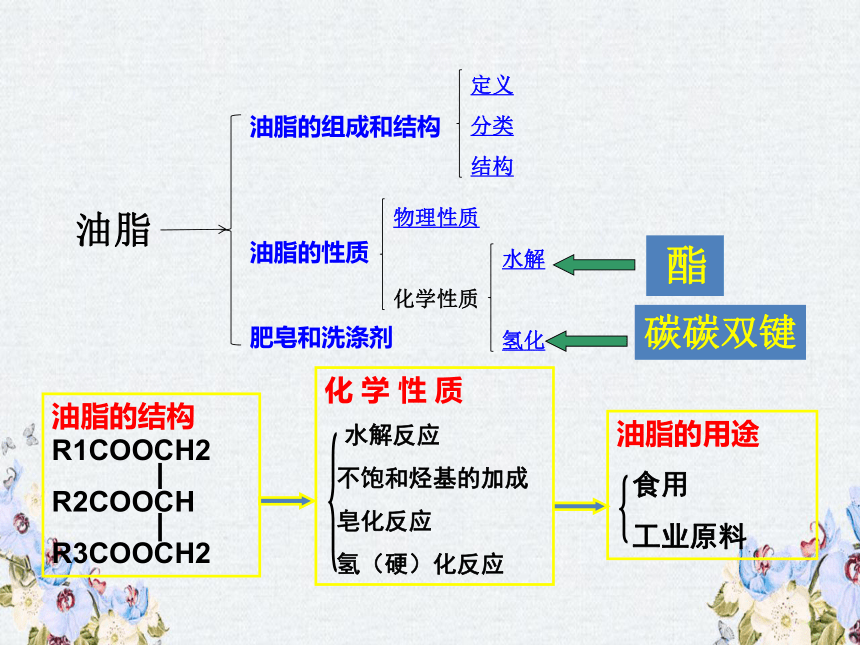
一、油脂的组成和结构:
油脂是由多种高级脂肪酸如硬脂酸、软脂酸或油酸等跟甘油生成的甘油酯。
1.定义:
脂和酯的区别:
甘油
高级脂肪酸
任何醇
羧酸或无机含氧酸
2.油脂的分类:
油(植物)——常温呈液态(花生油、豆油、芝麻油)
脂肪(动物)——常温呈固态(猪油、牛油、羊油)
思考:油脂与用来作燃料的汽油、柴油等矿物油是不是同类有机物?
烃
不是!油脂属于酯类,汽油、柴油属于
。
3.
油脂的结构
(1)R1、R2、R3可以代表饱和烃基或不饱和烃基。
(2)如果R1、R2、R3相同,这样的油脂称为简单甘油酯;如果R1、R2、R3不相同,称为混合甘油酯。
(3)天然油脂大都为混合甘油酯,且动、植物体内的油脂大都为多种混合甘油酯的混合物,无固定熔沸点。
一、油脂的结构和性质
1.油脂从结构上分析属于______类物质,分为:
①单甘油酯:所含烃基______的高级脂肪酸的甘油酯;
②混甘油酯:所含烃基______的高级脂肪酸的甘油酯;
2.由常温下的状态,油脂分为
①油:常温下______态;
②脂:常温下______态;
在油脂中,不饱和烃基含量越______,其熔点越低。
酯
相同
不同
液
固
低
1、油脂的水解反应
完成油脂在酸性条件水解的方程式:
(二)油脂的化学性质
(硬脂酸甘油酯
)
(
硬脂酸
)
(甘油)
2、与H2加成—油脂的氢化
油脂的硬化
硬化油的特性:
(1)油脂氢化得到的硬化油,就是人造脂肪,也叫硬化油;
(2)硬化油性质稳定,不易变质;
(3)硬化油便于运输;
(4)用于制肥皂、脂肪酸、甘油、人造奶油等的原料。
(油)
(脂肪)
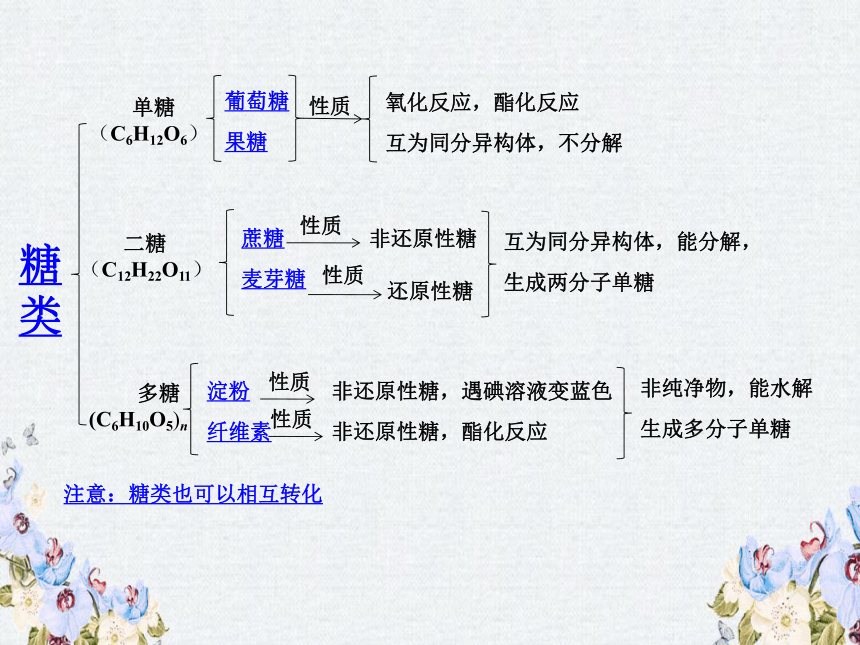
糖类
1、糖类具有怎样的特征?
2、糖类如何分类?结构及其性质:
单糖(不能水解成更简单的糖)
二糖(1mol水解产生2mol单糖)
多糖(1mol水解产生多摩单糖)
-葡萄糖、果糖
-麦芽糖、蔗糖
-淀粉、纤维素
——多羟基醛或多羟基酮,或者它们的脱水缩合物。
第二节
糖类
1.葡萄糖
C6H12O6
HOCH2—(CHOH)4—CHO
—OH、—CHO
白色晶体,有甜味,能溶于水
制镜业、糖果制造业、医药工业
葡
萄
糖
分子式
结构简式
官能团
物理性质
化学性质
加成(与H2)
氧化(与银氨溶液)
氧化[与Cu(OH)2]
酯化(与羧酸)
主要用途
2.蔗糖、麦芽糖
蔗糖
麦芽糖
分子式
C12H22O11
C12H22O11
物理性质
无色晶体、溶于水、有甜味
白色晶体,易溶于水,有甜味
是否含醛基
无
有
水解反应
方程式
C12H22O11+H2O
C6H12O6+C6H12O6
葡萄糖 果糖
C12H22O11+H2O
2C6H12O6
葡萄糖
主要来源
甘蔗、甜菜
农产品(大米、玉米)
二者关系
分子式相同,结构不同(或同分异构体)
3.淀粉、纤维素
淀 粉
纤维素
物理性质
不溶于冷水,白色粉末
白色无嗅无味物质,不溶于水,不溶于一般的有机溶剂
主要化学
性质
遇I2显蓝色
在酸性条件下水解,方程式:
(C6H10O5)n+
nH2O
nC6H12O6
葡萄糖
在酸性条件下水解,方程式:
(C6H10O5)n+n(H2O)
nC6H12O6
葡萄糖
存在与
制法
植物的种子、块茎和根里
木材、棉花
用途
食物、制葡萄糖、酒精
制硝酸纤维、纤维素乙酸酯、造纸、粘胶纤维
小结:糖类的相互转化
(C6H10O5)n
C6H12O6
缩合
C12H22O11
水解
发酵
C2H5OH
+
CO2
氧化
CO2
+
H2O
光合
缩合
水解
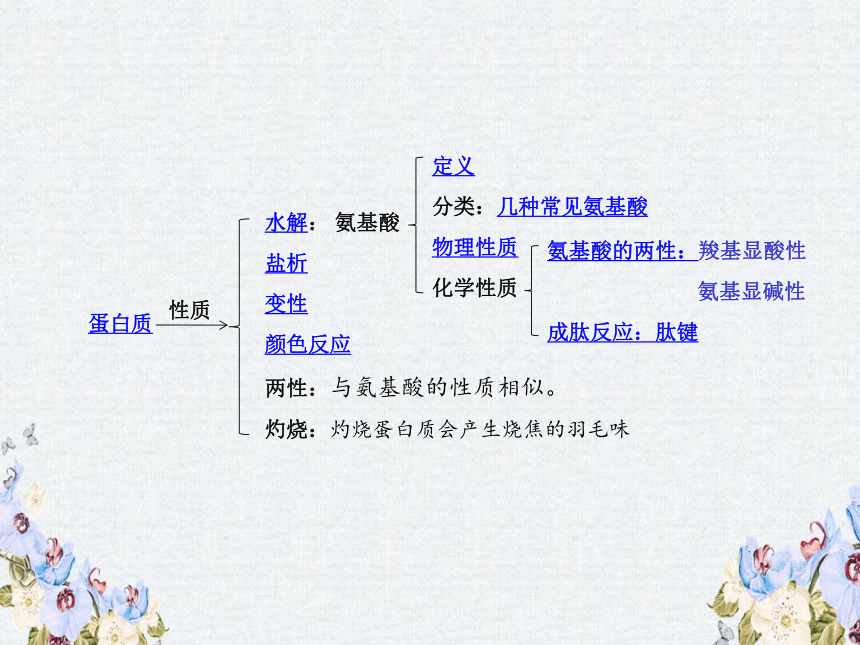
一、氨基酸的结构与性质:
羧酸分子中的烃基上的氢原子被-NH2(氨基)取代所得的一类化合物。
可分为α-氨基酸、β-氨基酸、…等;组成天然蛋白质的都是α-氨基酸。
定义:
分类:
α-氨基酸结构:
氨基
羧基
几种常见的氨基酸:
(1)
甘氨酸
(2)
丙氨酸(α-氨基丙酸)
(4)
谷氨酸(α-氨基戊二酸)
(3)
苯丙氨酸(α-氨基苯丙酸)
+
HCl
+
NaOH
+
H2O
天然氨基酸是无色晶体,熔点较高,在200~300℃时熔化分解,一般能溶于水,而难溶于乙醇、乙醚……
物理性质:
化学性质:
1、氨基酸的两性
(羧基显酸性,氨基显碱性)
2、成肽反应:
+
H2O
+
肽键
两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基与另一分子的羧基间脱去一分子水,缩合形成含有肽键的化合物,成为成肽反应。
多种氨基酸分子按不同的排列顺序以肽键相互结合,可以形成千百万种具有不同的理化性质和生理活性的多肽链。相对分子量在10
000以上的,并具有一定空间结构的多肽,称为蛋白质。
蛋白质的形成:
二、蛋白质的结构和性质
组成元素:
组成基本结构单元:
相对分子质量:
蛋白质
人体内所具有的蛋白质种类达到了10万种以上。
C、H、O、N、S
(P)等
氨基酸
几万----几千万
溶解性:有些可溶,有些难溶。如鸡蛋清
能溶解在水里形成胶体溶液。
蛋白质的性质
水解:水解生成氨基酸。
向蛋白质溶液中加入(NH4)2SO4溶液时,会使
蛋白质从溶液沉淀出来,加水后沉淀又溶解。
盐析的应用
盐析
向蛋白质溶液中加入某些浓的无机盐溶液后,
可使蛋白质凝聚而从溶液中析出。
(可逆的物理变化)
采用多次盐析的方法可以分离或提纯蛋白质
归纳总结
在某些物理因素或化学因素的影响下,蛋白质的理化性质和生理功能发生改变的现象。
归纳总结
蛋白质变性:
(不可逆化学变化)
变性因素
物理因素:
化学因素:
加热、加压、搅拌、
紫外线照射、超声波等。
强酸、强碱、重金属盐、三氯乙酸、乙醇、醛、丙酮等。
含有苯基的蛋白质均能发生这个反应。如皮肤,指甲等。
归纳总结
鸡蛋白溶液遇浓硝酸加热颜色变黄
颜色反应
再
见
生命中的基础有机化学物质
章末复习
人教版
选修5
第四章
1.
知道油脂的概念和存在。
2.
掌握油脂的结构特点和化学性质。
3.了解肥皂的去污原理及合成洗涤剂。
学习重点:油脂的化学性质。
第一节:
油脂
酯
碳碳双键
【随堂训练】
1.判断正误:
(1)单甘油酯一定是纯净物,混甘油酯一定是混合物。
(2)天然油脂没有固定的熔沸点
(3)油脂都不能使溴水褪色
(4)食用油属于酯类,石蜡油属于烃类
(5)精制的色拉油是纯净物
(错)
(对)
(错)
(对)
(错)
2、下列各组中属于同系物的是(
)
A.乙二醇、丙三醇
B.油酸、丙烯酸
C.硬脂酸、软脂酸
D.甲酸乙酯、硬脂酸甘油酯
BC
1.
知道糖类的组成和分类。
2.
掌握糖类的结构特点和化学性质。
3.知道糖类的互相转化。
学习重点:糖类的化学性质。
第二节:
糖类
糖类
注意:糖类也可以相互转化
练一练:
1、下列物质具有相同的最简式的组是(
)
A、乙醛
葡萄糖
B、乙酸
乙醛
C、乙醇
葡萄糖
D、甲酸甲酯
葡萄糖
2、葡萄糖所不具有的性质是(
)
A、和H2发生加成反应
B、和银氨溶液发生氧化反应
C、和酸发生酯化反应
D、和NaOH溶液反应
D
D
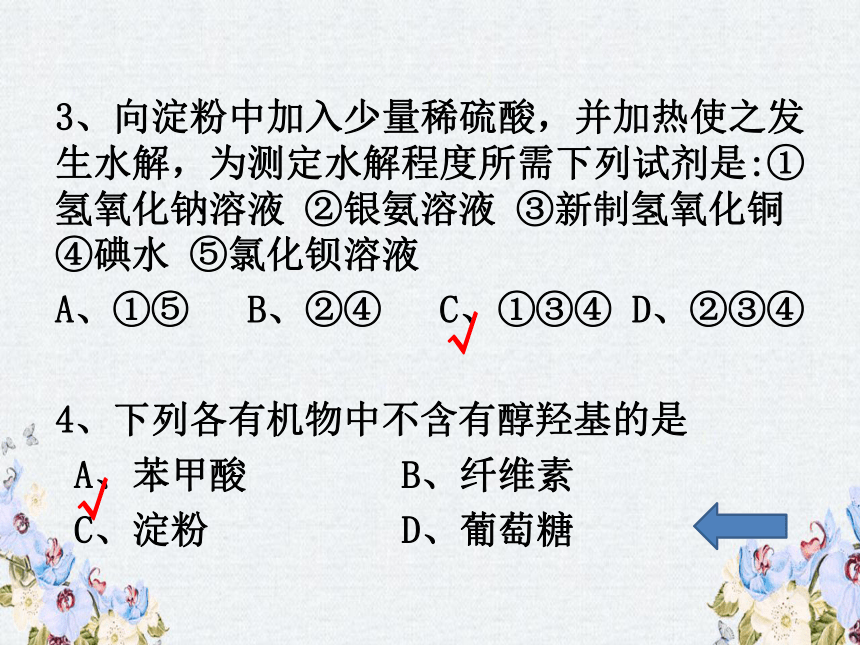
3、向淀粉中加入少量稀硫酸,并加热使之发生水解,为测定水解程度所需下列试剂是:①氢氧化钠溶液
②银氨溶液
③新制氢氧化铜
④碘水
⑤氯化钡溶液
A、①⑤
B、②④
C、①③④
D、②③④
4、下列各有机物中不含有醇羟基的是
A、苯甲酸
B、纤维素
C、淀粉
D、葡萄糖
√
√
1.
知道蛋白质的结构与性质。
2.
掌握氨基酸的结构特点和化学性质。
3.知道常见的几种氨基酸。
学习重点:蛋白质和氨基酸的化学性质。
第三节:蛋白质和核酸
定义
分类:几种常见氨基酸
物理性质
化学性质
氨基酸的两性:羧基显酸性
氨基显碱性
成肽反应:肽键
【课堂练习】
1、下列过程中,不可逆的是(
)
A.蛋白质的盐析
B.酯的水解
C.蛋白质的变性
D.氯化铁的水解
2、欲将蛋白质从水中析出而又不改变它的性
质应加入(
)
A.甲醛溶液
B.CuSO4溶液
C.饱和Na2SO4溶液
D.浓硫酸
C
C
3、下图表示蛋白质分子结构的一部分,图中A、B、C、D标出了分子中不同的键,当蛋白质发生水解时,断裂的键是(
)
C
4、为鉴别某白色纺织品的成分是蚕丝还是“人造丝”,可选用的方法是(
)
A、滴加浓硝酸
B、滴加浓硫酸
C、滴加酒精
D、灼烧
AD
5、误食重金属盐会使人中毒,可以
用以解毒急救的措施是(
)
A、服大量食盐水
B、服葡萄糖水
C、服鸡蛋清
D、服新鲜牛奶
CD
一、油脂的组成和结构:
油脂是由多种高级脂肪酸如硬脂酸、软脂酸或油酸等跟甘油生成的甘油酯。
1.定义:
脂和酯的区别:
甘油
高级脂肪酸
任何醇
羧酸或无机含氧酸
2.油脂的分类:
油(植物)——常温呈液态(花生油、豆油、芝麻油)
脂肪(动物)——常温呈固态(猪油、牛油、羊油)
思考:油脂与用来作燃料的汽油、柴油等矿物油是不是同类有机物?
烃
不是!油脂属于酯类,汽油、柴油属于
。
3.
油脂的结构
(1)R1、R2、R3可以代表饱和烃基或不饱和烃基。
(2)如果R1、R2、R3相同,这样的油脂称为简单甘油酯;如果R1、R2、R3不相同,称为混合甘油酯。
(3)天然油脂大都为混合甘油酯,且动、植物体内的油脂大都为多种混合甘油酯的混合物,无固定熔沸点。
一、油脂的结构和性质
1.油脂从结构上分析属于______类物质,分为:
①单甘油酯:所含烃基______的高级脂肪酸的甘油酯;
②混甘油酯:所含烃基______的高级脂肪酸的甘油酯;
2.由常温下的状态,油脂分为
①油:常温下______态;
②脂:常温下______态;
在油脂中,不饱和烃基含量越______,其熔点越低。
酯
相同
不同
液
固
低
1、油脂的水解反应
完成油脂在酸性条件水解的方程式:
(二)油脂的化学性质
(硬脂酸甘油酯
)
(
硬脂酸
)
(甘油)
2、与H2加成—油脂的氢化
油脂的硬化
硬化油的特性:
(1)油脂氢化得到的硬化油,就是人造脂肪,也叫硬化油;
(2)硬化油性质稳定,不易变质;
(3)硬化油便于运输;
(4)用于制肥皂、脂肪酸、甘油、人造奶油等的原料。
(油)
(脂肪)
糖类
1、糖类具有怎样的特征?
2、糖类如何分类?结构及其性质:
单糖(不能水解成更简单的糖)
二糖(1mol水解产生2mol单糖)
多糖(1mol水解产生多摩单糖)
-葡萄糖、果糖
-麦芽糖、蔗糖
-淀粉、纤维素
——多羟基醛或多羟基酮,或者它们的脱水缩合物。
第二节
糖类
1.葡萄糖
C6H12O6
HOCH2—(CHOH)4—CHO
—OH、—CHO
白色晶体,有甜味,能溶于水
制镜业、糖果制造业、医药工业
葡
萄
糖
分子式
结构简式
官能团
物理性质
化学性质
加成(与H2)
氧化(与银氨溶液)
氧化[与Cu(OH)2]
酯化(与羧酸)
主要用途
2.蔗糖、麦芽糖
蔗糖
麦芽糖
分子式
C12H22O11
C12H22O11
物理性质
无色晶体、溶于水、有甜味
白色晶体,易溶于水,有甜味
是否含醛基
无
有
水解反应
方程式
C12H22O11+H2O
C6H12O6+C6H12O6
葡萄糖 果糖
C12H22O11+H2O
2C6H12O6
葡萄糖
主要来源
甘蔗、甜菜
农产品(大米、玉米)
二者关系
分子式相同,结构不同(或同分异构体)
3.淀粉、纤维素
淀 粉
纤维素
物理性质
不溶于冷水,白色粉末
白色无嗅无味物质,不溶于水,不溶于一般的有机溶剂
主要化学
性质
遇I2显蓝色
在酸性条件下水解,方程式:
(C6H10O5)n+
nH2O
nC6H12O6
葡萄糖
在酸性条件下水解,方程式:
(C6H10O5)n+n(H2O)
nC6H12O6
葡萄糖
存在与
制法
植物的种子、块茎和根里
木材、棉花
用途
食物、制葡萄糖、酒精
制硝酸纤维、纤维素乙酸酯、造纸、粘胶纤维
小结:糖类的相互转化
(C6H10O5)n
C6H12O6
缩合
C12H22O11
水解
发酵
C2H5OH
+
CO2
氧化
CO2
+
H2O
光合
缩合
水解
一、氨基酸的结构与性质:
羧酸分子中的烃基上的氢原子被-NH2(氨基)取代所得的一类化合物。
可分为α-氨基酸、β-氨基酸、…等;组成天然蛋白质的都是α-氨基酸。
定义:
分类:
α-氨基酸结构:
氨基
羧基
几种常见的氨基酸:
(1)
甘氨酸
(2)
丙氨酸(α-氨基丙酸)
(4)
谷氨酸(α-氨基戊二酸)
(3)
苯丙氨酸(α-氨基苯丙酸)
+
HCl
+
NaOH
+
H2O
天然氨基酸是无色晶体,熔点较高,在200~300℃时熔化分解,一般能溶于水,而难溶于乙醇、乙醚……
物理性质:
化学性质:
1、氨基酸的两性
(羧基显酸性,氨基显碱性)
2、成肽反应:
+
H2O
+
肽键
两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基与另一分子的羧基间脱去一分子水,缩合形成含有肽键的化合物,成为成肽反应。
多种氨基酸分子按不同的排列顺序以肽键相互结合,可以形成千百万种具有不同的理化性质和生理活性的多肽链。相对分子量在10
000以上的,并具有一定空间结构的多肽,称为蛋白质。
蛋白质的形成:
二、蛋白质的结构和性质
组成元素:
组成基本结构单元:
相对分子质量:
蛋白质
人体内所具有的蛋白质种类达到了10万种以上。
C、H、O、N、S
(P)等
氨基酸
几万----几千万
溶解性:有些可溶,有些难溶。如鸡蛋清
能溶解在水里形成胶体溶液。
蛋白质的性质
水解:水解生成氨基酸。
向蛋白质溶液中加入(NH4)2SO4溶液时,会使
蛋白质从溶液沉淀出来,加水后沉淀又溶解。
盐析的应用
盐析
向蛋白质溶液中加入某些浓的无机盐溶液后,
可使蛋白质凝聚而从溶液中析出。
(可逆的物理变化)
采用多次盐析的方法可以分离或提纯蛋白质
归纳总结
在某些物理因素或化学因素的影响下,蛋白质的理化性质和生理功能发生改变的现象。
归纳总结
蛋白质变性:
(不可逆化学变化)
变性因素
物理因素:
化学因素:
加热、加压、搅拌、
紫外线照射、超声波等。
强酸、强碱、重金属盐、三氯乙酸、乙醇、醛、丙酮等。
含有苯基的蛋白质均能发生这个反应。如皮肤,指甲等。
归纳总结
鸡蛋白溶液遇浓硝酸加热颜色变黄
颜色反应
再
见
