人教版高二化学选修5第三章第三节 羧酸 酯 课件 (共34张PPT)
文档属性
| 名称 | 人教版高二化学选修5第三章第三节 羧酸 酯 课件 (共34张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-25 00:00:00 | ||
图片预览











文档简介
(共34张PPT)
第三节
羧酸
酯
为何在醋中加少量白酒,
醋的味道就会变得芳香而且不易变质?
厨师烧鱼时常加醋并加点酒,为何这样鱼味道就变得无腥、香醇,特别鲜美?
通过本节课的学习大家便会知道其中的奥妙。
1、概念:由烃基与羧基相连构成的有机化合物。
2、分类
一、羧酸:
脂肪酸
芳香酸
一元羧酸
二元羧酸
多元羧酸
CH3CH2COOH(丙酸)
C6H5-COOH(苯甲酸)
CH2=CH-COOH(丙烯酸)
HOOC-COOH(乙二酸)
(己三酸)
按烃基的种类
按羧基
的数目
CH2-COOH
CH-COOH
CH2-COOH
3、饱和一元羧酸通式:
CnH2n+1COOH
或CnH2nO2
4、羧酸的命名:
CH3COOH
CH3CHCH2CHCH2COOH
CH3
CH3
乙酸(醋酸)
3,5-二甲基己酸
CH3CH2COOH
丙酸
6
5
4
3
2
1
1、
物理性质
常温下为无色有强烈刺激性气味的液体
易溶于水、酒精
沸点:117.90C、熔点:16.60C
当温度低于熔点时,乙酸凝结成类似冰一样
的晶体,所以纯净的乙酸又称冰醋酸
二、乙酸(醋酸)
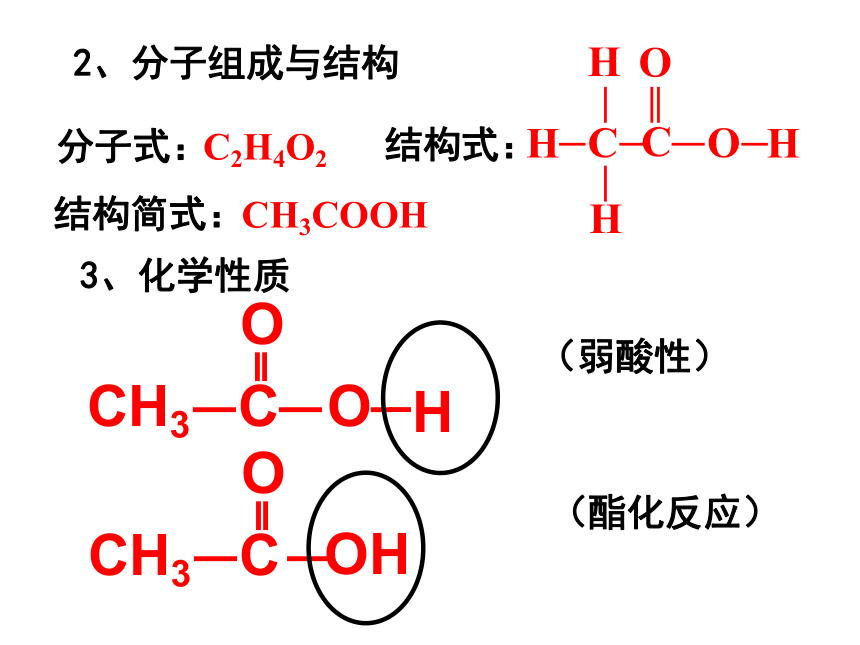
2、分子组成与结构
C2H4O2
CH3COOH
结构简式:
分子式:
结构式:
C
H
H
H
H
O
C
O
3、化学性质
O
CH3
C
O
H
(弱酸性)
OH
O
CH3
C
(酯化反应)
2CH3COOH
+
Na2CO3
=
2CH3COONa
+H2O+CO2↑
2CH3COOH
+
Mg
=
(CH3COO)2Mg+H2↑
CH3COOH
+
NaOH
=
CH3COONa+
H2O
E、与某些盐反应:
A、使紫色石蕊试液变红色
B、与活泼金属反应:
D、与碱反应:
C、与碱性氧化物反应:
2CH3COOH+Na2O=2CH3COONa+2H2O
(1)
弱酸性:乙酸是一种弱酸,其酸性比碳酸强
CH3COOH
CH3COO-+H+
科学探究
CH3COOH
A
B
C
D
E
F
G
H
I
J
NaHCO3溶液
苯酚钠溶液
Na2CO3
1、利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液的酸性强弱。
碳酸钠固体
乙酸溶液
苯酚钠溶液
Na2CO3+2CH3COOH
2CH3COONa+CO2↑+H2O
-ONa
+
CO2
+
H2O
-OH
+
NaHCO3
此装置有什么缺陷?如何改进?
1、化合物
跟足量的下列哪种物质的溶液反应可得到一钠盐C7H5O3Na(
)
COOH
OH
A
NaOH
B
Na2CO3
C
NaHCO3
D
NaCl
C
【巩固练习】
2.确定乙酸是弱酸的依据是(
)
A.乙酸可以和乙醇发生酯化反应
B.乙酸钠的水溶液显碱性
C.乙酸能使石蕊试液变红
D.Na2CO3中加入乙酸产生CO2
B
(2)乙酸的酯化反应
实验现象:饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。
饱和碳酸钠溶液
乙醇、乙酸、浓硫酸
酯化反应的本质:酸脱羟基、醇脱氢。
CH3COOH
+
H18OCH2
CH3
浓硫酸
△
+
H2O
CH3CO18OCH2
CH3
2、浓硫酸作催化剂,吸水剂
注意事项:
3、碎瓷片:防暴沸。
4、导管末端不能插入液面以下目的:防倒吸。
5、饱和碳酸钠溶液的作用:降低乙酸乙酯在水中的溶解度,中和乙酸,吸收乙醇。
6、分离:分液漏斗。
1、装药品顺序:乙醇→浓硫酸→冰醋酸。
饱和碳酸钠溶液
乙醇、乙酸、浓硫酸
为什么导管不插入饱和Na2CO3溶液中?有无其它防倒吸的方法?防止倒吸。
【知识迁移】写出下列酸和醇的酯化反应
C2H5O—NO2
+
H2O
CH3COOCH3
+
H2O
CH3COOH
+
HOCH3
浓H2SO4
C2H5OH
+
HO—NO2
浓H2SO4
硝酸乙酯
乙酸甲酯
足量
浓H2SO4
二乙酸乙二酯
HCOOH与CH3CH2OH的反应
【达标测试】
1.除去乙酸乙酯中含有的乙酸,最好的处理和操作是(
)
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量氢氧化钠溶液洗涤后分液
2.下列物质中,不能与乙醇发生酯化反应的是(
)
A.乙醛
B.硝酸 C.苯甲酸
D.硫酸
C
A
3、
酯化反应属于(
).
A.中和反应
B.不可逆反应
C.离子反应
D.取代反应
D
三、几种常见的有机酸
H—C—O—H
O
⑵有酸性
(3)有还原性(银镜反应,与新制Cu(OH)2反应)
⑴能发生酯化反应
甲酸的化学性质
?用一种试剂鉴别:乙醇、乙醛、乙酸、甲酸
结构特点:既有羧基又有醛基
甲酸(HCOOH)
俗称蚁酸
草酸C2H2O4
乳酸C3H6O3
COOH
COOH
O
CH3CH-C-OH
OH
四、酯
1、定义:饱和一元羧酸和饱和一元醇
生成的酯
2、物理性质
①低级酯是具有芳香气味的液体。
②密度比水小。
③难溶于水,易溶于乙醇和乙醚等
有机溶剂。可作溶剂。
3、存在:酯类广泛存在于自然界
自然界中的有机酯
资料卡片
丁酸乙酯
戊酸戊酯
乙酸异戊酯
生活中的有机酯
资料卡片
生活中的有机酯
资料卡片
官能团:
4、通式:
R—C—O—R’
O
—C—O—
O
酯基
5、饱和一元羧酸酯的通式:
CnH2nO2(n≥2)
RCOOR
’
或
6、酯的命名:
“某酸某酯”
HCOOCH3
CH3COOCH3
CH3CH2COOC2H5
甲酸甲酯
乙酸甲酯
丙酸乙酯
7、化学性质
CH3COOC2H5+H2O
CH3COOH+
C2H5OH
酸加羟基醇加氢
水解反应
H2SO4
CH3COOC2H5+NaOH
CH3COONa+
C2H5OH
△
△
1.
1mol有机物
与足量NaOH
溶
液充分反应,消耗NaOH
的物质的量为(
)
A.5mol
B.4mol
C.3mol
D.2mol
COOCH3
CH3COO
COOH
B
小结:几种衍生物之间的关系
祝同学们学习进步!
再
见
酸和醇酯化反应的类型
①一元有机羧酸与一元醇。如:
CH3COOCH3
+
H2O
CH3COOH
+
HOCH3
浓H2SO4
乙酸甲酯
②一元酸与二元醇或多元醇。如:
二乙酸乙二酯
浓H2SO4
2
③一元醇与多元羧酸分子间脱水形成酯
+2
C2H5OH
COOH
COOH
浓H2SO4
COOC2H5
COOC2H5
+2H2O
④.多元羧酸与多元醇之间的脱水反应
生成普通酯:
COOH
COOH
CH2OH
CH2OH
+
浓H2SO4
+
H2O
HOOC-COOCH2CH2OH
生成环酯:
生成高聚酯:
+
n
HOOC
COOH
n
HOCH2CH2OH
一定条件
C
C
O
CH2CH2
O
n
+
2n
H2O
O
O
浓H2SO4
+
2H2O
环乙二酸乙二酯
三种情况:生成普通酯、环状酯、髙聚酯
⑤.羟基酸自身的酯化反应
CH3CHCOOH
OH
2
浓H2SO4
CH3CHCOOCHCOOH
OH
CH3
+H2O
普通酯
CH3CHCOOH
OH
2
浓H2SO4
CH3-CH
COO
OOC
CH-CH3
+H2O
环状酯
乳酸
生成高聚酯:
一定条件
CH3
【OCHCO】n+nH2O
n
HOCHCOOH
CH3
多元羧酸与二元醇间缩聚成聚酯。如:
⑥羟基酸分子内脱水成环。如:
CH2COOH
CH2CH2OH
浓硫酸
△
O
CH2C
CH2CH2
=
O
+
H2O
+
n
HOOC
COOH
n
HOCH2CH2OH
一定条件
聚对苯二甲酸乙二酯
C
C
O
CH2CH2
O
n
+
2n
H2O
O
O
缩聚反应:
有机物分子间脱去小分子,形成高分子聚合物的反应。
祝同学们学习进步!
再
见
第三节
羧酸
酯
为何在醋中加少量白酒,
醋的味道就会变得芳香而且不易变质?
厨师烧鱼时常加醋并加点酒,为何这样鱼味道就变得无腥、香醇,特别鲜美?
通过本节课的学习大家便会知道其中的奥妙。
1、概念:由烃基与羧基相连构成的有机化合物。
2、分类
一、羧酸:
脂肪酸
芳香酸
一元羧酸
二元羧酸
多元羧酸
CH3CH2COOH(丙酸)
C6H5-COOH(苯甲酸)
CH2=CH-COOH(丙烯酸)
HOOC-COOH(乙二酸)
(己三酸)
按烃基的种类
按羧基
的数目
CH2-COOH
CH-COOH
CH2-COOH
3、饱和一元羧酸通式:
CnH2n+1COOH
或CnH2nO2
4、羧酸的命名:
CH3COOH
CH3CHCH2CHCH2COOH
CH3
CH3
乙酸(醋酸)
3,5-二甲基己酸
CH3CH2COOH
丙酸
6
5
4
3
2
1
1、
物理性质
常温下为无色有强烈刺激性气味的液体
易溶于水、酒精
沸点:117.90C、熔点:16.60C
当温度低于熔点时,乙酸凝结成类似冰一样
的晶体,所以纯净的乙酸又称冰醋酸
二、乙酸(醋酸)
2、分子组成与结构
C2H4O2
CH3COOH
结构简式:
分子式:
结构式:
C
H
H
H
H
O
C
O
3、化学性质
O
CH3
C
O
H
(弱酸性)
OH
O
CH3
C
(酯化反应)
2CH3COOH
+
Na2CO3
=
2CH3COONa
+H2O+CO2↑
2CH3COOH
+
Mg
=
(CH3COO)2Mg+H2↑
CH3COOH
+
NaOH
=
CH3COONa+
H2O
E、与某些盐反应:
A、使紫色石蕊试液变红色
B、与活泼金属反应:
D、与碱反应:
C、与碱性氧化物反应:
2CH3COOH+Na2O=2CH3COONa+2H2O
(1)
弱酸性:乙酸是一种弱酸,其酸性比碳酸强
CH3COOH
CH3COO-+H+
科学探究
CH3COOH
A
B
C
D
E
F
G
H
I
J
NaHCO3溶液
苯酚钠溶液
Na2CO3
1、利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液的酸性强弱。
碳酸钠固体
乙酸溶液
苯酚钠溶液
Na2CO3+2CH3COOH
2CH3COONa+CO2↑+H2O
-ONa
+
CO2
+
H2O
-OH
+
NaHCO3
此装置有什么缺陷?如何改进?
1、化合物
跟足量的下列哪种物质的溶液反应可得到一钠盐C7H5O3Na(
)
COOH
OH
A
NaOH
B
Na2CO3
C
NaHCO3
D
NaCl
C
【巩固练习】
2.确定乙酸是弱酸的依据是(
)
A.乙酸可以和乙醇发生酯化反应
B.乙酸钠的水溶液显碱性
C.乙酸能使石蕊试液变红
D.Na2CO3中加入乙酸产生CO2
B
(2)乙酸的酯化反应
实验现象:饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。
饱和碳酸钠溶液
乙醇、乙酸、浓硫酸
酯化反应的本质:酸脱羟基、醇脱氢。
CH3COOH
+
H18OCH2
CH3
浓硫酸
△
+
H2O
CH3CO18OCH2
CH3
2、浓硫酸作催化剂,吸水剂
注意事项:
3、碎瓷片:防暴沸。
4、导管末端不能插入液面以下目的:防倒吸。
5、饱和碳酸钠溶液的作用:降低乙酸乙酯在水中的溶解度,中和乙酸,吸收乙醇。
6、分离:分液漏斗。
1、装药品顺序:乙醇→浓硫酸→冰醋酸。
饱和碳酸钠溶液
乙醇、乙酸、浓硫酸
为什么导管不插入饱和Na2CO3溶液中?有无其它防倒吸的方法?防止倒吸。
【知识迁移】写出下列酸和醇的酯化反应
C2H5O—NO2
+
H2O
CH3COOCH3
+
H2O
CH3COOH
+
HOCH3
浓H2SO4
C2H5OH
+
HO—NO2
浓H2SO4
硝酸乙酯
乙酸甲酯
足量
浓H2SO4
二乙酸乙二酯
HCOOH与CH3CH2OH的反应
【达标测试】
1.除去乙酸乙酯中含有的乙酸,最好的处理和操作是(
)
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量氢氧化钠溶液洗涤后分液
2.下列物质中,不能与乙醇发生酯化反应的是(
)
A.乙醛
B.硝酸 C.苯甲酸
D.硫酸
C
A
3、
酯化反应属于(
).
A.中和反应
B.不可逆反应
C.离子反应
D.取代反应
D
三、几种常见的有机酸
H—C—O—H
O
⑵有酸性
(3)有还原性(银镜反应,与新制Cu(OH)2反应)
⑴能发生酯化反应
甲酸的化学性质
?用一种试剂鉴别:乙醇、乙醛、乙酸、甲酸
结构特点:既有羧基又有醛基
甲酸(HCOOH)
俗称蚁酸
草酸C2H2O4
乳酸C3H6O3
COOH
COOH
O
CH3CH-C-OH
OH
四、酯
1、定义:饱和一元羧酸和饱和一元醇
生成的酯
2、物理性质
①低级酯是具有芳香气味的液体。
②密度比水小。
③难溶于水,易溶于乙醇和乙醚等
有机溶剂。可作溶剂。
3、存在:酯类广泛存在于自然界
自然界中的有机酯
资料卡片
丁酸乙酯
戊酸戊酯
乙酸异戊酯
生活中的有机酯
资料卡片
生活中的有机酯
资料卡片
官能团:
4、通式:
R—C—O—R’
O
—C—O—
O
酯基
5、饱和一元羧酸酯的通式:
CnH2nO2(n≥2)
RCOOR
’
或
6、酯的命名:
“某酸某酯”
HCOOCH3
CH3COOCH3
CH3CH2COOC2H5
甲酸甲酯
乙酸甲酯
丙酸乙酯
7、化学性质
CH3COOC2H5+H2O
CH3COOH+
C2H5OH
酸加羟基醇加氢
水解反应
H2SO4
CH3COOC2H5+NaOH
CH3COONa+
C2H5OH
△
△
1.
1mol有机物
与足量NaOH
溶
液充分反应,消耗NaOH
的物质的量为(
)
A.5mol
B.4mol
C.3mol
D.2mol
COOCH3
CH3COO
COOH
B
小结:几种衍生物之间的关系
祝同学们学习进步!
再
见
酸和醇酯化反应的类型
①一元有机羧酸与一元醇。如:
CH3COOCH3
+
H2O
CH3COOH
+
HOCH3
浓H2SO4
乙酸甲酯
②一元酸与二元醇或多元醇。如:
二乙酸乙二酯
浓H2SO4
2
③一元醇与多元羧酸分子间脱水形成酯
+2
C2H5OH
COOH
COOH
浓H2SO4
COOC2H5
COOC2H5
+2H2O
④.多元羧酸与多元醇之间的脱水反应
生成普通酯:
COOH
COOH
CH2OH
CH2OH
+
浓H2SO4
+
H2O
HOOC-COOCH2CH2OH
生成环酯:
生成高聚酯:
+
n
HOOC
COOH
n
HOCH2CH2OH
一定条件
C
C
O
CH2CH2
O
n
+
2n
H2O
O
O
浓H2SO4
+
2H2O
环乙二酸乙二酯
三种情况:生成普通酯、环状酯、髙聚酯
⑤.羟基酸自身的酯化反应
CH3CHCOOH
OH
2
浓H2SO4
CH3CHCOOCHCOOH
OH
CH3
+H2O
普通酯
CH3CHCOOH
OH
2
浓H2SO4
CH3-CH
COO
OOC
CH-CH3
+H2O
环状酯
乳酸
生成高聚酯:
一定条件
CH3
【OCHCO】n+nH2O
n
HOCHCOOH
CH3
多元羧酸与二元醇间缩聚成聚酯。如:
⑥羟基酸分子内脱水成环。如:
CH2COOH
CH2CH2OH
浓硫酸
△
O
CH2C
CH2CH2
=
O
+
H2O
+
n
HOOC
COOH
n
HOCH2CH2OH
一定条件
聚对苯二甲酸乙二酯
C
C
O
CH2CH2
O
n
+
2n
H2O
O
O
缩聚反应:
有机物分子间脱去小分子,形成高分子聚合物的反应。
祝同学们学习进步!
再
见
