高中化学鲁科版必修一第二章第3节 氧化剂和还原剂——探究铁及其化合物的氧化性和还原性 课件(21张PPT)
文档属性
| 名称 | 高中化学鲁科版必修一第二章第3节 氧化剂和还原剂——探究铁及其化合物的氧化性和还原性 课件(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-25 19:22:06 | ||
图片预览








文档简介
(共21张PPT)
第三节:
探究铁及其化合物的
氧化性和还原性
茶,是著名的世界三大饮料之一,被称为“东方饮料的皇帝
茶可以提神疗烦,解热止渴,消食除腻。
茶可以杀菌消炎,减肥健美,明目清心。
茶可以解烟醒酒,降压除脂,减轻癌变。
小实验:变色茶
自然界中的铁单质
新疆陨铁
南极洲陨铁
含铁元素的矿物
黄铁矿
磁铁矿
赤铁矿
(主要成分为FeS2)
(主要成分为Fe2O3)
(主要成分为Fe3O4
)
实验室里的含铁试剂
FeSO4溶液
FeCl3溶液
Fe(OH)3
沉淀
Fe(OH)2
沉淀
铁粉
FeCl2晶体
Fe2O3
Fe2(SO4)3
FeCl2
FeSO4
Fe(OH)2
Fe
FeCl3
Fe2(SO4)3
Fe2O3
Fe(OH)3
+2
+3
还原性
氧化性、还原性
氧化性
铁及其化合物的分类
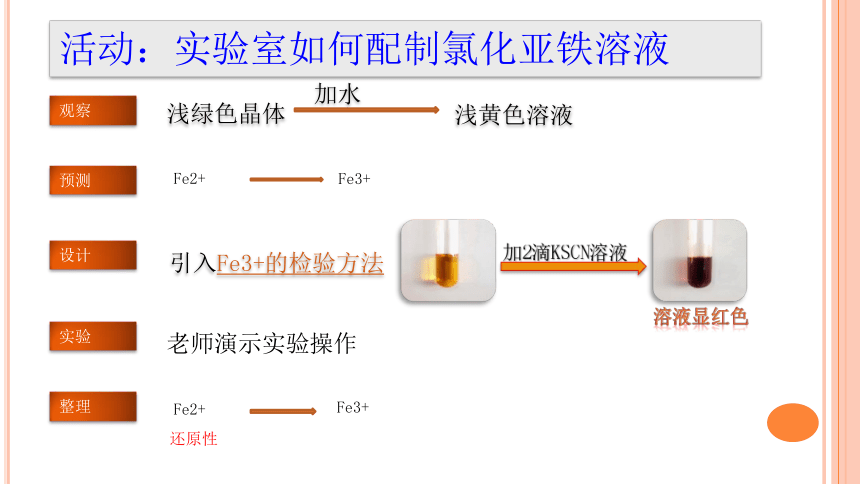
活动:实验室如何配制氯化亚铁溶液
观察
浅绿色晶体
加水
浅黄色溶液
预测
设计
实验
整理
Fe2+
Fe3+
引入Fe3+的检验方法
加2滴KSCN溶液
溶液显红色
老师演示实验操作
Fe2+
Fe3+
还原性
知
识
支
持
Fe3+的检验方法:
Fe2+的检验方法:
加2滴KSCN溶液
再滴加硝酸
加2滴KSCN溶液
溶液显红色
溶液显红色
溶液不变色
如何成功配制保存FeCl2溶液?
观察
预测
设计
实验
整理
Fe3+
Fe2+
老师演示实验操作
Fe3+
Fe2+
氧化性
Fe3+具有氧化性
Fe3+
Fe2+
铁粉
再滴加硝酸
加2滴KSCN溶液
溶液不变色
溶液显红色
铁粉
,引入Fe2+的检验方法:
探究物质性质的基本思路
观察
预测
设计
实验
整理
加入氧化剂,使其化合价升高;通过实验证明化合价升高后的产物
加入还原剂,使其化合价降低;通过实验证明化合价降低后的产物
探究方法
探究物质具
有还原性
探究物质具有氧化性
设计
自主探究实验
探究题目:
Fe、FeCl2、FeCl3的氧化性或还原性
探究物质
铁粉
FeCl2溶液
FeCl3溶液
预测性质
实验设计
实验现象
实验结论
提供试剂:铁粉、稀硫酸、
FeCl3溶液、铜片、锌片、KSCN溶液、
FeCl2溶液、稀硝酸,草酸
实验指导
1、小组分工合作:设计方案,
记录现象,填写学案
2、试剂参考用量:
液体:
1-2mL
铁粉:
1/3药匙
KSCN溶液:2-3滴
3、实验操作要规范。
探究题目:
Fe、FeCl2、FeCl3的氧化性或还原性
探究物质
铁粉
FeCl2溶液
FeCl3溶液
预测性质
还原性
氧化性
还原性
氧化性
实验设计
实验现象
实验结论
小
组
汇
报
总结提升
Fe
Fe2+
Fe3+
氧化性
还原性
Fe2+
+Zn
=
Zn2+
+Fe
2Fe2++
Cl2
=
2Fe3++
2Cl-
2Fe3+
+
Fe
=
3Fe2+
Fe
+
2H+
=
Fe2+
+
H2
还原性
氧化性
头晕乏力
缺铁性贫血
1、药剂:硫酸亚铁片、Vc片
各2片/天
2、辅助治疗:多食用含铁丰富
的食物并配合Vc服用
处方
学以致用
1
硫酸亚铁片
2
剥开的硫酸亚铁片
为什么要包裹一层糖衣??
学以致用2
为什么多食用含铁丰富
的食物并配合Vc服用???
学以致用3
第一个杯子加有FeCl3,茶叶水中含有一种酸性物质,当遇到Fe3+时会与其结合形成蓝黑色物质。
第二个杯子加有强还原剂草酸,能迅速将Fe3+还原成Fe2+,因此溶液的蓝黑色消失,重新显现出茶水的颜色。
品茶揭秘
课后作业1
过去电子工业常用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制造印刷线路板。制作时,把应该保留的铜箔遮挡,然后把铜箔放入氯化铁溶液中,这样没有遮挡的铜箔就被腐蚀掉了,留下了可以导电的铜线。请说出其中发生的反应原理,写出化学方程式。
本节课我收获了什么知识?
掌握了什么方法?
有什么新的发现?
约翰.道尔顿:
一些人能获得更多的成就,是由于他们对问题比起一般人能够更加专注和坚持,而不是由于他的天赋比别人高多少。
谢谢
第三节:
探究铁及其化合物的
氧化性和还原性
茶,是著名的世界三大饮料之一,被称为“东方饮料的皇帝
茶可以提神疗烦,解热止渴,消食除腻。
茶可以杀菌消炎,减肥健美,明目清心。
茶可以解烟醒酒,降压除脂,减轻癌变。
小实验:变色茶
自然界中的铁单质
新疆陨铁
南极洲陨铁
含铁元素的矿物
黄铁矿
磁铁矿
赤铁矿
(主要成分为FeS2)
(主要成分为Fe2O3)
(主要成分为Fe3O4
)
实验室里的含铁试剂
FeSO4溶液
FeCl3溶液
Fe(OH)3
沉淀
Fe(OH)2
沉淀
铁粉
FeCl2晶体
Fe2O3
Fe2(SO4)3
FeCl2
FeSO4
Fe(OH)2
Fe
FeCl3
Fe2(SO4)3
Fe2O3
Fe(OH)3
+2
+3
还原性
氧化性、还原性
氧化性
铁及其化合物的分类
活动:实验室如何配制氯化亚铁溶液
观察
浅绿色晶体
加水
浅黄色溶液
预测
设计
实验
整理
Fe2+
Fe3+
引入Fe3+的检验方法
加2滴KSCN溶液
溶液显红色
老师演示实验操作
Fe2+
Fe3+
还原性
知
识
支
持
Fe3+的检验方法:
Fe2+的检验方法:
加2滴KSCN溶液
再滴加硝酸
加2滴KSCN溶液
溶液显红色
溶液显红色
溶液不变色
如何成功配制保存FeCl2溶液?
观察
预测
设计
实验
整理
Fe3+
Fe2+
老师演示实验操作
Fe3+
Fe2+
氧化性
Fe3+具有氧化性
Fe3+
Fe2+
铁粉
再滴加硝酸
加2滴KSCN溶液
溶液不变色
溶液显红色
铁粉
,引入Fe2+的检验方法:
探究物质性质的基本思路
观察
预测
设计
实验
整理
加入氧化剂,使其化合价升高;通过实验证明化合价升高后的产物
加入还原剂,使其化合价降低;通过实验证明化合价降低后的产物
探究方法
探究物质具
有还原性
探究物质具有氧化性
设计
自主探究实验
探究题目:
Fe、FeCl2、FeCl3的氧化性或还原性
探究物质
铁粉
FeCl2溶液
FeCl3溶液
预测性质
实验设计
实验现象
实验结论
提供试剂:铁粉、稀硫酸、
FeCl3溶液、铜片、锌片、KSCN溶液、
FeCl2溶液、稀硝酸,草酸
实验指导
1、小组分工合作:设计方案,
记录现象,填写学案
2、试剂参考用量:
液体:
1-2mL
铁粉:
1/3药匙
KSCN溶液:2-3滴
3、实验操作要规范。
探究题目:
Fe、FeCl2、FeCl3的氧化性或还原性
探究物质
铁粉
FeCl2溶液
FeCl3溶液
预测性质
还原性
氧化性
还原性
氧化性
实验设计
实验现象
实验结论
小
组
汇
报
总结提升
Fe
Fe2+
Fe3+
氧化性
还原性
Fe2+
+Zn
=
Zn2+
+Fe
2Fe2++
Cl2
=
2Fe3++
2Cl-
2Fe3+
+
Fe
=
3Fe2+
Fe
+
2H+
=
Fe2+
+
H2
还原性
氧化性
头晕乏力
缺铁性贫血
1、药剂:硫酸亚铁片、Vc片
各2片/天
2、辅助治疗:多食用含铁丰富
的食物并配合Vc服用
处方
学以致用
1
硫酸亚铁片
2
剥开的硫酸亚铁片
为什么要包裹一层糖衣??
学以致用2
为什么多食用含铁丰富
的食物并配合Vc服用???
学以致用3
第一个杯子加有FeCl3,茶叶水中含有一种酸性物质,当遇到Fe3+时会与其结合形成蓝黑色物质。
第二个杯子加有强还原剂草酸,能迅速将Fe3+还原成Fe2+,因此溶液的蓝黑色消失,重新显现出茶水的颜色。
品茶揭秘
课后作业1
过去电子工业常用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制造印刷线路板。制作时,把应该保留的铜箔遮挡,然后把铜箔放入氯化铁溶液中,这样没有遮挡的铜箔就被腐蚀掉了,留下了可以导电的铜线。请说出其中发生的反应原理,写出化学方程式。
本节课我收获了什么知识?
掌握了什么方法?
有什么新的发现?
约翰.道尔顿:
一些人能获得更多的成就,是由于他们对问题比起一般人能够更加专注和坚持,而不是由于他的天赋比别人高多少。
谢谢
