高中化学 人教版(新课程标准) 选修3 物质结构与性质 第一章 原子结构与性质 单元复习 (共26张PPT)
文档属性
| 名称 | 高中化学 人教版(新课程标准) 选修3 物质结构与性质 第一章 原子结构与性质 单元复习 (共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 550.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-25 19:31:43 | ||
图片预览








文档简介
(共26张PPT)
第一章
原子结构与性质
第一节
原子结构
(第1,2课时)
复习题
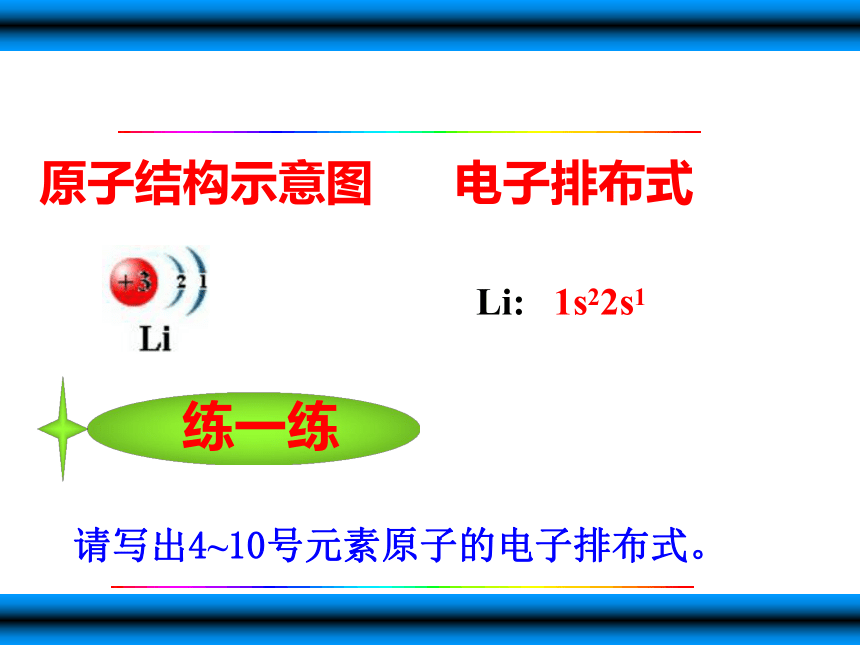
原子结构示意图
电子排布式
Li:
1s22s1
请写出4~10号元素原子的电子排布式。
4
铍Be
5
硼B
6
碳C
7
氮N
8
氧O
9
氟F
10
氖Ne
1s2
2s2
1s2
2s22p1
1s2
2s22p2
1s2
2s22p3
1s2
2s22p4
1s2
2s22p5
1s2
2s22p6
【练习】试书写N、Cl、K、26Fe原子的核外电子排布式。
Cl:
K:
26Fe:
1s2
2s22p6
3s23p5
1s2
2s22p6
3s23p6
4s1
1s2
2s22p6
3s23p63d6
4s2
注意书写:1s2
2s22p6
3s23p64s2
3d6
练习:请根据构造原理,写出下列元素基态原子的电子排布式:
(1)Ne??????????????
???
??
???。
(2)S
????????????????
??????。
(3)29Cu
?????????
???
?????????。
(4)32Ge
?????????????
??????。
1s22s22p6
1s22s22p63s23p4
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s24p2
下列各原子或离子的电子排布式错误的是(
)
A.
Ca2+
1s22s22p63s23p6
B.
O2-
1s22s23p4
C.
Cl-
1s22s22p63s23p5
D.
Ar
1s22s22p63s23p6
BC
练习
1:
练习2:
1.电子排布式为1s22s22p63s23p6
某原子,
则该元素的核电荷数是____________
2.某元素原子的价电子构型为3s23p4,
则此元素在周期表的位置是____________
18
第3周期,第VIA族
4.构造原理揭示的电子排布能级顺序,实质是
各能级能量高低,若以E
表示某能级的能量,下列能量大小顺序中正确的是
(
)
A.E(3s)>E(2s)>E(1s)
B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d)
D.E(5s)>E(4s)>E(4f)
3.一个电子排布为1s22s22p63s23p1的元素最可能的价态是(
)
A?
+1
B?
+2
C?
+3
D?
-1
C
A
5.下列各原子或离子的电子排布式错误的是(
)
A.Al
1s22s22p63s23p1
B.
O2-
1s22s22p6
C.Na+
1s22s22p6
D.
Si
1s22s22p2
6.下列表达方式错误的是(
)
A.甲烷的电子式
B.氟化钠的电子式
C.硫离子的核外电子排布式
1s22s22p63s23p4
D.碳-12原子符号
126C
D
C
A.前者大于后者
B.后者大于前者
C.前者等于后者
D.无法确定
B
练习1:在同一个原子中,M能层上的电子与Q能层上的电子的能量(
)
能表示核外电子排布
【思考】怎样用能层,能级表示核外电子排布?
2、根据2n2的规律推算第一到第四电子层最多可以容纳的电子数目为?
????????
。
1、按能量由低到高的顺序排列,正确的一组是:(
)
A.1s、2p、3d、4s
B.1s、2s、3s、2p
C.2s、2p、3s、3p
D.4p、3d、4s、3p
2、8、18、32
C
练习:
练习:请写出第四周期21—36号元素原子的基态电子排布式。
钪Sc:
;
钛Ti:
;
钒V:
;
铬Cr:
;
锰Mn:
;
铁Fe:
;
钴Co:
;
镍Ni:
;
1s22s22p63s23p63d14s2
1s22s22p63s23p63d24s2
1s22s22p63s23p63d34s2
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s2
1s22s22p63s23p63d64s2
1s22s22p63s23p63d74s2
1s22s22p63s23p63d84s2
练习:请写出第四周期21—36号元素原子的基态电子排布式。
铜Cu:
;
锌Zn:
;
镓Ga:
;
锗Ge:
;
砷As:
;
硒Se:
;
溴Br:
;
氪Kr:
;
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s2
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p2
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p4
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s24p6
P7
【思考与交流】1
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
练习:1~36号元素中是否都遵循构造原理?
举出能否具体的例子?
注
意
基态与激发态的关系原子光谱
基态原子
激发态原子
吸收能量
释放能量
发射光谱
吸收光谱
能量较高
能量最低
1.当镁原子由1s22s22p63s2
→1s22s22p63p2时,以下说法正确的是(
)
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.镁原子由基态转化成激发态,这一过程中释放能量
D.镁原子由激发态转化成基态,这一过程中吸收能量
A
课堂练习
2.判断下列表达是正确还是错误?
(1)
1s22s2
2p63s2
3p63d54s2
属于激发态
(2)
1s22s2
2p63d1
属于激发态
构造原理:
1s;2s
2p;3s
3p;4s
3d
4p;
5s
4d
5p;
6s
4f
5d
6p;7s
5f
6d
练习1:《创新设计》
例5,训练5
练习2:写出
24Cr
29Cu
电子排布式
29Cu
1s22s22p63s23p63d104s1
24Cr
1s22s22p63s23p63d54s1
洪特规则特例:
洪特规则特例:
相对稳定的状态
全充满(p6,d10,f14)
全空时(p0,d0,f0)
半充满(p3,d5,f7)
↑↑
↑↑
↑↑
↑↑
↑
↑
↑↓
↑↓
↑↓
↑↓
其中最能准确表示基态锰原子核外电子运动状态的是(
)
A
B
C
D
C
↑↓
↑↓
↑
↑↓
当碳原子的核外电子排布由
转变为
时,下列说法正确的是
(
)
A.碳原子由基态变为激发态
B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量
D.碳原子要向外界环境释放能量
A
C
1s
2s
2p
3s
3p
3d
5.下列有关原子轨道的叙述中不正确的(
)
A.氢原子的3s轨道能量较3p能级低
B.锂原子的2s与5s
轨道皆为球形分布
C.p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多
D.能层n=4的原子轨道最多可容纳16个电子
课堂练习
CD
6.基态碳原子的最外能层的各能级中,电子排布的方式正确的是(
)
A
B
C
D
C
课堂练习
7、以下是表示铁原子的3种不同化学用语。
请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。
结构示意图:能直观地反映核内的质子数和核外的电子层数
及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级
上的电子数。
电子排布图:能反映各轨道的能量的高低及各轨道上的电子
分布情况,自旋方向。
巩固练习
1、某元素原子序数为24,试问:
(1)该元素电子排布式:
1s2
2s22p6
3s23p63d5
4s1
(2)它有
个能层;
个能级;占有
个原子轨道。
(3)此元素有
个未成对电子;它的价电子数是
。
6
4
7
15
6
第一章
原子结构与性质
第一节
原子结构
(第1,2课时)
复习题
原子结构示意图
电子排布式
Li:
1s22s1
请写出4~10号元素原子的电子排布式。
4
铍Be
5
硼B
6
碳C
7
氮N
8
氧O
9
氟F
10
氖Ne
1s2
2s2
1s2
2s22p1
1s2
2s22p2
1s2
2s22p3
1s2
2s22p4
1s2
2s22p5
1s2
2s22p6
【练习】试书写N、Cl、K、26Fe原子的核外电子排布式。
Cl:
K:
26Fe:
1s2
2s22p6
3s23p5
1s2
2s22p6
3s23p6
4s1
1s2
2s22p6
3s23p63d6
4s2
注意书写:1s2
2s22p6
3s23p64s2
3d6
练习:请根据构造原理,写出下列元素基态原子的电子排布式:
(1)Ne??????????????
???
??
???。
(2)S
????????????????
??????。
(3)29Cu
?????????
???
?????????。
(4)32Ge
?????????????
??????。
1s22s22p6
1s22s22p63s23p4
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s24p2
下列各原子或离子的电子排布式错误的是(
)
A.
Ca2+
1s22s22p63s23p6
B.
O2-
1s22s23p4
C.
Cl-
1s22s22p63s23p5
D.
Ar
1s22s22p63s23p6
BC
练习
1:
练习2:
1.电子排布式为1s22s22p63s23p6
某原子,
则该元素的核电荷数是____________
2.某元素原子的价电子构型为3s23p4,
则此元素在周期表的位置是____________
18
第3周期,第VIA族
4.构造原理揭示的电子排布能级顺序,实质是
各能级能量高低,若以E
表示某能级的能量,下列能量大小顺序中正确的是
(
)
A.E(3s)>E(2s)>E(1s)
B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d)
D.E(5s)>E(4s)>E(4f)
3.一个电子排布为1s22s22p63s23p1的元素最可能的价态是(
)
A?
+1
B?
+2
C?
+3
D?
-1
C
A
5.下列各原子或离子的电子排布式错误的是(
)
A.Al
1s22s22p63s23p1
B.
O2-
1s22s22p6
C.Na+
1s22s22p6
D.
Si
1s22s22p2
6.下列表达方式错误的是(
)
A.甲烷的电子式
B.氟化钠的电子式
C.硫离子的核外电子排布式
1s22s22p63s23p4
D.碳-12原子符号
126C
D
C
A.前者大于后者
B.后者大于前者
C.前者等于后者
D.无法确定
B
练习1:在同一个原子中,M能层上的电子与Q能层上的电子的能量(
)
能表示核外电子排布
【思考】怎样用能层,能级表示核外电子排布?
2、根据2n2的规律推算第一到第四电子层最多可以容纳的电子数目为?
????????
。
1、按能量由低到高的顺序排列,正确的一组是:(
)
A.1s、2p、3d、4s
B.1s、2s、3s、2p
C.2s、2p、3s、3p
D.4p、3d、4s、3p
2、8、18、32
C
练习:
练习:请写出第四周期21—36号元素原子的基态电子排布式。
钪Sc:
;
钛Ti:
;
钒V:
;
铬Cr:
;
锰Mn:
;
铁Fe:
;
钴Co:
;
镍Ni:
;
1s22s22p63s23p63d14s2
1s22s22p63s23p63d24s2
1s22s22p63s23p63d34s2
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s2
1s22s22p63s23p63d64s2
1s22s22p63s23p63d74s2
1s22s22p63s23p63d84s2
练习:请写出第四周期21—36号元素原子的基态电子排布式。
铜Cu:
;
锌Zn:
;
镓Ga:
;
锗Ge:
;
砷As:
;
硒Se:
;
溴Br:
;
氪Kr:
;
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s2
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p2
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p4
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s24p6
P7
【思考与交流】1
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
练习:1~36号元素中是否都遵循构造原理?
举出能否具体的例子?
注
意
基态与激发态的关系原子光谱
基态原子
激发态原子
吸收能量
释放能量
发射光谱
吸收光谱
能量较高
能量最低
1.当镁原子由1s22s22p63s2
→1s22s22p63p2时,以下说法正确的是(
)
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.镁原子由基态转化成激发态,这一过程中释放能量
D.镁原子由激发态转化成基态,这一过程中吸收能量
A
课堂练习
2.判断下列表达是正确还是错误?
(1)
1s22s2
2p63s2
3p63d54s2
属于激发态
(2)
1s22s2
2p63d1
属于激发态
构造原理:
1s;2s
2p;3s
3p;4s
3d
4p;
5s
4d
5p;
6s
4f
5d
6p;7s
5f
6d
练习1:《创新设计》
例5,训练5
练习2:写出
24Cr
29Cu
电子排布式
29Cu
1s22s22p63s23p63d104s1
24Cr
1s22s22p63s23p63d54s1
洪特规则特例:
洪特规则特例:
相对稳定的状态
全充满(p6,d10,f14)
全空时(p0,d0,f0)
半充满(p3,d5,f7)
↑↑
↑↑
↑↑
↑↑
↑
↑
↑↓
↑↓
↑↓
↑↓
其中最能准确表示基态锰原子核外电子运动状态的是(
)
A
B
C
D
C
↑↓
↑↓
↑
↑↓
当碳原子的核外电子排布由
转变为
时,下列说法正确的是
(
)
A.碳原子由基态变为激发态
B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量
D.碳原子要向外界环境释放能量
A
C
1s
2s
2p
3s
3p
3d
5.下列有关原子轨道的叙述中不正确的(
)
A.氢原子的3s轨道能量较3p能级低
B.锂原子的2s与5s
轨道皆为球形分布
C.p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多
D.能层n=4的原子轨道最多可容纳16个电子
课堂练习
CD
6.基态碳原子的最外能层的各能级中,电子排布的方式正确的是(
)
A
B
C
D
C
课堂练习
7、以下是表示铁原子的3种不同化学用语。
请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。
结构示意图:能直观地反映核内的质子数和核外的电子层数
及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级
上的电子数。
电子排布图:能反映各轨道的能量的高低及各轨道上的电子
分布情况,自旋方向。
巩固练习
1、某元素原子序数为24,试问:
(1)该元素电子排布式:
1s2
2s22p6
3s23p63d5
4s1
(2)它有
个能层;
个能级;占有
个原子轨道。
(3)此元素有
个未成对电子;它的价电子数是
。
6
4
7
15
6
