化学反应限度
图片预览





文档简介
(共19张PPT)
你看到了什么?
你想到了什么?
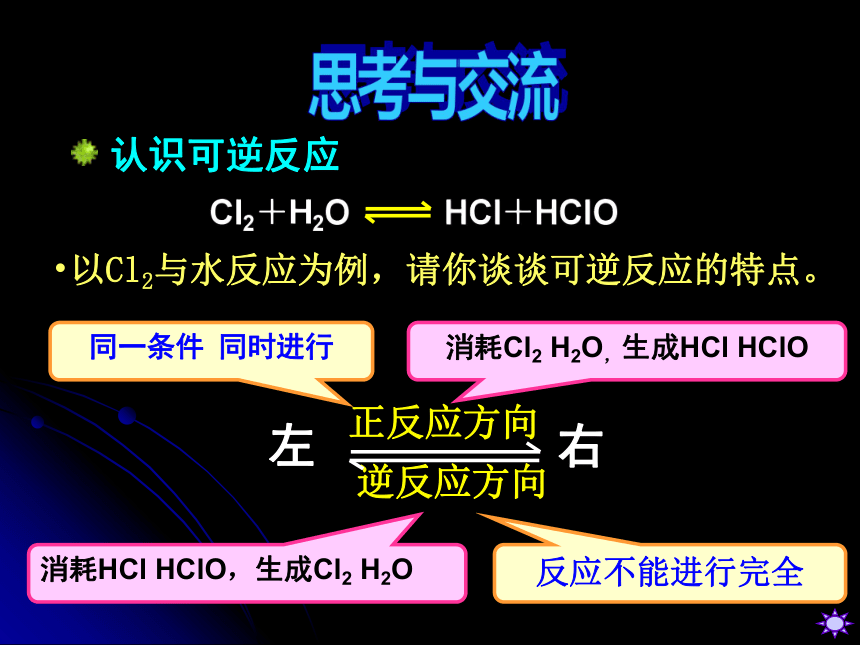
Cl2+H2O HCl+HClO
在瓶中加入大量的水,瓶内仍有Cl2?
氯水的颜色是黄绿色的?
Cl2在水中溶解是有限度的
Cl2与水反应是有限度的
溶解度
普通高中课程标准实验教科书 化学2 必修
第二章 化学反应与能量
第三节 化学反应的速率和限度
化学反应的限度
Cl2+H2O HCl+HClO
左 右
正反应方向
逆反应方向
消耗Cl2 H2O,生成HCl HClO
消耗HCl HClO,生成Cl2 H2O
反应不能进行完全
以Cl2与水反应为例,请你谈谈可逆反应的特点。
同一条件 同时进行
认识可逆反应
可逆反应在一定条件下所能达到的最大程度,即该反应的化学反应限度。
认识化学反应限度
Cl2+H2O HCl+HClO
正反应和逆反应的速率是如何变化的?
达到化学反应限度时反应停止了吗?
达到化学反应限度时各物质的浓度是否变化?
最大转化率
转化率(Cl2)=
Δn(Cl2)
n(Cl2 总量)
×100%
0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
500℃ 1.01×105 Pa
物质的量
时间(分)
在某密闭容器中发生反应:
2SO2 + O2 2SO3
催化剂
Cl2+H2O HCl+HClO
如何溶解更多的Cl2?
溶解度受外界条件影响
化学反应限度可以改变吗?
大胆预测影响化学反应限度的因素。
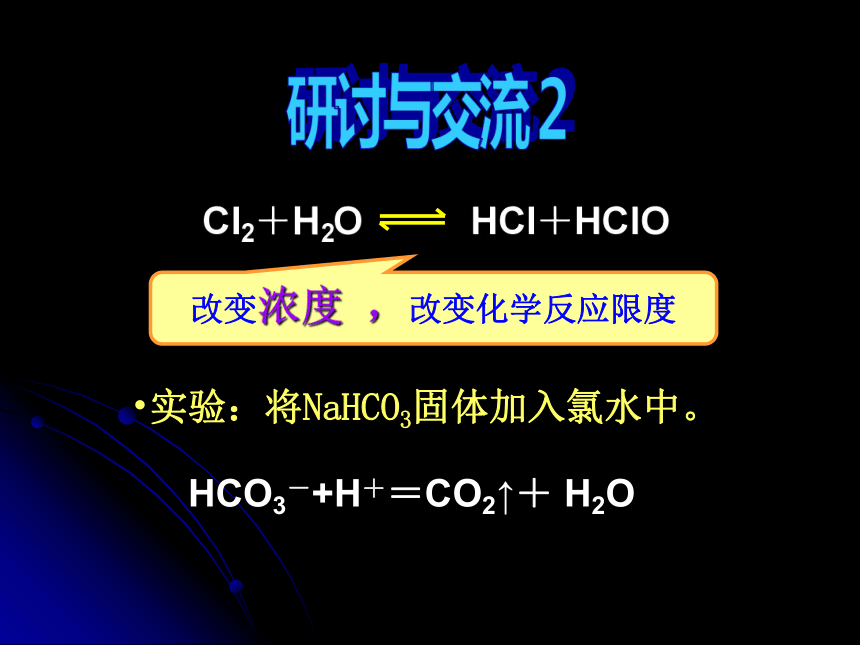
改变浓度 ,改变化学反应限度
实验:将NaHCO3固体加入氯水中。
HCO3-+H+=CO2↑+ H2O
Cl2+H2O HCl+HClO
0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
600℃ 1.01×105 Pa
0 10 20 30 40 50 60 70
SO2 1 0.6 0.5 0.4 0.3 0.3 0.3 0.3
O2 0.5 0.3 0.25 0.2 0.15 0.15 0.15 0.15
SO3 0 0.4 0.5 0.6 0.7 0.7 0.7 0.7
500℃ 1.01×105 Pa
物质的量
时间(分)
物质的量
时间(分)
在某密闭容器中发生反应:
2SO2 + O2 2SO3
催化剂
0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
500℃ 1.01×105 Pa
物质的量
时间(分)
500℃ 5.05×105 Pa
0 10 20 30 40 50 60 70
SO2 1 0.2 0.08 0.03 0.03 0.03 0.03 0.03
O2 0.5 0.1 0.04 0.015 0.015 0.015 0.015 0.015
SO3 0 0.8 0.92 0.97 0.97 0.97 0.97 0.97
物质的量
时间(分)
在某密闭容器中发生反应:
2SO2 + O2 2SO3
催化剂
2SO2 + O2 2SO3
催化剂
改变压强、温度,改变化学反应限度
Cl2+H2O HCl+HClO
改变浓度 ,改变化学反应限度
研究对象:可逆反应
化学平衡状态:
V正=V逆 > 0 ;混合物各组分的浓度不变
化学反应限度
影响限度的因素:
同一可逆反应的限度随条件不同而不同
浓度
压强
?
温度
决定因素:物质自身的化学性质
不同可逆反应,化学反应限度不同
你看到了什么
观察与记录
你想到了什么
思考与分析
提出新问题 化学反应限度
研讨与探究
应用与拓展
深入研究
研究问题的方法
0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
600℃ 1.01×105 Pa
0 10 20 30 40 50 60 70
SO2 1 0.6 0.5 0.4 0.3 0.3 0.3 0.3
O2 0.5 0.3 0.25 0.2 0.15 0.15 0.15 0.15
SO3 0 0.4 0.5 0.6 0.7 0.7 0.7 0.7
500℃ 1.01×105 Pa
物质的量
时间(分)
物质的量
时间(分)
500℃ 5.05×105 Pa
0 10 20 30 40 50 60 70
SO2 1 0.2 0.08 0.03 0.03 0.03 0.03 0.03
O2 0.5 0.1 0.04 0.015 0.015 0.015 0.015 0.015
SO3 0 0.8 0.92 0.97 0.97 0.97 0.97 0.97
物质的量
时间(分)
2SO2 + O2 2SO3
催化剂
Fe2O3 + 3CO 2Fe + 3CO2
高温
人们发现从高炉气中含有相当量的CO。
CO与铁矿石接触时间不够所造成的。
耗巨资金建成了一个高大的炼铁高炉。但是尾气中CO的含量竟然没有改变。
这是为什么呢?
C+CO2 2CO
(1)2H2 + O2 === 2H2O
2H2O === 2H2 + O2
点燃
通电
(2)Fe + 2HCl(浓) = FeCl2 + H2↑
Fe + 2HCl(稀) = FeCl2 + H2↑
(3)2CO + O2 === 2CO2
2SO2+O2 2SO3
点燃
△
催化剂
第三节 化学反应速率和限度
一、化学反应速率
二、化学反应限度
研究对象:可逆反应
化学平衡状态
影响因素: 决定因素:物质的性质
V正=V逆
动态平衡
各物质的浓度不变
影响因素:浓度、温度、压强
反应物转化率最大
决定
久制氯水的成分是盐酸。
SO2、O2
SO3 SO2 O2
SO2、O2
2SO2 (g) + O2(g) 2SO3(g)
催化剂
你看到了什么?
你想到了什么?
Cl2+H2O HCl+HClO
在瓶中加入大量的水,瓶内仍有Cl2?
氯水的颜色是黄绿色的?
Cl2在水中溶解是有限度的
Cl2与水反应是有限度的
溶解度
普通高中课程标准实验教科书 化学2 必修
第二章 化学反应与能量
第三节 化学反应的速率和限度
化学反应的限度
Cl2+H2O HCl+HClO
左 右
正反应方向
逆反应方向
消耗Cl2 H2O,生成HCl HClO
消耗HCl HClO,生成Cl2 H2O
反应不能进行完全
以Cl2与水反应为例,请你谈谈可逆反应的特点。
同一条件 同时进行
认识可逆反应
可逆反应在一定条件下所能达到的最大程度,即该反应的化学反应限度。
认识化学反应限度
Cl2+H2O HCl+HClO
正反应和逆反应的速率是如何变化的?
达到化学反应限度时反应停止了吗?
达到化学反应限度时各物质的浓度是否变化?
最大转化率
转化率(Cl2)=
Δn(Cl2)
n(Cl2 总量)
×100%
0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
500℃ 1.01×105 Pa
物质的量
时间(分)
在某密闭容器中发生反应:
2SO2 + O2 2SO3
催化剂
Cl2+H2O HCl+HClO
如何溶解更多的Cl2?
溶解度受外界条件影响
化学反应限度可以改变吗?
大胆预测影响化学反应限度的因素。
改变浓度 ,改变化学反应限度
实验:将NaHCO3固体加入氯水中。
HCO3-+H+=CO2↑+ H2O
Cl2+H2O HCl+HClO
0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
600℃ 1.01×105 Pa
0 10 20 30 40 50 60 70
SO2 1 0.6 0.5 0.4 0.3 0.3 0.3 0.3
O2 0.5 0.3 0.25 0.2 0.15 0.15 0.15 0.15
SO3 0 0.4 0.5 0.6 0.7 0.7 0.7 0.7
500℃ 1.01×105 Pa
物质的量
时间(分)
物质的量
时间(分)
在某密闭容器中发生反应:
2SO2 + O2 2SO3
催化剂
0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
500℃ 1.01×105 Pa
物质的量
时间(分)
500℃ 5.05×105 Pa
0 10 20 30 40 50 60 70
SO2 1 0.2 0.08 0.03 0.03 0.03 0.03 0.03
O2 0.5 0.1 0.04 0.015 0.015 0.015 0.015 0.015
SO3 0 0.8 0.92 0.97 0.97 0.97 0.97 0.97
物质的量
时间(分)
在某密闭容器中发生反应:
2SO2 + O2 2SO3
催化剂
2SO2 + O2 2SO3
催化剂
改变压强、温度,改变化学反应限度
Cl2+H2O HCl+HClO
改变浓度 ,改变化学反应限度
研究对象:可逆反应
化学平衡状态:
V正=V逆 > 0 ;混合物各组分的浓度不变
化学反应限度
影响限度的因素:
同一可逆反应的限度随条件不同而不同
浓度
压强
?
温度
决定因素:物质自身的化学性质
不同可逆反应,化学反应限度不同
你看到了什么
观察与记录
你想到了什么
思考与分析
提出新问题 化学反应限度
研讨与探究
应用与拓展
深入研究
研究问题的方法
0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
600℃ 1.01×105 Pa
0 10 20 30 40 50 60 70
SO2 1 0.6 0.5 0.4 0.3 0.3 0.3 0.3
O2 0.5 0.3 0.25 0.2 0.15 0.15 0.15 0.15
SO3 0 0.4 0.5 0.6 0.7 0.7 0.7 0.7
500℃ 1.01×105 Pa
物质的量
时间(分)
物质的量
时间(分)
500℃ 5.05×105 Pa
0 10 20 30 40 50 60 70
SO2 1 0.2 0.08 0.03 0.03 0.03 0.03 0.03
O2 0.5 0.1 0.04 0.015 0.015 0.015 0.015 0.015
SO3 0 0.8 0.92 0.97 0.97 0.97 0.97 0.97
物质的量
时间(分)
2SO2 + O2 2SO3
催化剂
Fe2O3 + 3CO 2Fe + 3CO2
高温
人们发现从高炉气中含有相当量的CO。
CO与铁矿石接触时间不够所造成的。
耗巨资金建成了一个高大的炼铁高炉。但是尾气中CO的含量竟然没有改变。
这是为什么呢?
C+CO2 2CO
(1)2H2 + O2 === 2H2O
2H2O === 2H2 + O2
点燃
通电
(2)Fe + 2HCl(浓) = FeCl2 + H2↑
Fe + 2HCl(稀) = FeCl2 + H2↑
(3)2CO + O2 === 2CO2
2SO2+O2 2SO3
点燃
△
催化剂
第三节 化学反应速率和限度
一、化学反应速率
二、化学反应限度
研究对象:可逆反应
化学平衡状态
影响因素: 决定因素:物质的性质
V正=V逆
动态平衡
各物质的浓度不变
影响因素:浓度、温度、压强
反应物转化率最大
决定
久制氯水的成分是盐酸。
SO2、O2
SO3 SO2 O2
SO2、O2
2SO2 (g) + O2(g) 2SO3(g)
催化剂
