人教版高一化学必修二1.3.2共价键 课件(56张ppt)
文档属性
| 名称 | 人教版高一化学必修二1.3.2共价键 课件(56张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-26 18:51:47 | ||
图片预览







文档简介
(共29张PPT)
H·
和
原子形成HCl过程中,能否形成离子键?为什么?
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
不能,因非金属元素的原子均有获得电子的倾向。
我只有一个电子,太少了
我也少一个电子
e
H
原子
Cl
原子
H
·
愿意
愿意
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
氢分子的形成:
H
·
氯化氢分子的形成:
·
H
+
→
H
·
+
→
原子之间通过共用电子对所形成的相互作用,叫做共价键。
对共价键的理解
共价键:原子之间通过共用电子对所形成
的相互作用叫做共价键。
1.成键原因:
2.成键粒子:
3.成键实质:
4.成键元素:
形成共用电子对
原子(相同或不同)。
原子间通过共用电子对产生的静电作用。(有引力和斥力)
非金属元素和非金属元素或不活泼金属之间。
6.
共价键存在范围:
1)非金属单质:H2、Cl2、O2、N2等(稀有气体除外)
5.共价键的特点:
一个原子有几个未成对电子电子就可以和几个未成对原子配对成键(具有饱和性和方向性)。
如:VIIA族元素的原子一般可形成1个共价键,VIA族2个,VA族3个,
IVA族4个,IIIA族3个等。
2)非金属氧化物:H2O、CO2、H2O2等
3)非金属氢化物:HX、H2R、RH3、RH4
等
4)某些非金属化合物中:碱、含氧酸盐、铵盐、某些金属
氧化物
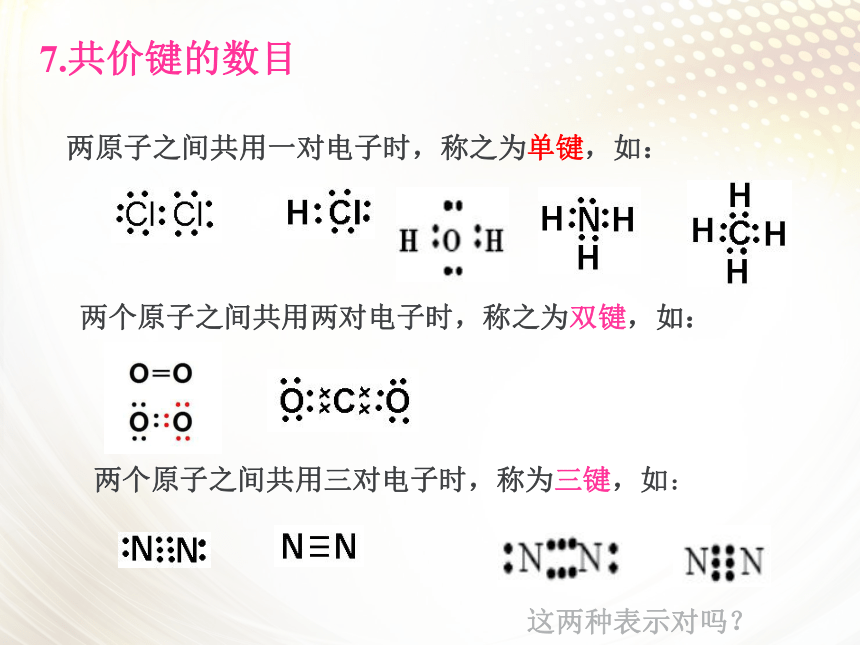
7.共价键的数目
两原子之间共用一对电子时,称之为单键,如:
两个原子之间共用两对电子时,称之为双键,如:
两个原子之间共用三对电子时,称为三键,如:
这两种表示对吗?
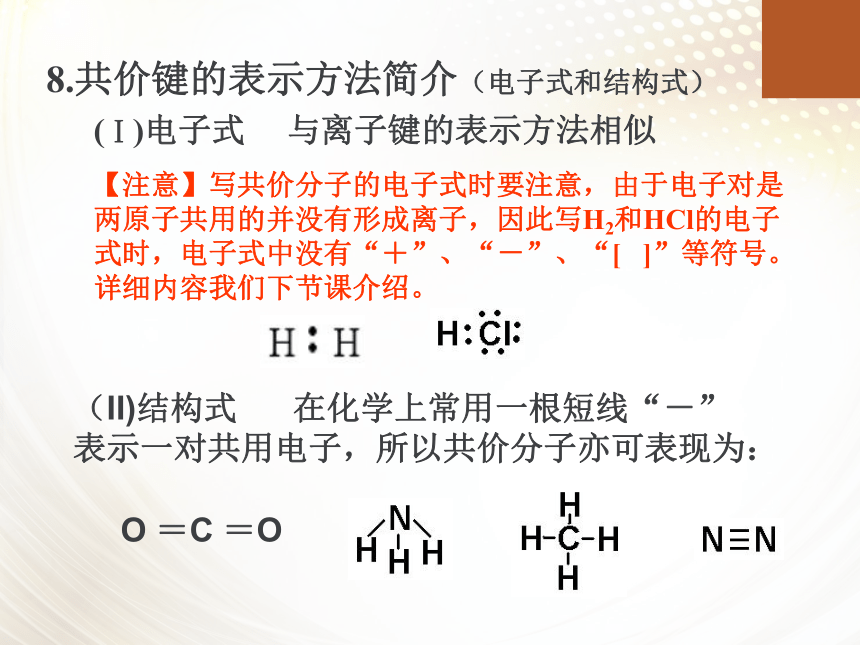
8.共价键的表示方法简介(电子式和结构式)
(Ⅰ)电子式
与离子键的表示方法相似
【注意】写共价分子的电子式时要注意,由于电子对是两原子共用的并没有形成离子,因此写H2和HCl的电子式时,电子式中没有“+”、“-”、“[
]”等符号。详细内容我们下节课介绍。
(II)结构式
在化学上常用一根短线“-”表示一对共用电子,所以共价分子亦可表现为:
O
=C
=O
O=C=O
H-O-O-H
用电子式表示共价化合物
1.每个原子均应达到稳定的结构
2.不加中括号[
],不标正负电荷数
3.原子最外层电子数距8电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子对(即几个共价键)
书写要求:
9.共价键的强弱比较(原子半径和共用电子对数目)
一般而言两成键原子半径越小,共价键就越短,共价键就越牢固。如:H-H
﹥Cl-Cl
H-F
﹥H-Cl
两成键原子间共用电子对数目越多,共价键就越牢固,一般:三键﹥双键﹥单键
如:C≡C
﹥C=C
﹥C-C
10共价键的分类(极性键和非极性键)
(I)非极性共价键
两个原子核间的共用电子对不偏向任何一个原子核的共价键【特点(判断方法):同种元素原子之间形成的共价键】。结果:成键原子都不显电性。
(II)极性共价键
两个原子核间的共用电子对偏向于某个原子核的共价键【特点(判断方法):不同种元素原子之间形成的共价键)】。结果:偏向带负电,偏离带正电
(III)极性强弱判断方法:看构成共价键的两个原子的非金属性的差别大小,差别越大极性越大。如极性大小:
H-F
﹥H-Cl
请判断NaOH、Na2O2属于离子化合物还是共价化合物?写出其相应的电子式,并分析两化合物中的成键情况?
共价化合物:只含有共价键的化合物
物质类型:酸、非金属氧化物、非金属氢化物
离子化合物
离子化合物
含有共价键的化合物不一定是共价化合物
判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物
练习:
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
下列说法是否正确?并举例说明
1、离子化合物中可能含有共价键。
2、共价化合物中可能含有离子键。
3、非金属原子间不可能形成离子键。
4、非极性键只存在于双原子单质分子里。
5、活泼金属和活泼非金属一定形成离子化合物。
练习
下列说法中正确的是
(
)
(A)含有共价键的分子一定是共价分子
(B)只含有共价键的物质一定是共价化合物
(C)离子化合物中可能含有极性共价键或非极性共价
键
(D)氦分子中含有共价键
也可能是单质分子,如氯气,氮气。
正确
氦气是单原子分子,不存在化学健。
C
也可能是离子化合物,如
NaOH,
Na2O2
。
写出下列物质的电子式,并指出化合物的类型
H2O
HClO
NaOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
1、判断Cl2
、N2
、HCl、NH3
、NaOH、H2O2等物质中共价键的极性。
2、膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气(C2H2)的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述正确的是(
)
A.PH3分子中有离子键
B.PH3分子中有未成键的电子对
C.PH3是一个强氧化剂
D.PH3分子中的P-H键是非极性键
反馈练习
B
Cl2、N2中只有非极性键;
HCl、NH3
中只有极性键;
NaOH中既有离子键又有极性键;H2O2既有非极性键又有极性键
膦与氨类似,只含非金属元素,只有共价键,有一对未成键电子(孤对电子),P最低价具有强还原性,P-H键是极性键。
非金属元素之间
活泼金属与非金属元素之间
阳离子
~
阴离子
原子
~原子
静电作用
离子电荷数多、半径小的键强
原子半径小键强
共用电子对
离子键和共价键的比较
只存于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
比
较
离子键
共价键
成键元素
成键微粒
成键本质
键的强弱
键的存在
联系:两者并无绝对严格的界限,可把离子键看做极性键增强的极限;把非极性键看做是极性键减弱的极限;而把极性键看做时非极性键与离子键的过度状态。
键极性对性质的影响(了解)
极性由强到弱
非极性
→
键极性键
→离子键
水中的电离
难
→
有的可电离→电离
熔融状态时电离
难
→
难
→
电离
显然区分离子化合物与共价化合物的最佳方法是:???
共
价
键
12
化学键与物质类别之间的关系规律
化学键
定义:使离子相结合或原子相结合的作用力通称为化学键。
化学反应的实质:反应物分子内化学键的断裂和产物分子中化学键的形成。
旧键的断裂和新键的形成
复习
下列哪一种元素的原子既能与其它元素的原子形成离子键或极性共价键,又能彼此结合形成非极性共价键
(
)
(A)Na
(B)Ne
(C)Cl
(D)O
能彼此结合形成非极性共价键的,是非金属元素。
NaCl
H-Cl
Cl-Cl
C
D
Na2O
H-O-H
O2
二氧化碳的电子式或结构式错误的是(
)
O=C=O
O-C-O
(A)
(B)
(C)
(D)
A
C
碳氧双键
次氯酸的电子式或结构式错误的是(
)
H-O-Cl
(A)
(B)
(C)
(D)
A
D
含氧酸都是共价化合物,不是离子化合物。
题型一
共价键辨认
【例1】下列化合物中所有化学键都是共价键的是
(
)
A.Na2O2
B.NaOH
C.BaCl2
D.CCl4
D
【解析】A、B中均有离子键和共价键,C中只有离子键。
1.某元素的原子核最外电子层上只有1个电子,它跟卤族化合时,可形成的化学键是
(
)
A.一定是离子键
B.一定是共价键
C.可能是离子键,也可能是共价键
D.上述说法都不正确
对应训练
C
A
D
C
1、下列说法中正确的是(
)
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中可能含有共价键
2、下列物质中含有共价键的离子化合物是(
)
A.Ba(OH)2
B.CaCl2
C.H2O
D.H2
AD
A
牛刀小试:
3
写出下列物质的电子式:
CH4、
NaOH、
Na2O2、
NH4+、
H3O+、
Ar、
Mg2+、
NH4Cl、
HClO
H·
和
原子形成HCl过程中,能否形成离子键?为什么?
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
不能,因非金属元素的原子均有获得电子的倾向。
我只有一个电子,太少了
我也少一个电子
e
H
原子
Cl
原子
H
·
愿意
愿意
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
氢分子的形成:
H
·
氯化氢分子的形成:
·
H
+
→
H
·
+
→
原子之间通过共用电子对所形成的相互作用,叫做共价键。
对共价键的理解
共价键:原子之间通过共用电子对所形成
的相互作用叫做共价键。
1.成键原因:
2.成键粒子:
3.成键实质:
4.成键元素:
形成共用电子对
原子(相同或不同)。
原子间通过共用电子对产生的静电作用。(有引力和斥力)
非金属元素和非金属元素或不活泼金属之间。
6.
共价键存在范围:
1)非金属单质:H2、Cl2、O2、N2等(稀有气体除外)
5.共价键的特点:
一个原子有几个未成对电子电子就可以和几个未成对原子配对成键(具有饱和性和方向性)。
如:VIIA族元素的原子一般可形成1个共价键,VIA族2个,VA族3个,
IVA族4个,IIIA族3个等。
2)非金属氧化物:H2O、CO2、H2O2等
3)非金属氢化物:HX、H2R、RH3、RH4
等
4)某些非金属化合物中:碱、含氧酸盐、铵盐、某些金属
氧化物
7.共价键的数目
两原子之间共用一对电子时,称之为单键,如:
两个原子之间共用两对电子时,称之为双键,如:
两个原子之间共用三对电子时,称为三键,如:
这两种表示对吗?
8.共价键的表示方法简介(电子式和结构式)
(Ⅰ)电子式
与离子键的表示方法相似
【注意】写共价分子的电子式时要注意,由于电子对是两原子共用的并没有形成离子,因此写H2和HCl的电子式时,电子式中没有“+”、“-”、“[
]”等符号。详细内容我们下节课介绍。
(II)结构式
在化学上常用一根短线“-”表示一对共用电子,所以共价分子亦可表现为:
O
=C
=O
O=C=O
H-O-O-H
用电子式表示共价化合物
1.每个原子均应达到稳定的结构
2.不加中括号[
],不标正负电荷数
3.原子最外层电子数距8电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子对(即几个共价键)
书写要求:
9.共价键的强弱比较(原子半径和共用电子对数目)
一般而言两成键原子半径越小,共价键就越短,共价键就越牢固。如:H-H
﹥Cl-Cl
H-F
﹥H-Cl
两成键原子间共用电子对数目越多,共价键就越牢固,一般:三键﹥双键﹥单键
如:C≡C
﹥C=C
﹥C-C
10共价键的分类(极性键和非极性键)
(I)非极性共价键
两个原子核间的共用电子对不偏向任何一个原子核的共价键【特点(判断方法):同种元素原子之间形成的共价键】。结果:成键原子都不显电性。
(II)极性共价键
两个原子核间的共用电子对偏向于某个原子核的共价键【特点(判断方法):不同种元素原子之间形成的共价键)】。结果:偏向带负电,偏离带正电
(III)极性强弱判断方法:看构成共价键的两个原子的非金属性的差别大小,差别越大极性越大。如极性大小:
H-F
﹥H-Cl
请判断NaOH、Na2O2属于离子化合物还是共价化合物?写出其相应的电子式,并分析两化合物中的成键情况?
共价化合物:只含有共价键的化合物
物质类型:酸、非金属氧化物、非金属氢化物
离子化合物
离子化合物
含有共价键的化合物不一定是共价化合物
判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物
练习:
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
下列说法是否正确?并举例说明
1、离子化合物中可能含有共价键。
2、共价化合物中可能含有离子键。
3、非金属原子间不可能形成离子键。
4、非极性键只存在于双原子单质分子里。
5、活泼金属和活泼非金属一定形成离子化合物。
练习
下列说法中正确的是
(
)
(A)含有共价键的分子一定是共价分子
(B)只含有共价键的物质一定是共价化合物
(C)离子化合物中可能含有极性共价键或非极性共价
键
(D)氦分子中含有共价键
也可能是单质分子,如氯气,氮气。
正确
氦气是单原子分子,不存在化学健。
C
也可能是离子化合物,如
NaOH,
Na2O2
。
写出下列物质的电子式,并指出化合物的类型
H2O
HClO
NaOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
1、判断Cl2
、N2
、HCl、NH3
、NaOH、H2O2等物质中共价键的极性。
2、膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气(C2H2)的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述正确的是(
)
A.PH3分子中有离子键
B.PH3分子中有未成键的电子对
C.PH3是一个强氧化剂
D.PH3分子中的P-H键是非极性键
反馈练习
B
Cl2、N2中只有非极性键;
HCl、NH3
中只有极性键;
NaOH中既有离子键又有极性键;H2O2既有非极性键又有极性键
膦与氨类似,只含非金属元素,只有共价键,有一对未成键电子(孤对电子),P最低价具有强还原性,P-H键是极性键。
非金属元素之间
活泼金属与非金属元素之间
阳离子
~
阴离子
原子
~原子
静电作用
离子电荷数多、半径小的键强
原子半径小键强
共用电子对
离子键和共价键的比较
只存于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
比
较
离子键
共价键
成键元素
成键微粒
成键本质
键的强弱
键的存在
联系:两者并无绝对严格的界限,可把离子键看做极性键增强的极限;把非极性键看做是极性键减弱的极限;而把极性键看做时非极性键与离子键的过度状态。
键极性对性质的影响(了解)
极性由强到弱
非极性
→
键极性键
→离子键
水中的电离
难
→
有的可电离→电离
熔融状态时电离
难
→
难
→
电离
显然区分离子化合物与共价化合物的最佳方法是:???
共
价
键
12
化学键与物质类别之间的关系规律
化学键
定义:使离子相结合或原子相结合的作用力通称为化学键。
化学反应的实质:反应物分子内化学键的断裂和产物分子中化学键的形成。
旧键的断裂和新键的形成
复习
下列哪一种元素的原子既能与其它元素的原子形成离子键或极性共价键,又能彼此结合形成非极性共价键
(
)
(A)Na
(B)Ne
(C)Cl
(D)O
能彼此结合形成非极性共价键的,是非金属元素。
NaCl
H-Cl
Cl-Cl
C
D
Na2O
H-O-H
O2
二氧化碳的电子式或结构式错误的是(
)
O=C=O
O-C-O
(A)
(B)
(C)
(D)
A
C
碳氧双键
次氯酸的电子式或结构式错误的是(
)
H-O-Cl
(A)
(B)
(C)
(D)
A
D
含氧酸都是共价化合物,不是离子化合物。
题型一
共价键辨认
【例1】下列化合物中所有化学键都是共价键的是
(
)
A.Na2O2
B.NaOH
C.BaCl2
D.CCl4
D
【解析】A、B中均有离子键和共价键,C中只有离子键。
1.某元素的原子核最外电子层上只有1个电子,它跟卤族化合时,可形成的化学键是
(
)
A.一定是离子键
B.一定是共价键
C.可能是离子键,也可能是共价键
D.上述说法都不正确
对应训练
C
A
D
C
1、下列说法中正确的是(
)
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中可能含有共价键
2、下列物质中含有共价键的离子化合物是(
)
A.Ba(OH)2
B.CaCl2
C.H2O
D.H2
AD
A
牛刀小试:
3
写出下列物质的电子式:
CH4、
NaOH、
Na2O2、
NH4+、
H3O+、
Ar、
Mg2+、
NH4Cl、
HClO
