高中化学鲁科版 必修1 4.2 铝 金属材料 金属铝的性质(共20张PPT)
文档属性
| 名称 | 高中化学鲁科版 必修1 4.2 铝 金属材料 金属铝的性质(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-26 23:01:07 | ||
图片预览








文档简介
(共20张PPT)
4-3-1
金属铝的性质
鲁科版
化学1(必修)
崇德
尚志
求实
开拓
你在日常生活中见到过哪些铝制品?
想一想
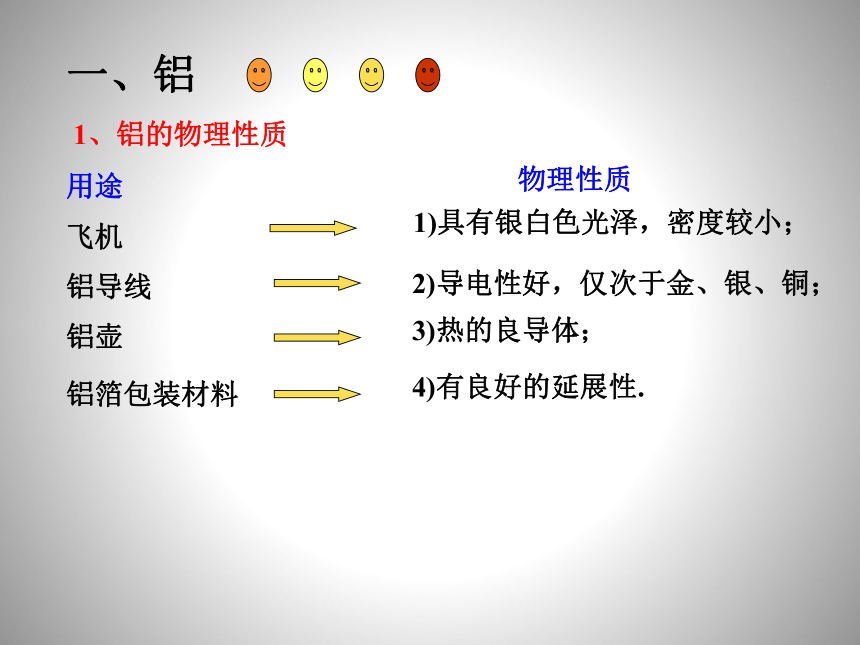
1、铝的物理性质
物理性质
用途
飞机
铝导线
铝壶
铝箔包装材料
金属单质的基本性质
和非金属单质反应
发生置换反应
和酸反应
金属
Al
还原性
实验一:铝与氧气的反应
实验1:铝在氧气中燃烧
剧烈燃烧,放出大量的热和耀眼的白光
铝与氧气反应
实验内容
实验现象
结论
用途:制燃烧弹、信号弹、火箭推进剂等
将5g三氧化二铁粉末和2g铝粉混合均匀放在
“纸漏斗”中,上面加少量氯酸钾并在混合物中插一根镁条,点燃镁条观察发生的现象。
药品:Fe2O3、Al粉、镁条、氯酸钾
实验2:铝热反应
现象:火星四射,发出耀眼的光芒,有黑色熔融物生成,放出大量的热。
演示实验
1、引发此反应的操作是什么?
2、镁条、氯酸钾在这个反应中起什么作用?
3、该反应的条件是什么?
点燃镁条
引燃剂,
高温
4、此反应是放热反应还是吸热反应?
5、此反应属于什么反应类型?
6、铝和氧化镁是否反应?
放热反应
置换反应
否
助燃剂,
2Al
+
Fe2O3
====
2Fe
+
Al2O3
铝热剂
高温
反应方程式:
该反应叫铝热反应
铝热反应的原理?
Al在高温下表现出强还原性,把某些金属从它的氧化物中置换出来。
铝热反应用途
①冶炼难熔的金属
②焊接钢轨
铝与盐溶液反应
根据金属活动性顺序的应用,铝能把排在它后面的金属从它们的盐溶液中置换出来,如:
2Al+3CuSO4
====3Cu+Al2(SO4)3
2Al+3Cu2+====3Cu+2Al3+
1、为什么铝制餐具不宜蒸煮或长期存放有酸性或碱性的食物?
Al能与酸或碱起反应
和非金属单质反应
发生置换反应
和酸反应
金属
Al
还原性
实验3:铝与盐酸的反应
(
)
×2
铝与氢氧化钠反应是多步反应的结果:
2Al+6H2O+2NaOH==2
Na[
Al(OH)4
]+3H2↑
Al(OH)3+NaOH==
Na[
Al(OH)4
]
2Al+6H2O==2Al(OH)3+3H2↑
反应的机理:
+
2Al+2NaOH+6H2O=2
Na[
Al(OH)4
]
+3H2↑
实验4、与碱反应
氧化剂
还原剂
铝单质是不是与任何酸都可以发生反应并生成氢气?
联想·质疑
铝在冷的浓硫酸、浓硝酸中发生钝化
铝单质是不是与任何酸都可以发生反应并生成?
联想·质疑
铝在冷的浓硫酸、浓硝酸中发生钝化
1、对于铝和烧碱溶液的反应,下列说法不正确的(
)
A、铝是还原剂
B、H2O是氧化剂
C、该反应说明所有金属都能与碱反应
D、铝与强碱或酸反应能产生氢气
2、两份铝屑,一份与过量HCl溶液反应,另一份与过量
NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的
质量比为(
)
A、1:1
B、1:2
C、1:3
D、2:1
C
B
4-3-1
金属铝的性质
鲁科版
化学1(必修)
崇德
尚志
求实
开拓
你在日常生活中见到过哪些铝制品?
想一想
1、铝的物理性质
物理性质
用途
飞机
铝导线
铝壶
铝箔包装材料
金属单质的基本性质
和非金属单质反应
发生置换反应
和酸反应
金属
Al
还原性
实验一:铝与氧气的反应
实验1:铝在氧气中燃烧
剧烈燃烧,放出大量的热和耀眼的白光
铝与氧气反应
实验内容
实验现象
结论
用途:制燃烧弹、信号弹、火箭推进剂等
将5g三氧化二铁粉末和2g铝粉混合均匀放在
“纸漏斗”中,上面加少量氯酸钾并在混合物中插一根镁条,点燃镁条观察发生的现象。
药品:Fe2O3、Al粉、镁条、氯酸钾
实验2:铝热反应
现象:火星四射,发出耀眼的光芒,有黑色熔融物生成,放出大量的热。
演示实验
1、引发此反应的操作是什么?
2、镁条、氯酸钾在这个反应中起什么作用?
3、该反应的条件是什么?
点燃镁条
引燃剂,
高温
4、此反应是放热反应还是吸热反应?
5、此反应属于什么反应类型?
6、铝和氧化镁是否反应?
放热反应
置换反应
否
助燃剂,
2Al
+
Fe2O3
====
2Fe
+
Al2O3
铝热剂
高温
反应方程式:
该反应叫铝热反应
铝热反应的原理?
Al在高温下表现出强还原性,把某些金属从它的氧化物中置换出来。
铝热反应用途
①冶炼难熔的金属
②焊接钢轨
铝与盐溶液反应
根据金属活动性顺序的应用,铝能把排在它后面的金属从它们的盐溶液中置换出来,如:
2Al+3CuSO4
====3Cu+Al2(SO4)3
2Al+3Cu2+====3Cu+2Al3+
1、为什么铝制餐具不宜蒸煮或长期存放有酸性或碱性的食物?
Al能与酸或碱起反应
和非金属单质反应
发生置换反应
和酸反应
金属
Al
还原性
实验3:铝与盐酸的反应
(
)
×2
铝与氢氧化钠反应是多步反应的结果:
2Al+6H2O+2NaOH==2
Na[
Al(OH)4
]+3H2↑
Al(OH)3+NaOH==
Na[
Al(OH)4
]
2Al+6H2O==2Al(OH)3+3H2↑
反应的机理:
+
2Al+2NaOH+6H2O=2
Na[
Al(OH)4
]
+3H2↑
实验4、与碱反应
氧化剂
还原剂
铝单质是不是与任何酸都可以发生反应并生成氢气?
联想·质疑
铝在冷的浓硫酸、浓硝酸中发生钝化
铝单质是不是与任何酸都可以发生反应并生成?
联想·质疑
铝在冷的浓硫酸、浓硝酸中发生钝化
1、对于铝和烧碱溶液的反应,下列说法不正确的(
)
A、铝是还原剂
B、H2O是氧化剂
C、该反应说明所有金属都能与碱反应
D、铝与强碱或酸反应能产生氢气
2、两份铝屑,一份与过量HCl溶液反应,另一份与过量
NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的
质量比为(
)
A、1:1
B、1:2
C、1:3
D、2:1
C
B
