人教五四学制版九年级化学:第三单元 酸和碱 复习课(共16张PPT)
文档属性
| 名称 | 人教五四学制版九年级化学:第三单元 酸和碱 复习课(共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 434.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-27 17:46:27 | ||
图片预览




文档简介
(共16张PPT)
酸碱
复习课
指出下列物质中那些是酸?那些是碱?
1、NaOH
2、
CaCO3
3、
HCl
4、H2O2
5、Na2CO3
6、Ca(OH)2
7、H2SO4
酸:HCl
H2SO4
碱:NaOH
Ca(OH)2
酸:在水溶液中解离时,生成的阳离子全部是氢离子的化合物
碱:在水溶液中解离时,生成的阴离子全部是氢氧根离子的化合物
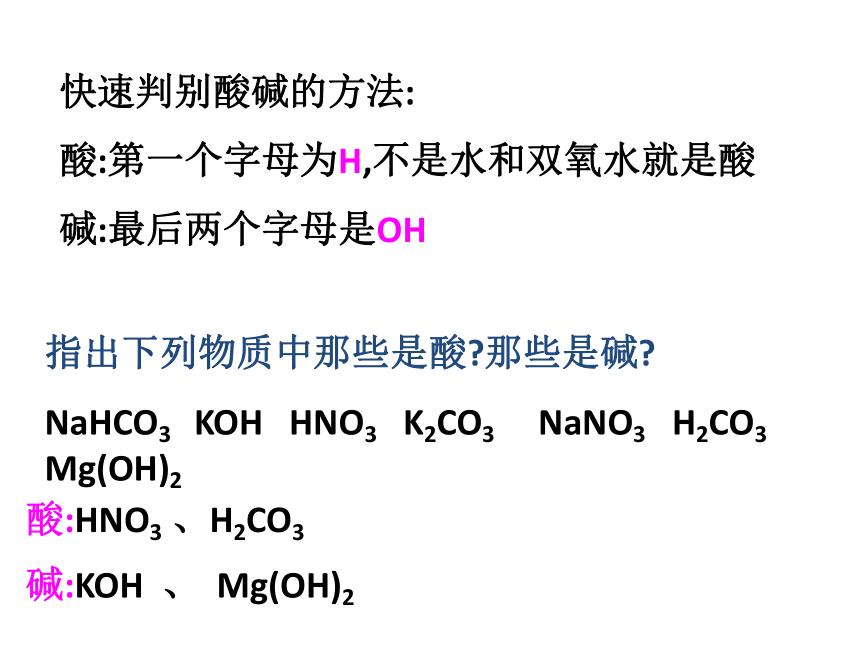
快速判别酸碱的方法:
酸:第一个字母为H,不是水和双氧水就是酸
碱:最后两个字母是OH
指出下列物质中那些是酸?那些是碱?
NaHCO3
KOH
HNO3
K2CO3
NaNO3
H2CO3
Mg(OH)2
酸:HNO3
、H2CO3
碱:KOH
、
Mg(OH)2
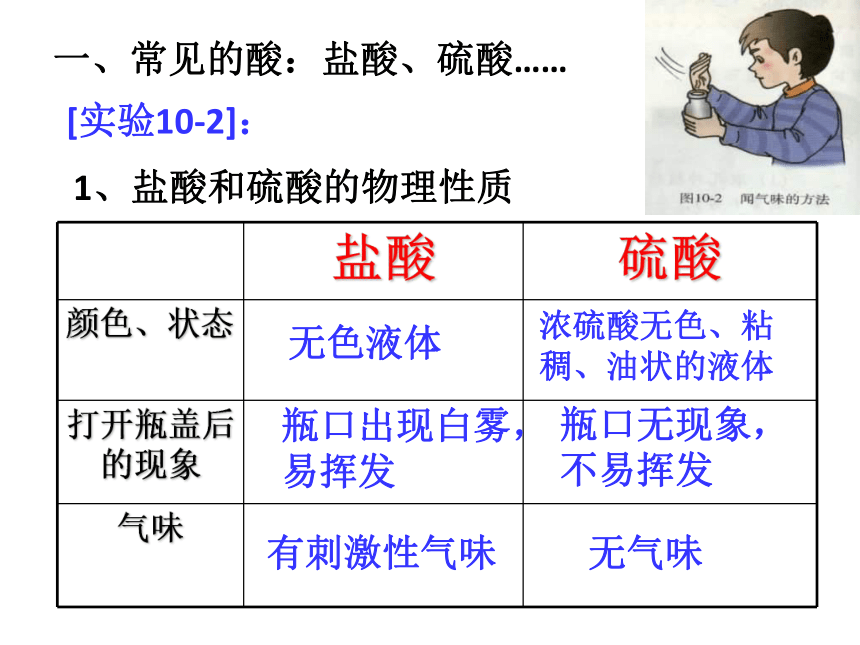
一、常见的酸:盐酸、硫酸……
[实验10-2]:
无色液体
瓶口出现白雾,易挥发
有刺激性气味
浓硫酸无色、粘稠、油状的液体
瓶口无现象,不易挥发
无气味
1、盐酸和硫酸的物理性质
盐酸
硫酸
颜色、状态
打开瓶盖后的现象
气味
[想一想]
分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),两瓶酸的质量、质量分数各有何变化?应如何保存?
(1)、酸能使酸碱指示剂显示不同的颜色;
(2)、酸能与多种活泼金属反应,生成氢气
(3)、酸能与某些金属氧化物反应,生成水。
规律:酸能使石蕊试液变红色,酚酞试液不变色
规律:氢前金属
+
酸
=
金属化合物
+
氢气↑
规律:金属氧化物
+
酸
=
金属化合物
+
水
知识回顾
酸类有哪些相似的化学性质?
Fe
+
2HCl
=
FeCl2
+
H2↑
CuO
+
H2SO4
=
CuSO4
+
H2
O
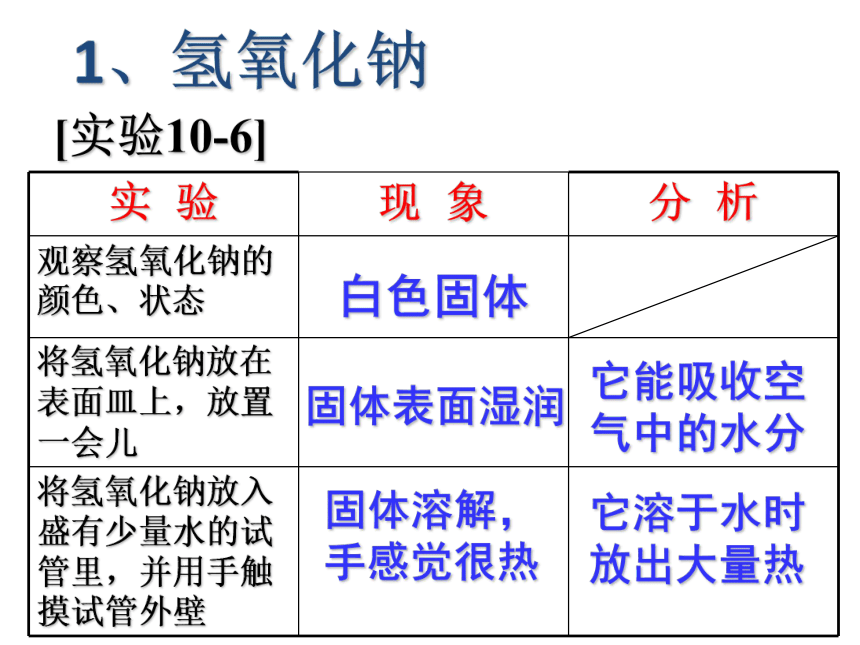
[实验10-6]
1、氢氧化钠
白色固体
固体表面湿润
它能吸收空气中的水分
固体溶解,手感觉很热
它溶于水时放出大量热
实
验
现
象
分
析
观察氢氧化钠的颜色、状态
将氢氧化钠放在表面皿上,放置一会儿
将氢氧化钠放入盛有少量水的试管里,并用手触摸试管外壁
2、氢氧化钙
[实验10-8]
现象:部分溶解,放出大量的热
CaO
+
H2O
=
Ca(OH)2
俗名:熟石灰、消石灰
其他常见碱:氢氧化钾
KOH
氨水
NH3?H2O
生石灰
熟石灰
碱类有哪些相似的化学性质?
(1)、碱能使酸碱指示剂显示不同的颜色
(2)、碱能与某些非金属氧化物反应,生成水
规律:碱能使石蕊试液变蓝色,酚酞试液变红色
规律:非金属氧化物
+
碱
=
金属化合物
+
水
CO2
+
Ca(OH)2
=
CaCO3↓
+
H2O
SO3
+
2NaOH
=
Na2SO4
+
H2O
知识回顾
课
题
2
酸和碱之间会发生什么反应
[实验10-8]在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。
提出问题:
酸和碱之间会发生反应吗?
实验验证:
稀盐酸与氢氧化钠溶液直接混合
观察现象:
无明显现象
得出结论:
没有结论
你能设计出可行的方案证明酸和碱之间发生了反应吗?
发生化学变化时常伴有颜色变化、放出气体、生成沉定、能量的变化(放热、吸热、发光)等
实验现象:
得出结论:
为什么要加入酚酞指示剂?
借以判断反应有无发生
什么时候酸和碱恰好完全反应?
溶液刚好由红色变为无色
溶液由红色变为无色
酸和碱能反应
1、为什么NaOH和HCl会反应?
2、反应后生成什么?
3、反应前后溶液中离子发生了怎样的变化?
重新组合
微观世界
氢氧化钠与盐酸反应的本质:酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。
酸溶液与碱溶液的反应实质是酸溶液中的氢离子与碱中的氢氧根离子结合生成了水。
中和反应实质:H++OH-
=H2O
HCl
+
NaOH
=
NaCl
+
H2O
酸
+
碱
→
盐
+
水
中和反应:酸和碱作用生成盐和水的反应
练一练
1.下列反应中属于中和反应的是(
)
A.Zn
+
2HCl
ZnCl2
+H2↑
B.CuO
+
2HCl
CuCl2+
H2O
C.Ba(OH)2+
H2SO4
BaSO4
↓+
2H2O
D.
AgNO3+HCl
AgCl↓
+HNO3
C
●改良酸性土壤
●处理工厂废水
●用于医药
◆中和胃酸
◆防蚊虫叮咬
酸碱
复习课
指出下列物质中那些是酸?那些是碱?
1、NaOH
2、
CaCO3
3、
HCl
4、H2O2
5、Na2CO3
6、Ca(OH)2
7、H2SO4
酸:HCl
H2SO4
碱:NaOH
Ca(OH)2
酸:在水溶液中解离时,生成的阳离子全部是氢离子的化合物
碱:在水溶液中解离时,生成的阴离子全部是氢氧根离子的化合物
快速判别酸碱的方法:
酸:第一个字母为H,不是水和双氧水就是酸
碱:最后两个字母是OH
指出下列物质中那些是酸?那些是碱?
NaHCO3
KOH
HNO3
K2CO3
NaNO3
H2CO3
Mg(OH)2
酸:HNO3
、H2CO3
碱:KOH
、
Mg(OH)2
一、常见的酸:盐酸、硫酸……
[实验10-2]:
无色液体
瓶口出现白雾,易挥发
有刺激性气味
浓硫酸无色、粘稠、油状的液体
瓶口无现象,不易挥发
无气味
1、盐酸和硫酸的物理性质
盐酸
硫酸
颜色、状态
打开瓶盖后的现象
气味
[想一想]
分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),两瓶酸的质量、质量分数各有何变化?应如何保存?
(1)、酸能使酸碱指示剂显示不同的颜色;
(2)、酸能与多种活泼金属反应,生成氢气
(3)、酸能与某些金属氧化物反应,生成水。
规律:酸能使石蕊试液变红色,酚酞试液不变色
规律:氢前金属
+
酸
=
金属化合物
+
氢气↑
规律:金属氧化物
+
酸
=
金属化合物
+
水
知识回顾
酸类有哪些相似的化学性质?
Fe
+
2HCl
=
FeCl2
+
H2↑
CuO
+
H2SO4
=
CuSO4
+
H2
O
[实验10-6]
1、氢氧化钠
白色固体
固体表面湿润
它能吸收空气中的水分
固体溶解,手感觉很热
它溶于水时放出大量热
实
验
现
象
分
析
观察氢氧化钠的颜色、状态
将氢氧化钠放在表面皿上,放置一会儿
将氢氧化钠放入盛有少量水的试管里,并用手触摸试管外壁
2、氢氧化钙
[实验10-8]
现象:部分溶解,放出大量的热
CaO
+
H2O
=
Ca(OH)2
俗名:熟石灰、消石灰
其他常见碱:氢氧化钾
KOH
氨水
NH3?H2O
生石灰
熟石灰
碱类有哪些相似的化学性质?
(1)、碱能使酸碱指示剂显示不同的颜色
(2)、碱能与某些非金属氧化物反应,生成水
规律:碱能使石蕊试液变蓝色,酚酞试液变红色
规律:非金属氧化物
+
碱
=
金属化合物
+
水
CO2
+
Ca(OH)2
=
CaCO3↓
+
H2O
SO3
+
2NaOH
=
Na2SO4
+
H2O
知识回顾
课
题
2
酸和碱之间会发生什么反应
[实验10-8]在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。
提出问题:
酸和碱之间会发生反应吗?
实验验证:
稀盐酸与氢氧化钠溶液直接混合
观察现象:
无明显现象
得出结论:
没有结论
你能设计出可行的方案证明酸和碱之间发生了反应吗?
发生化学变化时常伴有颜色变化、放出气体、生成沉定、能量的变化(放热、吸热、发光)等
实验现象:
得出结论:
为什么要加入酚酞指示剂?
借以判断反应有无发生
什么时候酸和碱恰好完全反应?
溶液刚好由红色变为无色
溶液由红色变为无色
酸和碱能反应
1、为什么NaOH和HCl会反应?
2、反应后生成什么?
3、反应前后溶液中离子发生了怎样的变化?
重新组合
微观世界
氢氧化钠与盐酸反应的本质:酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。
酸溶液与碱溶液的反应实质是酸溶液中的氢离子与碱中的氢氧根离子结合生成了水。
中和反应实质:H++OH-
=H2O
HCl
+
NaOH
=
NaCl
+
H2O
酸
+
碱
→
盐
+
水
中和反应:酸和碱作用生成盐和水的反应
练一练
1.下列反应中属于中和反应的是(
)
A.Zn
+
2HCl
ZnCl2
+H2↑
B.CuO
+
2HCl
CuCl2+
H2O
C.Ba(OH)2+
H2SO4
BaSO4
↓+
2H2O
D.
AgNO3+HCl
AgCl↓
+HNO3
C
●改良酸性土壤
●处理工厂废水
●用于医药
◆中和胃酸
◆防蚊虫叮咬
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
