第四单元 分子间作用力 分子晶体 氢键的形成 课件(31张PPT)
文档属性
| 名称 | 第四单元 分子间作用力 分子晶体 氢键的形成 课件(31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-28 14:26:43 | ||
图片预览








文档简介
(共31张PPT)
氢键的形成
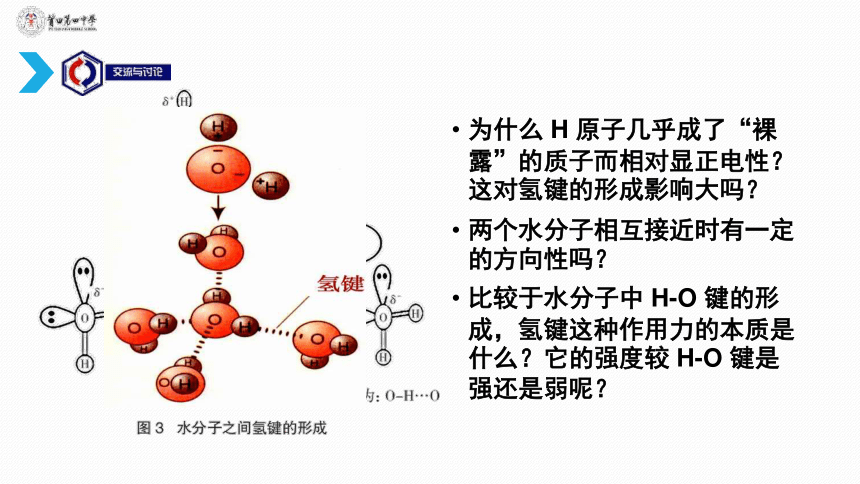
(1)为什么第ⅣA
族元素氢化物的沸点逐渐升高呢?
(2)第ⅥA
族元素氢化物沸点也会逐渐升高吗?
从相对分子质量对分子间作用力影响的角度分析,应该是水的沸点比
H2S的沸点低,水的沸点“异常”说明了什么?
为什么
H
原子几乎成了“裸露”的质子而相对显正电性?这对氢键的形成影响大吗?
两个水分子相互接近时有一定的方向性吗?
比较于水分子中
H-O
键的形成,氢键这种作用力的本质是什么?它的强度较
H-O
键是强还是弱呢?
在H2O分子中,由于O原子吸引电子的能力很强,H—O键的极性很强,共用电子对强烈地偏向O原子,亦即H原子的电子云被O原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,与另一个H2O分子带部分负电荷的O原子相互吸引。这种静电吸引作用就是氢键。
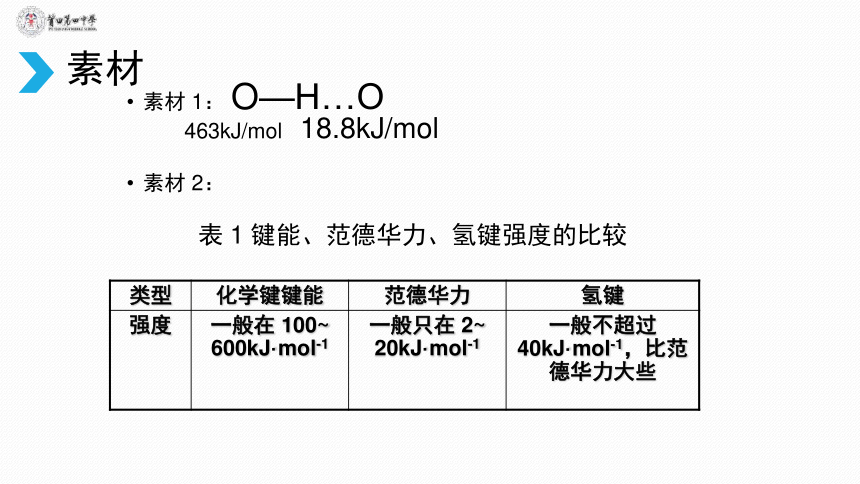
素材
素材
1:
O—H…O
463kJ/mol
18.8kJ/mol
素材
2:
表
1
键能、范德华力、氢键强度的比较
类型
化学键键能
范德华力
氢键
强度
一般在
100~
600kJ·mol-1
一般只在
2~
20kJ·mol-1
一般不超过
40kJ·mol-1,比范德华力大些
小结:
1.
氢键的本质:静电作用
2.
氢键的强度:比范德华力大一些,比化学键小得多,不属于化学键
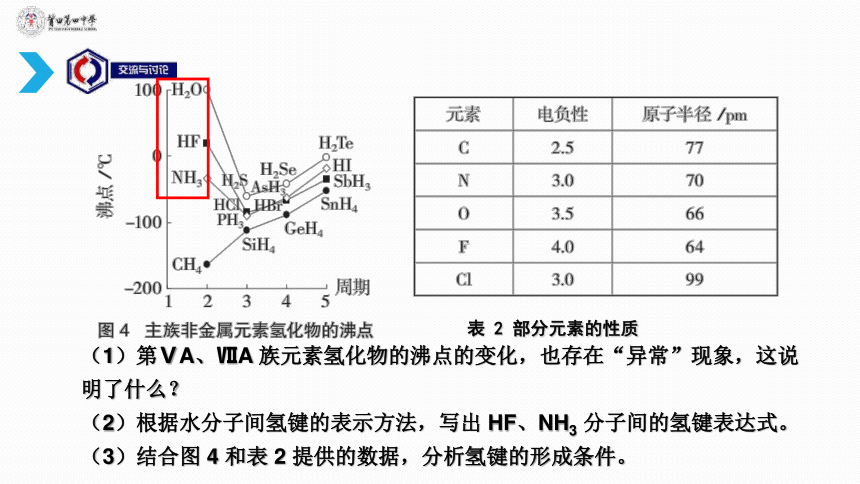
表
2
部分元素的性质
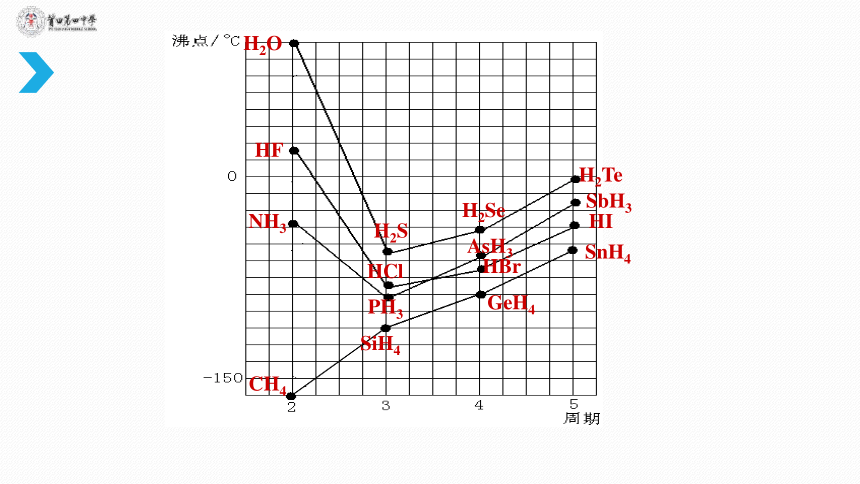
(1)第ⅤA、ⅦA
族元素氢化物的沸点的变化,也存在“异常”现象,这说明了什么?
(2)根据水分子间氢键的表示方法,写出
HF、NH3
分子间的氢键表达式。
(3)结合图
4
和表
2
提供的数据,分析氢键的形成条件。
小结
(1)氢键的表示方法:X—H…Y
(2)氢键的形成条件:在
X—H…Y,X、Y
都是电负性大、半径较小的原子。
[
练习
]
1.下列哪些分子之间可能存在氢键呢?你还能列举出哪些?
A.
H-O-O-H(H2
O2
)
B.
CH3-CH2-OH
C.
CH4
D.
CH3COOH
E.
HOOC-CH2-
NH2
2.CH3CH2OH与H2O之间能形成氢键吗?你是怎样判断的?
已知:
邻羟基苯甲醛
熔点:
2℃
沸点:
196.5℃
对羟基苯甲醛
熔点:
115℃
沸点:
250℃
(1)从组成和结构上看这两种物质属于什么关系?
(2)请从它们的结构特点分析它们所形成氢键的不同以及导致两者熔点差异的原因。
小结
同一分子
不同分子
氢键的类型
分子内氢键
分子间氢键
教科书
P56
1.请解释物质的下列性质:
(1)NH3极易溶于水。
(2)氟化氢的熔点比氯化氢的高。
2.根据硝酸和醋酸熔、沸点差异较大的事实,分析它们可能含有的氢键,并与同学交流讨论。
氢键对物质性质的影响
①对熔点和沸点的影响
分子间形成氢键会导致物质的熔沸点
升高
分子内形成氢键则会导致物质的熔沸点
降低
②对溶解度的影响
溶质分子与溶剂分子之间形成氢键使溶解度增大。
冰晶体中的氢键
水分子间形成的氢键
在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
水分子间形成的氢键
在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
2013中国科学院的绍兴籍科学家裘晓辉和他的队友们运用原子力显微镜,首次成功捕捉到了氢键的图像。左图为《自然》杂志评选的年度图片。(图中加了黄色标示的即为氢键)
氢键的高清晰照片能帮助科学家理解其本质,进而为控制氢键、利用氢键奠定基础。在此基础上,我们未来有可能人工影响或控制水、DNA和蛋白质的结构,生命体和我们生活的环境也有可能因此而改变。如支撑DNA双螺旋结构的就是氢键,氢键还能解开和复制,在生命遗传中起到非常重要的作用。
蛋白质分子中的氢键(图中虚线表示氢键)
DNA双螺旋是通过氢键使它们的碱基(A…T
和C…G)
相互配对形成的(图中虚线表示氢键)
问题讨论
(1)如果液态水的分子之间没有形成氢键,如果冰中的分子之间没有氢键,那么水的沸点和冰的密度将会发生怎样的变化?这种变化对地球的生命会产生什么样的影响?
(2)DNA
分子中有几种不同的氢键,如果
DNA
大分子碱基没有通过氢键形成配对,那么对遗传信息会产生怎样的影响?
化学键、氢键和范德华力的比较
化学键
氢
键
范德华力
概
念
范
围
能
量
性质影响
化学键、氢键和范德华力的比较
物质分子间存在的微弱相互作用
分子间
比化学键弱得多
随范德华力的增大,物质的熔沸点升高、溶解度增大
比化学键弱得多,比范德华力稍强
分子中含有与H原子相结合的原子半径小、电负性大、有孤对电子的F、O、N
分子间(内)电负性较大的成键原子通过H原子而形成的静电作用
分子间氢键使物质熔沸点升高硬度增大、水中溶解度增大
分子内氢键使物质熔沸点降低、硬度减小
影响物质的化学性质和物理性质
相邻的原子或离子之间的强烈的相互作用。
原子或离子
很强烈,克服它需要较高的能量
化学键
氢
键
范德华力
概
念
范
围
强度比较
性质影响
1.下列物质中不存在氢键的是
(
)
A.冰醋酸中醋酸分子之间
B.一水合氨分子中的氨分子与水分子之间
C.液态氟化氢中氟化氢分子之间
D.可燃冰(CH4·8H2O)中甲烷分子与水
分子之间
D
练
习
练
习
2.固体乙醇晶体中不存在的作用力是
A.极性键
B.非极性键
C.离子键
D.氢键
3.下列有关水的叙述中,可以用氢键的知
识来解释的是
A.水比硫化氢气体稳定
B.水的熔沸点比硫化氢的高
C.氯化氢气体易溶于水
D.0℃时,水的密度比冰大
C
BD
氢键的形成
(1)为什么第ⅣA
族元素氢化物的沸点逐渐升高呢?
(2)第ⅥA
族元素氢化物沸点也会逐渐升高吗?
从相对分子质量对分子间作用力影响的角度分析,应该是水的沸点比
H2S的沸点低,水的沸点“异常”说明了什么?
为什么
H
原子几乎成了“裸露”的质子而相对显正电性?这对氢键的形成影响大吗?
两个水分子相互接近时有一定的方向性吗?
比较于水分子中
H-O
键的形成,氢键这种作用力的本质是什么?它的强度较
H-O
键是强还是弱呢?
在H2O分子中,由于O原子吸引电子的能力很强,H—O键的极性很强,共用电子对强烈地偏向O原子,亦即H原子的电子云被O原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,与另一个H2O分子带部分负电荷的O原子相互吸引。这种静电吸引作用就是氢键。
素材
素材
1:
O—H…O
463kJ/mol
18.8kJ/mol
素材
2:
表
1
键能、范德华力、氢键强度的比较
类型
化学键键能
范德华力
氢键
强度
一般在
100~
600kJ·mol-1
一般只在
2~
20kJ·mol-1
一般不超过
40kJ·mol-1,比范德华力大些
小结:
1.
氢键的本质:静电作用
2.
氢键的强度:比范德华力大一些,比化学键小得多,不属于化学键
表
2
部分元素的性质
(1)第ⅤA、ⅦA
族元素氢化物的沸点的变化,也存在“异常”现象,这说明了什么?
(2)根据水分子间氢键的表示方法,写出
HF、NH3
分子间的氢键表达式。
(3)结合图
4
和表
2
提供的数据,分析氢键的形成条件。
小结
(1)氢键的表示方法:X—H…Y
(2)氢键的形成条件:在
X—H…Y,X、Y
都是电负性大、半径较小的原子。
[
练习
]
1.下列哪些分子之间可能存在氢键呢?你还能列举出哪些?
A.
H-O-O-H(H2
O2
)
B.
CH3-CH2-OH
C.
CH4
D.
CH3COOH
E.
HOOC-CH2-
NH2
2.CH3CH2OH与H2O之间能形成氢键吗?你是怎样判断的?
已知:
邻羟基苯甲醛
熔点:
2℃
沸点:
196.5℃
对羟基苯甲醛
熔点:
115℃
沸点:
250℃
(1)从组成和结构上看这两种物质属于什么关系?
(2)请从它们的结构特点分析它们所形成氢键的不同以及导致两者熔点差异的原因。
小结
同一分子
不同分子
氢键的类型
分子内氢键
分子间氢键
教科书
P56
1.请解释物质的下列性质:
(1)NH3极易溶于水。
(2)氟化氢的熔点比氯化氢的高。
2.根据硝酸和醋酸熔、沸点差异较大的事实,分析它们可能含有的氢键,并与同学交流讨论。
氢键对物质性质的影响
①对熔点和沸点的影响
分子间形成氢键会导致物质的熔沸点
升高
分子内形成氢键则会导致物质的熔沸点
降低
②对溶解度的影响
溶质分子与溶剂分子之间形成氢键使溶解度增大。
冰晶体中的氢键
水分子间形成的氢键
在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
水分子间形成的氢键
在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
2013中国科学院的绍兴籍科学家裘晓辉和他的队友们运用原子力显微镜,首次成功捕捉到了氢键的图像。左图为《自然》杂志评选的年度图片。(图中加了黄色标示的即为氢键)
氢键的高清晰照片能帮助科学家理解其本质,进而为控制氢键、利用氢键奠定基础。在此基础上,我们未来有可能人工影响或控制水、DNA和蛋白质的结构,生命体和我们生活的环境也有可能因此而改变。如支撑DNA双螺旋结构的就是氢键,氢键还能解开和复制,在生命遗传中起到非常重要的作用。
蛋白质分子中的氢键(图中虚线表示氢键)
DNA双螺旋是通过氢键使它们的碱基(A…T
和C…G)
相互配对形成的(图中虚线表示氢键)
问题讨论
(1)如果液态水的分子之间没有形成氢键,如果冰中的分子之间没有氢键,那么水的沸点和冰的密度将会发生怎样的变化?这种变化对地球的生命会产生什么样的影响?
(2)DNA
分子中有几种不同的氢键,如果
DNA
大分子碱基没有通过氢键形成配对,那么对遗传信息会产生怎样的影响?
化学键、氢键和范德华力的比较
化学键
氢
键
范德华力
概
念
范
围
能
量
性质影响
化学键、氢键和范德华力的比较
物质分子间存在的微弱相互作用
分子间
比化学键弱得多
随范德华力的增大,物质的熔沸点升高、溶解度增大
比化学键弱得多,比范德华力稍强
分子中含有与H原子相结合的原子半径小、电负性大、有孤对电子的F、O、N
分子间(内)电负性较大的成键原子通过H原子而形成的静电作用
分子间氢键使物质熔沸点升高硬度增大、水中溶解度增大
分子内氢键使物质熔沸点降低、硬度减小
影响物质的化学性质和物理性质
相邻的原子或离子之间的强烈的相互作用。
原子或离子
很强烈,克服它需要较高的能量
化学键
氢
键
范德华力
概
念
范
围
强度比较
性质影响
1.下列物质中不存在氢键的是
(
)
A.冰醋酸中醋酸分子之间
B.一水合氨分子中的氨分子与水分子之间
C.液态氟化氢中氟化氢分子之间
D.可燃冰(CH4·8H2O)中甲烷分子与水
分子之间
D
练
习
练
习
2.固体乙醇晶体中不存在的作用力是
A.极性键
B.非极性键
C.离子键
D.氢键
3.下列有关水的叙述中,可以用氢键的知
识来解释的是
A.水比硫化氢气体稳定
B.水的熔沸点比硫化氢的高
C.氯化氢气体易溶于水
D.0℃时,水的密度比冰大
C
BD
