第一单元 分子构型与物质的性质 分子的空间构型 课件(18张PPT)
文档属性
| 名称 | 第一单元 分子构型与物质的性质 分子的空间构型 课件(18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-28 14:37:32 | ||
图片预览

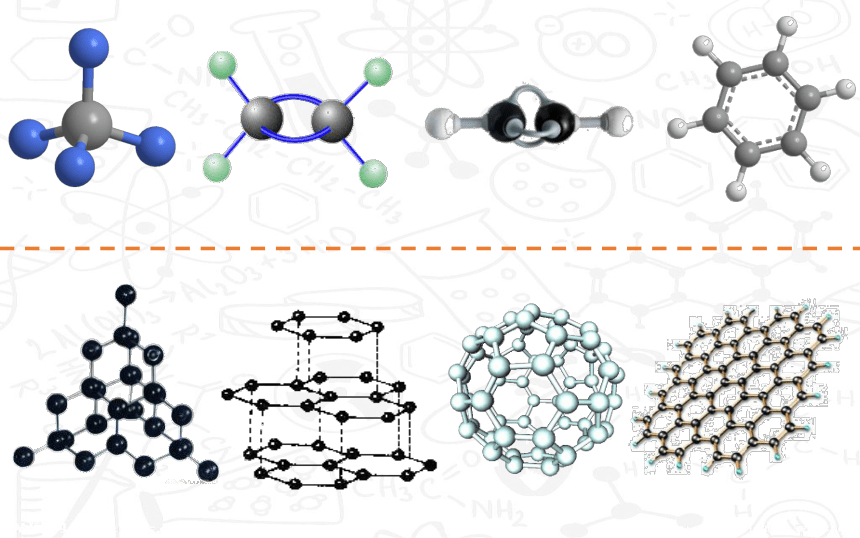



文档简介
(共18张PPT)
苏教版选修3《物质结构与性质》
专题4 第一单元 分子构型与物质的性质
分子的空间构型
C:2s22p2
2s
2p
C的基态
2s
2p
激发态
sp3 杂化态
激发
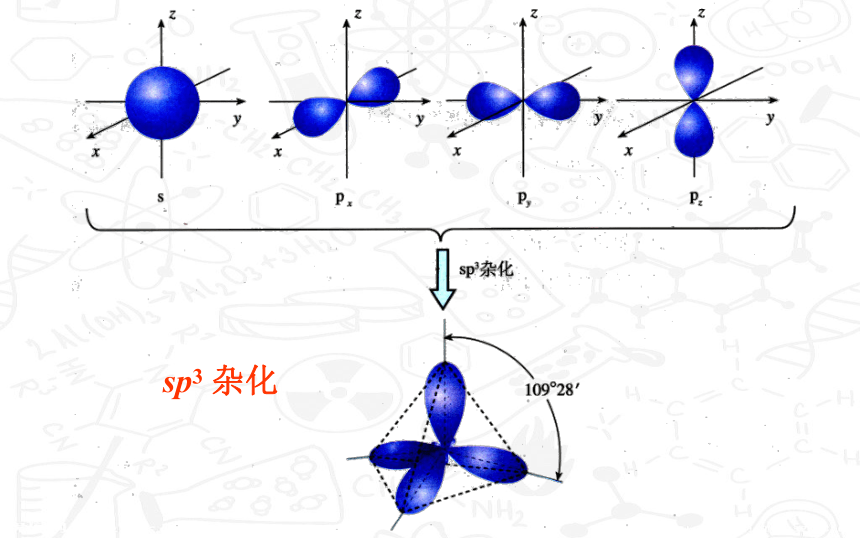
CH4分子的形成
sp3 杂化
1954年获诺贝尔化学奖
1962年获诺贝尔和平奖
美国化学家 鲍林
杂化及杂化轨道
指不同类型能量相近的原子轨道,在形成分子的成键过程中重新组合成一系列能量相等的新的轨道。这种轨道重新组合的过程叫杂化,所形成的新轨道称为杂化轨道。
基本要点:
① 能级相近的价电子轨道混合杂化
② 杂化前后轨道数目不变
③ 杂化后轨道伸展方向,形状发生改变
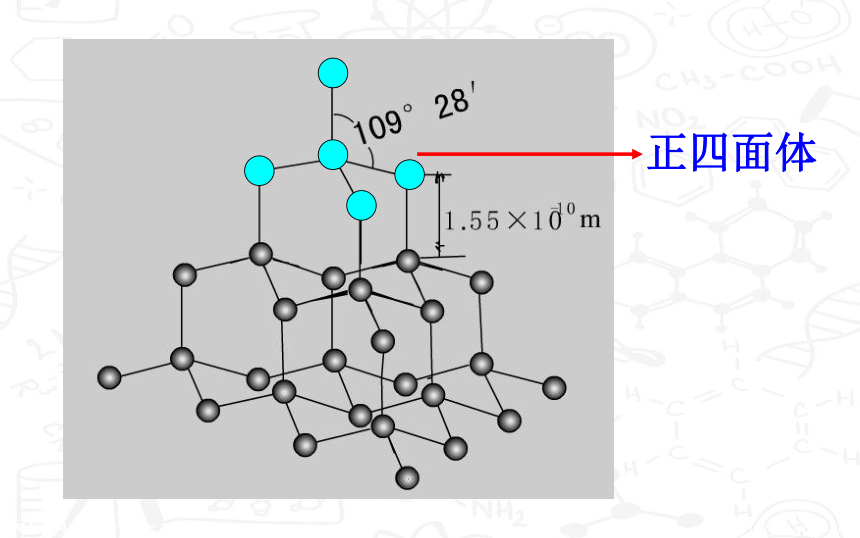
正四面体
【课堂练习1】分析甲硅烷(SiH4)的结构
甲硅烷(SiH4)的结构与甲烷相似。SiH4分子中Si的杂化方式是 ;H原子的1s轨道与Si原子的 轨道重叠形成Si—H σ键。
SP3杂化
SP3杂化
C:2s22p2
2s
2p
C的基态
2s
2p
激发态
sp2 杂化
激发
sp2 杂化
2p
C:2s22p2
2s
2p
C的基态
2s
2p
激发态
sp 杂化
激发
sp 杂化
2p
回
望
教
材
P46
页
【问题解决】试用杂化轨理论解释苯的结构
C
C
C
C
C
C
H
H
H
H
H
H
苯的结构
sp2杂化
【课堂练习2】分子中的大π键可用符号表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为。
吡咯
吡咯分子中的大π键可表示为 。
回
望
教
材
P59
页
石墨晶体
sp2杂化
【问题解决】试用杂化轨理论认识石墨的结构
杂化类型 SP SP2 SP3
参与杂化的原子轨道
杂化轨道数
杂化轨道间夹角
杂化轨道 空间构型
实 例
1个S 1个P
1个S 3个P
1个S 2个P
2个SP
3个SP2
4个SP3
180°
120°
109.5°
直线形
正三角形
正四面体
BeCl2 C2H2
BF3 C2H4
CH4 CCl4
课堂小结
苏教版选修3《物质结构与性质》
专题4 第一单元 分子构型与物质的性质
分子的空间构型
C:2s22p2
2s
2p
C的基态
2s
2p
激发态
sp3 杂化态
激发
CH4分子的形成
sp3 杂化
1954年获诺贝尔化学奖
1962年获诺贝尔和平奖
美国化学家 鲍林
杂化及杂化轨道
指不同类型能量相近的原子轨道,在形成分子的成键过程中重新组合成一系列能量相等的新的轨道。这种轨道重新组合的过程叫杂化,所形成的新轨道称为杂化轨道。
基本要点:
① 能级相近的价电子轨道混合杂化
② 杂化前后轨道数目不变
③ 杂化后轨道伸展方向,形状发生改变
正四面体
【课堂练习1】分析甲硅烷(SiH4)的结构
甲硅烷(SiH4)的结构与甲烷相似。SiH4分子中Si的杂化方式是 ;H原子的1s轨道与Si原子的 轨道重叠形成Si—H σ键。
SP3杂化
SP3杂化
C:2s22p2
2s
2p
C的基态
2s
2p
激发态
sp2 杂化
激发
sp2 杂化
2p
C:2s22p2
2s
2p
C的基态
2s
2p
激发态
sp 杂化
激发
sp 杂化
2p
回
望
教
材
P46
页
【问题解决】试用杂化轨理论解释苯的结构
C
C
C
C
C
C
H
H
H
H
H
H
苯的结构
sp2杂化
【课堂练习2】分子中的大π键可用符号表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为。
吡咯
吡咯分子中的大π键可表示为 。
回
望
教
材
P59
页
石墨晶体
sp2杂化
【问题解决】试用杂化轨理论认识石墨的结构
杂化类型 SP SP2 SP3
参与杂化的原子轨道
杂化轨道数
杂化轨道间夹角
杂化轨道 空间构型
实 例
1个S 1个P
1个S 3个P
1个S 2个P
2个SP
3个SP2
4个SP3
180°
120°
109.5°
直线形
正三角形
正四面体
BeCl2 C2H2
BF3 C2H4
CH4 CCl4
课堂小结
