高中化学鲁科版 选修四 2.3 化学反应速率(共26张PPT)
文档属性
| 名称 | 高中化学鲁科版 选修四 2.3 化学反应速率(共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-28 17:19:05 | ||
图片预览








文档简介
(共26张PPT)
瞧它们涉及的化学变化快慢相差很大耶!
瞬间完成
节
日
焰
火
牛
奶
变
质
35℃
半天变质
钢
铁
生
锈
潮湿空气中数周
溶
洞
几十万年
煤
的
形
成
千百万年
而且,要注意保存的温度及保质的期限哦!
①一次性快餐盒、聚乙烯等塑料制品分解需要几百年。
②汽车尾气NO、CO反应能生成N2、CO2,但汽车尾气中仍有NO、CO排放,因为反应太慢了
有的反应我们希望快一点好!
①橡胶老化,钢铁腐蚀;
②“云龙陛石”近几十年腐蚀加快;
③乐山大佛近几十年腐蚀特别严重。
有的反应我们希望慢一点好!
第二章第三节
第一课时
化学反应速率
学习目标
【知识与技能】
1.了解化学反应速率的概念及表示方法;
2.知道浓度、温度、催化剂等因素对化学反应速
率的影响;
3.初步了解如何调控化学反应的快慢,以及在生
产生活中的作用。
【过程与方法】
通过实验探究,总结影响化学反应速率的因素;
【情感态度价值观】
有参与化学科技活动的热情,将化学知识应用于
生产、生活实践的意识,能够对与化学有关的社
会和生活问题作出合理的判断。
有哪些条件会影响化学反应的快慢?
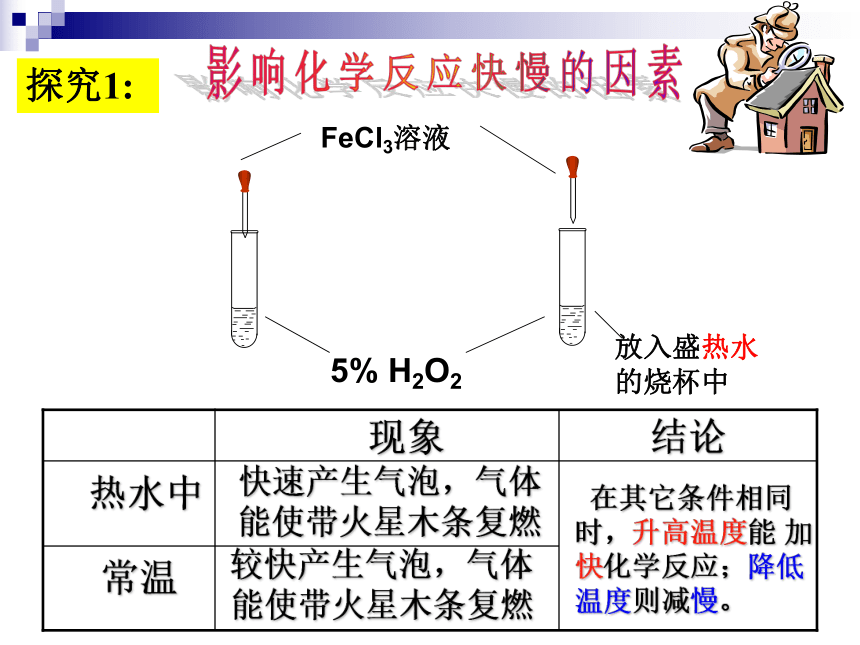
探究1:
5%
H2O2
FeCl3溶液
放入盛热水的烧杯中
结论
现象
热水中
常温
快速产生气泡,气体能使带火星木条复燃
较快产生气泡,气体能使带火星木条复燃
在其它条件相同时,升高温度能
加快化学反应;降低温度则减慢。
5%
H2O2
FeCl3溶液
MnO2粉末
探究2:
很快产生大量气泡
很快产生大量气泡
较慢产生少量气泡
在其它条件相同时,使用催化剂能加快化学反应.
根据你的生活和学习经验判断,
是什么因素影响了它们的反应快慢
?
1.
夏天里露置在空气中的牛奶很快就变质了_____。
2.
加酶洗衣粉去污能力比普通洗衣粉强得多
。
3.
蜂窝煤比大块状的煤容易燃烧
。
4.
大小相同的锌粒分别在1mol/L的盐酸和3mol/L的
盐酸中反应速率不同_____。
5.
向分别装有表面积相等的镁片和锌片的试管中中加入同体积同浓度的盐酸,产生气体快慢不同
。
反应物的性质
浓度
反应物的接触面积
催化剂
影响化学反应快慢的因素
规律
(在其它条件相同时)
内
因
外
因
反应物的性质
反应物的化学性质越活泼,化学反应越快;反之则越慢
温度
升高温度,化学反应加快;
反之减慢
催化剂
使用催化剂,化学反应加快
反应物的浓度
其他因素
反应物固体的颗粒大小、光照、电磁波……
增大反应物的浓度,化学反应加快;反之减慢
学以致用
1.人们为什么使用电冰箱储存食物?
2.实验室通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
3.
葡萄糖在空气中燃烧时需要较高的温度,可是在人体中,在正常体温时就可以被氧化,这是为什么?
温度越低,食物变质腐败的速率越慢。这也是温度对化学反应速率的影响在生活中的应用。
固体药品研得越细,其表面积越大,混匀后反应物之间接触的面积也越大,反应也迅速、充分。
人体里的生物酶起催化作用,可以降低葡萄糖氧化反应所需要的能量,所以在人体温度的范围内就可以发生反应。
速率
在化学反应过程中,该用什么来表示一个化学反应进行的快慢呢?
(1.5~5)×10-3
m/s
约
8.5
m/s
物理学中用
来表示物体运动的快慢。
在化学反应过程中,该用什么来表示一个化学反应进行的快慢呢?
速率
——
化学反应速率
阅读课本
1.化学反应速率的表示:
化学反应速率用单位时间(如每秒,每分钟,每小时)内反应物浓度的减小量或
生成物浓度的增加量来表示。
3.试根据以上计算式推出v的单位是什么?
2.某一物质的化学反应速率的计算式为:
mol/(L
·
s)或mol/(L
·
min)或mol/(L
·
h)
二.化学反应速率
动脑时间
4、有关化学反应速率的简单计算
例:某反应的反应物浓度在5
min内由6
mol/L变成了2
mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率?
=
5min
6mol/L
-2
mol/L
=0.8
mol/(L·min)
解:
答:用该物质表示的该反应在这段时间内的平均反应速率为0.8
mol/(L·min)
=
0.3mol/(L·s)
v
(NH3)
=
=
二、化学反应速率:
化学反应速率通常用单位时间内反应物浓度的减少量
或生成物浓度的增加量(均取正值)来表示。
反应速率单位:
mol/(L?min)
或mol/(L
?s)
一、影响化学反应速率的因素:
内因:反应物的性质;
外因:温度、浓度、催化剂、
反应物固体的颗粒大小、光照、电磁波等。
小
结
1.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指在一段时间内任何一种反应物物
质的量的减少或任何一种生成物物质的量的增加。
B.化学反应速率为0.8
mol/(L·s),是指在1
s时某物
质的浓度是0.8
mol/L。
C.化学反应速率可以衡量化学反应进行的快慢。
D.对于任何化学反应来说,反应速率越快,反应现象
越明显。
解析 一般情况下不用固体或纯液体表示化学反应速率,A项错误;0.8
mol/(L·s)表示一段时间内,某物质的浓度平均每秒改变0.8
mol/L,B项错误;对于无明显现象的化学反应而言,反应速率的大小与现象无关,D项错误。
[巩固提升]
2.下列说法正确的是( )
A.Na与水反应时增大水的用量可加快反应速率
B.Fe与硫酸反应制取H2时,选用浓硫酸可加快反应速率
C.两支试管中分别加入相同浓度的过氧化氢,其中一支试管中加少量MnO2,两支试管中产生氧气的快慢相同
D.Al在氧气中燃烧生成Al2O3,将铝片改成铝粉燃烧更剧烈
解析 对纯液体改变其用量不影响反应速率,A项错误;常温下,浓H2SO4可使铁钝化,不生成H2,B项错误;使用MnO2可加快O2的生成速率,C项错误;将铝片改为铝粉,增大了铝与氧气的接触面积,反应速率增大,D项正确。
[巩固提升]
3.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )
解析 比较化学反应速率大小时,应该先看决定化学反应速率的主要因素——内部因素:反应物本身的性质,然后再看影响化学反应速率的外界因素,如温度、浓度、催化剂、压强等。由于Fe不如Mg活泼,金属与硝酸反应不产生H2,所以C项反应速率最小,A项不产生H2;其他两项中只比较c(H+)即可,显然3
mol/L盐酸中c(H+)小于
3
mol/L
硫酸中c(H+),因此D项放出H2的速率最大。
[巩固提升]
金属(粉末状)/mol
酸的浓度及体积
反应
温度
A
Mg
0.1
6
mol/L硝酸
10
mL
60℃
B
Mg
0.1
3
mol/L盐酸
10
mL
60℃
C
Fe
0.1
3
mol/L盐酸
10
mL
60℃
D
Mg
0.1
3
mol/L硫酸
10
mL
60℃
4.在一定温度和一定容积的容器中进行反应2HI
H2+I2,若反应物浓度由0.1
mol/L降到0.05
mol/L需20
s,那么由0.05
mol/L降到0.025
mol/L,需要的反应时间为
A.等于10
s
B.等于8
s
C.大于10
s
D.小于10
s
完成学案后面的作业。
瞧它们涉及的化学变化快慢相差很大耶!
瞬间完成
节
日
焰
火
牛
奶
变
质
35℃
半天变质
钢
铁
生
锈
潮湿空气中数周
溶
洞
几十万年
煤
的
形
成
千百万年
而且,要注意保存的温度及保质的期限哦!
①一次性快餐盒、聚乙烯等塑料制品分解需要几百年。
②汽车尾气NO、CO反应能生成N2、CO2,但汽车尾气中仍有NO、CO排放,因为反应太慢了
有的反应我们希望快一点好!
①橡胶老化,钢铁腐蚀;
②“云龙陛石”近几十年腐蚀加快;
③乐山大佛近几十年腐蚀特别严重。
有的反应我们希望慢一点好!
第二章第三节
第一课时
化学反应速率
学习目标
【知识与技能】
1.了解化学反应速率的概念及表示方法;
2.知道浓度、温度、催化剂等因素对化学反应速
率的影响;
3.初步了解如何调控化学反应的快慢,以及在生
产生活中的作用。
【过程与方法】
通过实验探究,总结影响化学反应速率的因素;
【情感态度价值观】
有参与化学科技活动的热情,将化学知识应用于
生产、生活实践的意识,能够对与化学有关的社
会和生活问题作出合理的判断。
有哪些条件会影响化学反应的快慢?
探究1:
5%
H2O2
FeCl3溶液
放入盛热水的烧杯中
结论
现象
热水中
常温
快速产生气泡,气体能使带火星木条复燃
较快产生气泡,气体能使带火星木条复燃
在其它条件相同时,升高温度能
加快化学反应;降低温度则减慢。
5%
H2O2
FeCl3溶液
MnO2粉末
探究2:
很快产生大量气泡
很快产生大量气泡
较慢产生少量气泡
在其它条件相同时,使用催化剂能加快化学反应.
根据你的生活和学习经验判断,
是什么因素影响了它们的反应快慢
?
1.
夏天里露置在空气中的牛奶很快就变质了_____。
2.
加酶洗衣粉去污能力比普通洗衣粉强得多
。
3.
蜂窝煤比大块状的煤容易燃烧
。
4.
大小相同的锌粒分别在1mol/L的盐酸和3mol/L的
盐酸中反应速率不同_____。
5.
向分别装有表面积相等的镁片和锌片的试管中中加入同体积同浓度的盐酸,产生气体快慢不同
。
反应物的性质
浓度
反应物的接触面积
催化剂
影响化学反应快慢的因素
规律
(在其它条件相同时)
内
因
外
因
反应物的性质
反应物的化学性质越活泼,化学反应越快;反之则越慢
温度
升高温度,化学反应加快;
反之减慢
催化剂
使用催化剂,化学反应加快
反应物的浓度
其他因素
反应物固体的颗粒大小、光照、电磁波……
增大反应物的浓度,化学反应加快;反之减慢
学以致用
1.人们为什么使用电冰箱储存食物?
2.实验室通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
3.
葡萄糖在空气中燃烧时需要较高的温度,可是在人体中,在正常体温时就可以被氧化,这是为什么?
温度越低,食物变质腐败的速率越慢。这也是温度对化学反应速率的影响在生活中的应用。
固体药品研得越细,其表面积越大,混匀后反应物之间接触的面积也越大,反应也迅速、充分。
人体里的生物酶起催化作用,可以降低葡萄糖氧化反应所需要的能量,所以在人体温度的范围内就可以发生反应。
速率
在化学反应过程中,该用什么来表示一个化学反应进行的快慢呢?
(1.5~5)×10-3
m/s
约
8.5
m/s
物理学中用
来表示物体运动的快慢。
在化学反应过程中,该用什么来表示一个化学反应进行的快慢呢?
速率
——
化学反应速率
阅读课本
1.化学反应速率的表示:
化学反应速率用单位时间(如每秒,每分钟,每小时)内反应物浓度的减小量或
生成物浓度的增加量来表示。
3.试根据以上计算式推出v的单位是什么?
2.某一物质的化学反应速率的计算式为:
mol/(L
·
s)或mol/(L
·
min)或mol/(L
·
h)
二.化学反应速率
动脑时间
4、有关化学反应速率的简单计算
例:某反应的反应物浓度在5
min内由6
mol/L变成了2
mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率?
=
5min
6mol/L
-2
mol/L
=0.8
mol/(L·min)
解:
答:用该物质表示的该反应在这段时间内的平均反应速率为0.8
mol/(L·min)
=
0.3mol/(L·s)
v
(NH3)
=
=
二、化学反应速率:
化学反应速率通常用单位时间内反应物浓度的减少量
或生成物浓度的增加量(均取正值)来表示。
反应速率单位:
mol/(L?min)
或mol/(L
?s)
一、影响化学反应速率的因素:
内因:反应物的性质;
外因:温度、浓度、催化剂、
反应物固体的颗粒大小、光照、电磁波等。
小
结
1.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指在一段时间内任何一种反应物物
质的量的减少或任何一种生成物物质的量的增加。
B.化学反应速率为0.8
mol/(L·s),是指在1
s时某物
质的浓度是0.8
mol/L。
C.化学反应速率可以衡量化学反应进行的快慢。
D.对于任何化学反应来说,反应速率越快,反应现象
越明显。
解析 一般情况下不用固体或纯液体表示化学反应速率,A项错误;0.8
mol/(L·s)表示一段时间内,某物质的浓度平均每秒改变0.8
mol/L,B项错误;对于无明显现象的化学反应而言,反应速率的大小与现象无关,D项错误。
[巩固提升]
2.下列说法正确的是( )
A.Na与水反应时增大水的用量可加快反应速率
B.Fe与硫酸反应制取H2时,选用浓硫酸可加快反应速率
C.两支试管中分别加入相同浓度的过氧化氢,其中一支试管中加少量MnO2,两支试管中产生氧气的快慢相同
D.Al在氧气中燃烧生成Al2O3,将铝片改成铝粉燃烧更剧烈
解析 对纯液体改变其用量不影响反应速率,A项错误;常温下,浓H2SO4可使铁钝化,不生成H2,B项错误;使用MnO2可加快O2的生成速率,C项错误;将铝片改为铝粉,增大了铝与氧气的接触面积,反应速率增大,D项正确。
[巩固提升]
3.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )
解析 比较化学反应速率大小时,应该先看决定化学反应速率的主要因素——内部因素:反应物本身的性质,然后再看影响化学反应速率的外界因素,如温度、浓度、催化剂、压强等。由于Fe不如Mg活泼,金属与硝酸反应不产生H2,所以C项反应速率最小,A项不产生H2;其他两项中只比较c(H+)即可,显然3
mol/L盐酸中c(H+)小于
3
mol/L
硫酸中c(H+),因此D项放出H2的速率最大。
[巩固提升]
金属(粉末状)/mol
酸的浓度及体积
反应
温度
A
Mg
0.1
6
mol/L硝酸
10
mL
60℃
B
Mg
0.1
3
mol/L盐酸
10
mL
60℃
C
Fe
0.1
3
mol/L盐酸
10
mL
60℃
D
Mg
0.1
3
mol/L硫酸
10
mL
60℃
4.在一定温度和一定容积的容器中进行反应2HI
H2+I2,若反应物浓度由0.1
mol/L降到0.05
mol/L需20
s,那么由0.05
mol/L降到0.025
mol/L,需要的反应时间为
A.等于10
s
B.等于8
s
C.大于10
s
D.小于10
s
完成学案后面的作业。
