2011届高三化学三轮总复习重点专题突破:第5讲 化学反应中的能量变化
文档属性
| 名称 | 2011届高三化学三轮总复习重点专题突破:第5讲 化学反应中的能量变化 |
|
|
| 格式 | zip | ||
| 文件大小 | 112.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-05-23 00:00:00 | ||
图片预览


文档简介
第5讲 化学反应中的能量变化
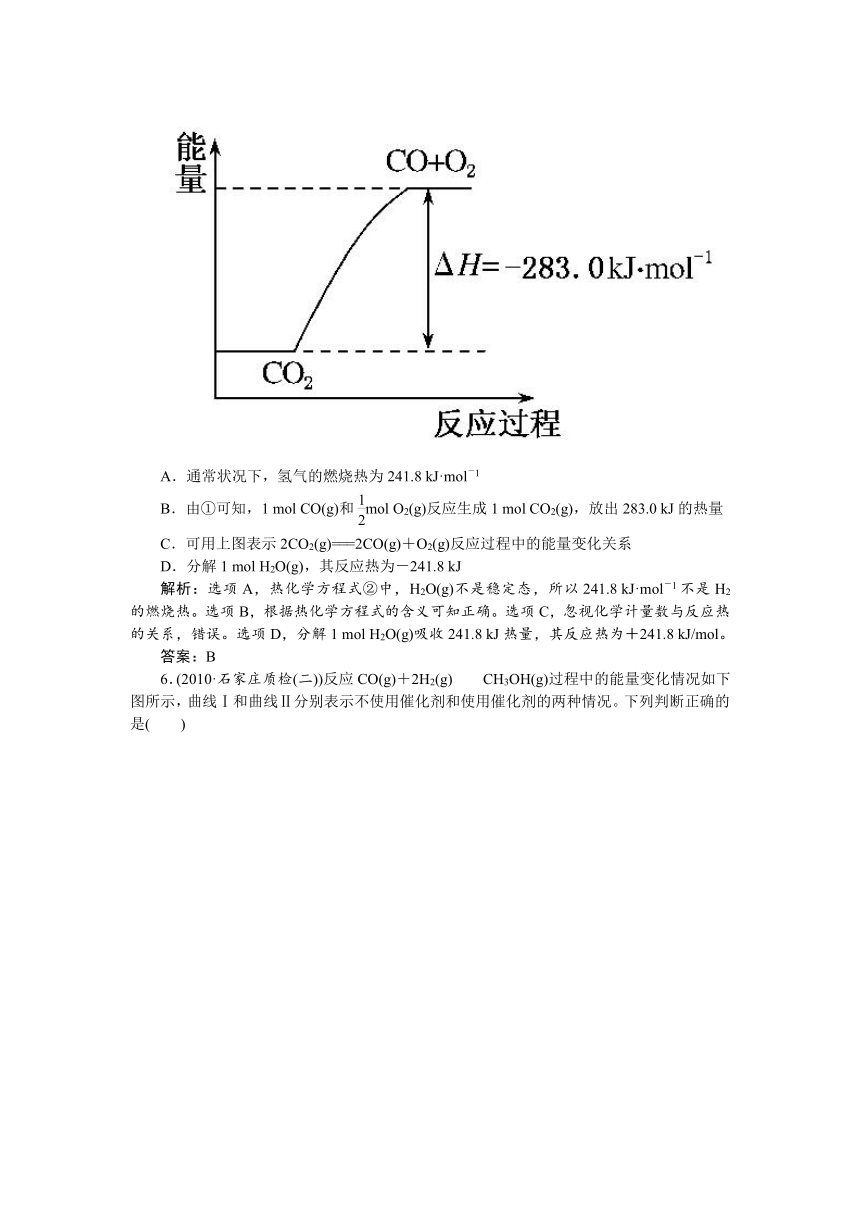
1.(2010·北京市抽样)反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )
A.12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
C.该反应的热化学方程式是2C(s)+O2(g)===2CO(g);ΔH=-221 kJ
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
解析:根据图示,12 g C(s)与一定量O2(g)反应生成28 g CO(g)放出的热量为110.5 kJ,A错;2 mol C(s)与O2(g)反应生成CO(g)放出的热量为221 kJ,由于CO(g)与O2(g)反应生成CO2(g)放热,因此2 mol C(s)与足量O2(g)反应生成CO2(g)放出的热量大于221 kJ,B对;该反应的热化学方程式是2C(s)+O2(g)===2CO(g);ΔH=-221 kJ/mol,C错;该反应的反应热等于CO分子中化学键形成时所释放的总能量与C、O2分子中化学键断裂时所吸收的总能量的差,D错。
答案:B
2.(2010·四川省检测)已知:①H+(aq)+OH-(aq)===H2O(l);ΔH1;②2SO2(g)+O2(g)??2SO3(g);ΔH2。其他条件不变时,改变反应物的量,则下列判断正确的是( )
A.ΔH1增大,ΔH2减小 B.ΔH1增大,ΔH2增大
C.ΔH1减小,ΔH2减小 D.ΔH1不变,ΔH2不变
解析:ΔH1表示稀溶液中强酸与强碱反应生成1 mol水的反应热,与反应物的量无关;ΔH2表示2 mol二氧化硫气体与1 mol氧气完全反应生成2 mol三氧化硫气体的反应热,与反应物的量无关。
答案:D
3.(2010·石家庄质检(一))已知在101 kPa下,1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ。则下列说法中正确的是( )
A.氢气的燃烧热为241.8 kJ·mol-1
B.1 mol H2O(l)具有的能量大于1 mol H2O(g)具有的能量
C.反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g);ΔH=+483.6 kJ·mol-1
D.2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量
解析:A项,燃烧热是指生成液态水时放出的热量,而题中给出的是气态水,故不能得出燃烧热的数据;B项,气态水所具有的能量大于液态水所具有的能量;C项,氢气燃烧时放热,ΔH的值应为负值;D项,放热反应中,反应物的总能量大于生成物的总能量,故正确。
答案:D
4.(2010·邯郸市摸底考试)一些烷烃的燃烧热如下表:
化合物 燃烧热/kJ·mol-1 化合物 燃烧热/kJ·mol-1
甲烷 890.3 正丁烷 2878.0
乙烷 1560.8 异丁烷 2869.6
丙烷 2221.5 2-甲基丁烷 3531.3
下列表达正确的是( )
A.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g);ΔH=-1560.8 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.正戊烷的燃烧热大于3531.3 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
解析:选项A,所给的热化学方程式中H2O为非稳定的气态,且ΔH值也与化学计量数不符,错误。选项B,等物质的量的正丁烷燃烧释放出的热量大于异丁烷,说明正丁烷具有的总能量大于异丁烷,能量越高越不稳定,所以异丁烷的稳定性大于正丁烷。选项C,根据正丁烷的燃烧热大于异丁烷,推知正戊烷的燃烧热大于2 甲基丁烷的燃烧热,即正戊烷的燃烧热大于3531.5 kJ·mol-1。选项D,相同质量的烷烃,氢的质量分数越大,燃烧放出的热量越多。
答案:C
5.(2010·成都市检测)已知:①CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1 ②H2(g)+O2(g)===H2O(g);ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A.通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B.由①可知,1 mol CO(g)和mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量
C.可用上图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系
D.分解1 mol H2O(g),其反应热为-241.8 kJ
解析:选项A,热化学方程式②中,H2O(g)不是稳定态,所以241.8 kJ·mol-1不是H2的燃烧热。选项B,根据热化学方程式的含义可知正确。选项C,忽视化学计量数与反应热的关系,错误。选项D,分解1 mol H2O(g)吸收241.8 kJ热量,其反应热为+241.8 kJ/mol。
答案:B
6.(2010·石家庄质检(二))反应CO(g)+2H2(g)??CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
A.该反应的ΔH=+91 kJ/mol
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH变大
解析:根据图示,反应物的总能量大于生成物的总能量,该反应是放热反应,故选项A错误,C正确。选项B,加入催化剂只能降低反应所需的活化能,而对反应热无影响。选项D,生成液态CH3OH时释放出的热量更大,ΔH变小。
答案:C
7.(2010·黄冈市质检)向盛有50 mL 1.00 mol·L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )
A.该实验表明化学能可以转化为热能
B.NaOH溶液的浓度大于1.00 mol/L
C.V=50 mL时,混合液的pH>7
D.该实验表明有水生成的反应都是放热反应
解析:A项,由图象可知,随着反应的进行,混合液的温度升高,故该反应是放热反应,即将化学能转变为热能,正确;B项,由图象可知,加入40 mL氢氧化钠溶液时恰好完全中和,则表明氢氧化钠溶液的浓度大于1 mol/L,正确;C项,V=50 mL时,氢氧化钠溶液过量,此时的pH大于7,正确;D项,不能由此反应说明有水生成的反应均为放热反应,如氢氧化钡与氯化铵的反应中也生成水,但却为吸热反应,故不正确。
答案:D
8.(2010·海淀区期末)已知:2CO(g)+O2(g)===2CO2(g);ΔH=-566 kJ·mol-1
N2(g)+O2(g)===2NO(g);ΔH=+180 kJ·mol-1
则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ·mol-1 B.+386 kJ·mol-1
C.-746 kJ·mol-1 D.+746 kJ·mol-1
解析:设提供的两个反应分别为①、②,根据盖斯定律,2CO(g)+2NO(g)===N2(g)+2CO2(g)可以通过①-②得到,故该反应的ΔH=-746 kJ·mol-1。
答案:C
9.(2010·河南省调研)已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1,CO(g)+O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1,现有CO、H2和CO2组成的混合气体112.0 L(标准状况)经完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为( )
A.80% B.40% C.60% D.20%
解析:本题考查了反应热的有关计算。由题意H2(g)~H2O(l),则反应前V(H2)=×22.4 L·mol-1=22.4 L,H2燃烧放出的热量为Q=571.6×=285.8(kJ),则V(CO)=×22.4 L·mol-1=44.8 L,故CO的体积分数=×100%=40%。
答案:B
10.(2010·浙江杭州月考)某学生用如图所示装置进行化学反应X+2Y===2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到试管中甲处下降,乙处上升。关于该反应的下列叙述正确的是( )
①该反应为放热反应;
②生成物的总能量比反应物的总能量高;
③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。
A.①②③ B.①③
C.①② D.③
解析:由于试管中滴加试剂Y时,甲处下降,乙处上升,说明广口瓶内的压强大于大气压强,其原因是X+2Y===2Z的反应是一个放热反应,生成物的总能量比反应物的总能量低,当X与Y混合后,由于反应放热,使广口瓶内的压强增大,使甲处液面下降。
答案:B
11.(2010·桂林市摸底考试)在一定条件下发生化学反应:2SO2(g)+O2(g)??2SO3(g);ΔH=-197 kJ/mol。现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入气体的量和反应放出的热量(Q)如下表所示:
容器 SO2(mol) O2(mol) N2(mol) Q(kJ)
甲 2 1 0 Q1
乙 1 0.5 0 Q2
丙 1 0.5 1 Q3
根据以上数据,下列叙述不正确的是( )
A.在上述条件下反应生成1 mol SO3气体放热98.5 kJ
B. 在上述条件下将2 mol SO2与1 mol O2混合充分反应后放出的热量小于197 kJ
C. Q1=2Q2=2Q3=197 kJ
D. 2Q2=2Q3解析:由方程式知,每生成2 mol SO3放出197 kJ热量,A对;恒容条件下,加入的N2对平衡移动不产生影响,故乙、丙容器达到平衡时放出的热量相同;甲、乙相比,平衡时若SO2的转化率相同,则2Q2=Q1,但因乙容器中压强比甲小,不利于反应向右进行,导致乙容器中SO2的转化率比甲容器中的小,故有2Q2答案:C
12.(2010·江西省联考)下列过程都与热量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
解析:稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式应为:H+(aq)+SO(aq)+Ba2+(aq)+OH-(aq)===BaSO4(s)+H2O(l);ΔH<-57.3 kJ/mol。
答案:B
13.(2009·平遥模拟)①CaCO3(s)===CaO+CO2(g);ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g);
ΔH=-131.3 kJ/mol
③H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l);
ΔH=-57.3 kJ/mol
④C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ/mol
⑤CO(g)+O2(g)===CO2(g);ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l);
ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l);ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有________,不正确的理由分别是____________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式__________________________________________。
(3)上述反应中,表示燃烧热的热化学方程式有________;表示中和热的热化学方程式有______________。
答案:(1)①②③
①CaO没标状态,ΔH=+177.7 kJ/mol;②H2O的状态应为“g”;③H2SO4、NaOH和Na2SO4的状态不是“l”应为“aq”
(2)C(s)+O2(g)===CO(g);ΔH=-110.5 kJ/mol
(3)④⑤ ⑥
14.(2010·北京市抽样)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是__________________________________________。
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)===CO(g)+H2(g);ΔH=________kJ·mol-1。
解析:(1)根据提供信息,1 mol甲烷完全燃烧生成液态水放出890.31 kJ的热量,因此其热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31 kJ·mol-1。(2)设提供的三个反应分别为①、②、③,根据盖斯定律,C(s)+H2O(g)===CO(g)+H2(g)可以通过①-②-③得到,因此该反应的ΔH=-437.3 kJ·mol-1-(-285.8 kJ·mol-1)-(-283.0 kJ·mol-1)=+131.5 kJ·mol-1。
答案:(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31 kJ·mol-1 (2)+131.5
15.(2009·南通)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(选填“A”、“B”或“C”)。
(2)20世纪30年代Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程
中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________________。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键所需吸收的能量,下表是部分化学键的键能数据:
化学键 P—P P—O O===O P===O
键能/kJ·mol-1 197 360 499 x
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中x=________。
图Ⅲ
解析:(1)有效碰撞是发生化学反应的碰撞,即有新物质生成的碰撞,显然选C。(2)当反应物的总能量大于生成物的总能量时,反应放热,反之吸热,注意热化学方程式必须标明反应物和生成物的状态。(3)催化剂主要使有效碰撞的能量降低,使反应的门槛降低,即过渡态时的能量较低。
(4)P4+5O2===P4O10,燃烧热为(4x+12×360)-(6×197+5×499)=2378.0,求得x=433.75 kJ/mol。
答案:(1)C (2)NO2(g)+CO(g)===CO2(g)+NO(g);
ΔH=-234 kJ/mol
(3)上图虚线所示
(4)433.75
1.(2010·北京市抽样)反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )
A.12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
C.该反应的热化学方程式是2C(s)+O2(g)===2CO(g);ΔH=-221 kJ
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
解析:根据图示,12 g C(s)与一定量O2(g)反应生成28 g CO(g)放出的热量为110.5 kJ,A错;2 mol C(s)与O2(g)反应生成CO(g)放出的热量为221 kJ,由于CO(g)与O2(g)反应生成CO2(g)放热,因此2 mol C(s)与足量O2(g)反应生成CO2(g)放出的热量大于221 kJ,B对;该反应的热化学方程式是2C(s)+O2(g)===2CO(g);ΔH=-221 kJ/mol,C错;该反应的反应热等于CO分子中化学键形成时所释放的总能量与C、O2分子中化学键断裂时所吸收的总能量的差,D错。
答案:B
2.(2010·四川省检测)已知:①H+(aq)+OH-(aq)===H2O(l);ΔH1;②2SO2(g)+O2(g)??2SO3(g);ΔH2。其他条件不变时,改变反应物的量,则下列判断正确的是( )
A.ΔH1增大,ΔH2减小 B.ΔH1增大,ΔH2增大
C.ΔH1减小,ΔH2减小 D.ΔH1不变,ΔH2不变
解析:ΔH1表示稀溶液中强酸与强碱反应生成1 mol水的反应热,与反应物的量无关;ΔH2表示2 mol二氧化硫气体与1 mol氧气完全反应生成2 mol三氧化硫气体的反应热,与反应物的量无关。
答案:D
3.(2010·石家庄质检(一))已知在101 kPa下,1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ。则下列说法中正确的是( )
A.氢气的燃烧热为241.8 kJ·mol-1
B.1 mol H2O(l)具有的能量大于1 mol H2O(g)具有的能量
C.反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g);ΔH=+483.6 kJ·mol-1
D.2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量
解析:A项,燃烧热是指生成液态水时放出的热量,而题中给出的是气态水,故不能得出燃烧热的数据;B项,气态水所具有的能量大于液态水所具有的能量;C项,氢气燃烧时放热,ΔH的值应为负值;D项,放热反应中,反应物的总能量大于生成物的总能量,故正确。
答案:D
4.(2010·邯郸市摸底考试)一些烷烃的燃烧热如下表:
化合物 燃烧热/kJ·mol-1 化合物 燃烧热/kJ·mol-1
甲烷 890.3 正丁烷 2878.0
乙烷 1560.8 异丁烷 2869.6
丙烷 2221.5 2-甲基丁烷 3531.3
下列表达正确的是( )
A.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g);ΔH=-1560.8 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.正戊烷的燃烧热大于3531.3 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
解析:选项A,所给的热化学方程式中H2O为非稳定的气态,且ΔH值也与化学计量数不符,错误。选项B,等物质的量的正丁烷燃烧释放出的热量大于异丁烷,说明正丁烷具有的总能量大于异丁烷,能量越高越不稳定,所以异丁烷的稳定性大于正丁烷。选项C,根据正丁烷的燃烧热大于异丁烷,推知正戊烷的燃烧热大于2 甲基丁烷的燃烧热,即正戊烷的燃烧热大于3531.5 kJ·mol-1。选项D,相同质量的烷烃,氢的质量分数越大,燃烧放出的热量越多。
答案:C
5.(2010·成都市检测)已知:①CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1 ②H2(g)+O2(g)===H2O(g);ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A.通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B.由①可知,1 mol CO(g)和mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量
C.可用上图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系
D.分解1 mol H2O(g),其反应热为-241.8 kJ
解析:选项A,热化学方程式②中,H2O(g)不是稳定态,所以241.8 kJ·mol-1不是H2的燃烧热。选项B,根据热化学方程式的含义可知正确。选项C,忽视化学计量数与反应热的关系,错误。选项D,分解1 mol H2O(g)吸收241.8 kJ热量,其反应热为+241.8 kJ/mol。
答案:B
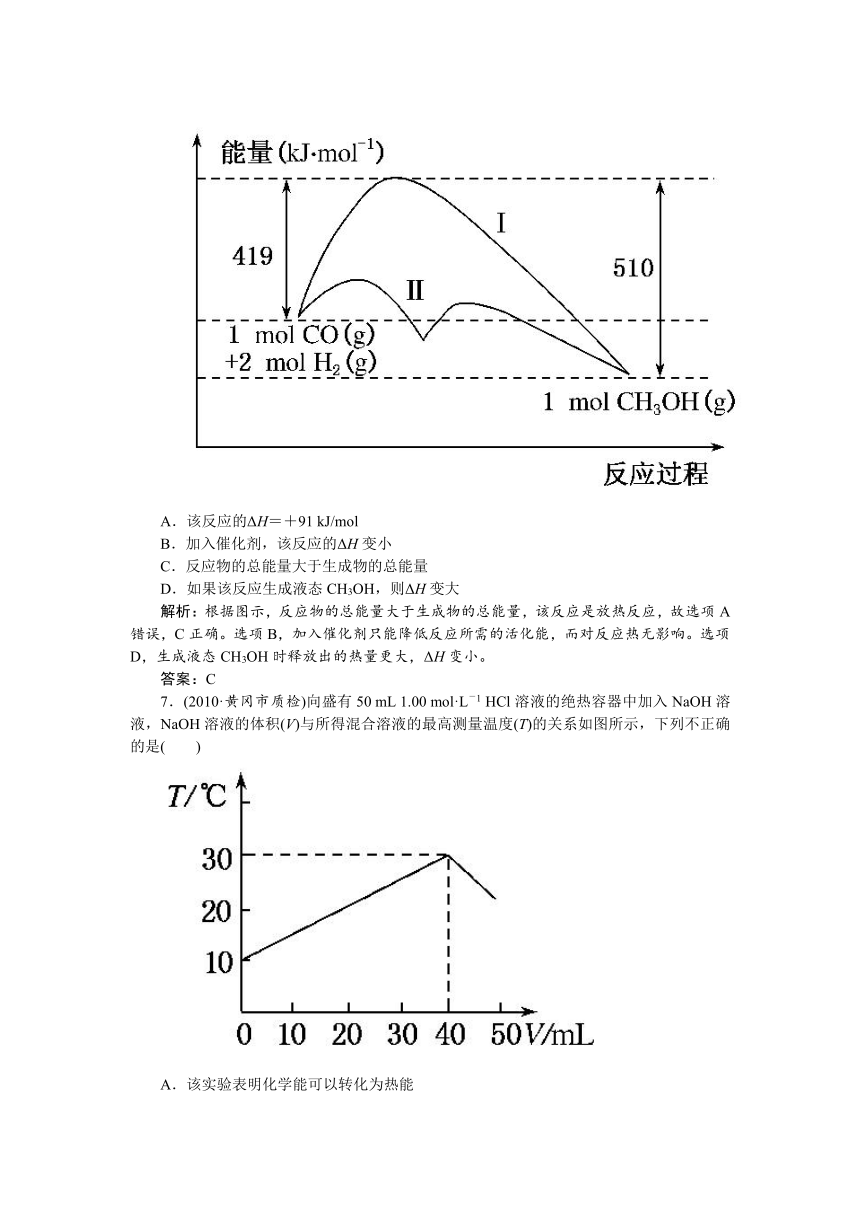
6.(2010·石家庄质检(二))反应CO(g)+2H2(g)??CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
A.该反应的ΔH=+91 kJ/mol
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH变大
解析:根据图示,反应物的总能量大于生成物的总能量,该反应是放热反应,故选项A错误,C正确。选项B,加入催化剂只能降低反应所需的活化能,而对反应热无影响。选项D,生成液态CH3OH时释放出的热量更大,ΔH变小。
答案:C
7.(2010·黄冈市质检)向盛有50 mL 1.00 mol·L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )
A.该实验表明化学能可以转化为热能
B.NaOH溶液的浓度大于1.00 mol/L
C.V=50 mL时,混合液的pH>7
D.该实验表明有水生成的反应都是放热反应
解析:A项,由图象可知,随着反应的进行,混合液的温度升高,故该反应是放热反应,即将化学能转变为热能,正确;B项,由图象可知,加入40 mL氢氧化钠溶液时恰好完全中和,则表明氢氧化钠溶液的浓度大于1 mol/L,正确;C项,V=50 mL时,氢氧化钠溶液过量,此时的pH大于7,正确;D项,不能由此反应说明有水生成的反应均为放热反应,如氢氧化钡与氯化铵的反应中也生成水,但却为吸热反应,故不正确。
答案:D
8.(2010·海淀区期末)已知:2CO(g)+O2(g)===2CO2(g);ΔH=-566 kJ·mol-1
N2(g)+O2(g)===2NO(g);ΔH=+180 kJ·mol-1
则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ·mol-1 B.+386 kJ·mol-1
C.-746 kJ·mol-1 D.+746 kJ·mol-1
解析:设提供的两个反应分别为①、②,根据盖斯定律,2CO(g)+2NO(g)===N2(g)+2CO2(g)可以通过①-②得到,故该反应的ΔH=-746 kJ·mol-1。
答案:C
9.(2010·河南省调研)已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1,CO(g)+O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1,现有CO、H2和CO2组成的混合气体112.0 L(标准状况)经完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为( )
A.80% B.40% C.60% D.20%
解析:本题考查了反应热的有关计算。由题意H2(g)~H2O(l),则反应前V(H2)=×22.4 L·mol-1=22.4 L,H2燃烧放出的热量为Q=571.6×=285.8(kJ),则V(CO)=×22.4 L·mol-1=44.8 L,故CO的体积分数=×100%=40%。
答案:B
10.(2010·浙江杭州月考)某学生用如图所示装置进行化学反应X+2Y===2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到试管中甲处下降,乙处上升。关于该反应的下列叙述正确的是( )
①该反应为放热反应;
②生成物的总能量比反应物的总能量高;
③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。
A.①②③ B.①③
C.①② D.③
解析:由于试管中滴加试剂Y时,甲处下降,乙处上升,说明广口瓶内的压强大于大气压强,其原因是X+2Y===2Z的反应是一个放热反应,生成物的总能量比反应物的总能量低,当X与Y混合后,由于反应放热,使广口瓶内的压强增大,使甲处液面下降。
答案:B
11.(2010·桂林市摸底考试)在一定条件下发生化学反应:2SO2(g)+O2(g)??2SO3(g);ΔH=-197 kJ/mol。现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入气体的量和反应放出的热量(Q)如下表所示:
容器 SO2(mol) O2(mol) N2(mol) Q(kJ)
甲 2 1 0 Q1
乙 1 0.5 0 Q2
丙 1 0.5 1 Q3
根据以上数据,下列叙述不正确的是( )
A.在上述条件下反应生成1 mol SO3气体放热98.5 kJ
B. 在上述条件下将2 mol SO2与1 mol O2混合充分反应后放出的热量小于197 kJ
C. Q1=2Q2=2Q3=197 kJ
D. 2Q2=2Q3
12.(2010·江西省联考)下列过程都与热量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
解析:稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式应为:H+(aq)+SO(aq)+Ba2+(aq)+OH-(aq)===BaSO4(s)+H2O(l);ΔH<-57.3 kJ/mol。
答案:B
13.(2009·平遥模拟)①CaCO3(s)===CaO+CO2(g);ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g);
ΔH=-131.3 kJ/mol
③H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l);
ΔH=-57.3 kJ/mol
④C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ/mol
⑤CO(g)+O2(g)===CO2(g);ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l);
ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l);ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有________,不正确的理由分别是____________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式__________________________________________。
(3)上述反应中,表示燃烧热的热化学方程式有________;表示中和热的热化学方程式有______________。
答案:(1)①②③
①CaO没标状态,ΔH=+177.7 kJ/mol;②H2O的状态应为“g”;③H2SO4、NaOH和Na2SO4的状态不是“l”应为“aq”
(2)C(s)+O2(g)===CO(g);ΔH=-110.5 kJ/mol
(3)④⑤ ⑥
14.(2010·北京市抽样)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是__________________________________________。
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)===CO(g)+H2(g);ΔH=________kJ·mol-1。
解析:(1)根据提供信息,1 mol甲烷完全燃烧生成液态水放出890.31 kJ的热量,因此其热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31 kJ·mol-1。(2)设提供的三个反应分别为①、②、③,根据盖斯定律,C(s)+H2O(g)===CO(g)+H2(g)可以通过①-②-③得到,因此该反应的ΔH=-437.3 kJ·mol-1-(-285.8 kJ·mol-1)-(-283.0 kJ·mol-1)=+131.5 kJ·mol-1。
答案:(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31 kJ·mol-1 (2)+131.5
15.(2009·南通)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(选填“A”、“B”或“C”)。
(2)20世纪30年代Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程
中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________________。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键所需吸收的能量,下表是部分化学键的键能数据:
化学键 P—P P—O O===O P===O
键能/kJ·mol-1 197 360 499 x
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中x=________。
图Ⅲ
解析:(1)有效碰撞是发生化学反应的碰撞,即有新物质生成的碰撞,显然选C。(2)当反应物的总能量大于生成物的总能量时,反应放热,反之吸热,注意热化学方程式必须标明反应物和生成物的状态。(3)催化剂主要使有效碰撞的能量降低,使反应的门槛降低,即过渡态时的能量较低。
(4)P4+5O2===P4O10,燃烧热为(4x+12×360)-(6×197+5×499)=2378.0,求得x=433.75 kJ/mol。
答案:(1)C (2)NO2(g)+CO(g)===CO2(g)+NO(g);
ΔH=-234 kJ/mol
(3)上图虚线所示
(4)433.75
同课章节目录
