2011届高三化学三轮总复习重点专题突破:第7讲 化学反应速率与化学平衡
文档属性
| 名称 | 2011届高三化学三轮总复习重点专题突破:第7讲 化学反应速率与化学平衡 |  | |
| 格式 | zip | ||
| 文件大小 | 82.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-05-23 20:13:23 | ||
图片预览



文档简介
第7讲 化学反应速率与化学平衡
1.(2009·广州)下列有关化学反应速率的认识,正确的是( )
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大
B.温度升高,分子动能增加,减小了活化能,故反应速率增大
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
D.H+和OH-的反应活化能接近于零,反应几乎在瞬间完成
解析:增大压强,体积减小,活化分子总数不变,但活化分子浓度增大,反应速率增大,A不正确。温度升高,更多分子吸收能量成为活化分子,反应速率增大,活化能不变,B不正确。使用催化剂,降低活化能,使更多分子成为活化分子,反应速率增大,C不正确。
答案:D
2.(2010·赣州市质检)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体。下列措施对改变该反应的速率几乎没有影响的是( )
A.用相同浓度但温度较高的盐酸代替常温下的盐酸
B.增大反应体系的压强或减小反应体系的压强
C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙
D.改用与原盐酸含有相同H+浓度的稀硫酸
解析:温度高,反应速率提高;压强是通过改变气体的浓度来改变化学反应速率的,而该反应为固体碳酸钙与液体盐酸的反应,反应物中没有气体,故改变压强对该反应的速率几乎没有影响;粉末状态的固体表面积大,反应速率快;尽管强调了稀硫酸与原盐酸中的H+浓度相同,但硫酸与碳酸钙反应生成的CaSO4微溶,覆盖在碳酸钙表面,从而使碳酸钙与H+的接触面积减小,导致反应速率变慢。
答案:B
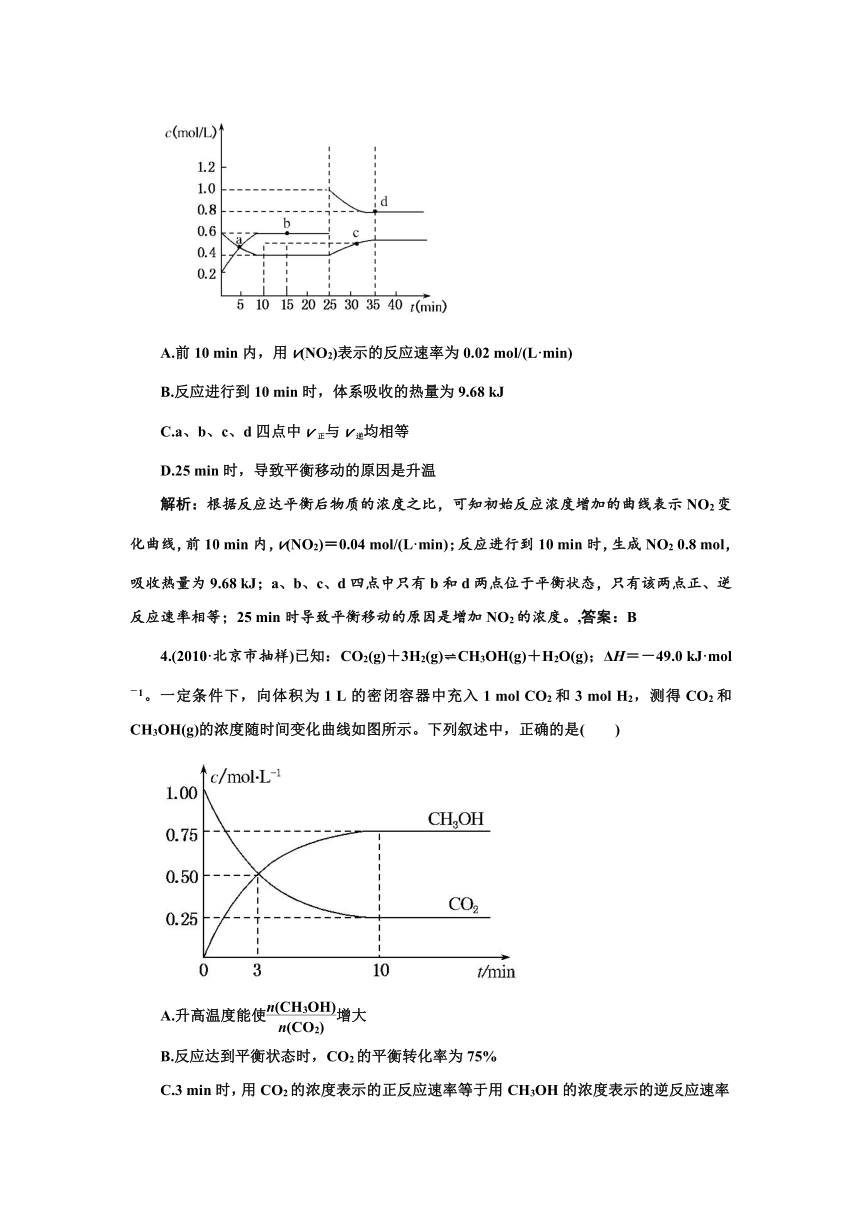
3.(2010·南昌市调研)已知NO2与N2O4可相互转化:2NO2(g) N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。下列推理分析合理的是( )
A.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
解析:根据反应达平衡后物质的浓度之比,可知初始反应浓度增加的曲线表示NO2变化曲线,前10 min内,v(NO2)=0.04 mol/(L·min);反应进行到10 min时,生成NO2 0.8 mol,吸收热量为9.68 kJ;a、b、c、d四点中只有b和d两点位于平衡状态,只有该两点正、逆反应速率相等;25 min时导致平衡移动的原因是增加NO2的浓度。,答案:B
4.(2010·北京市抽样)已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1
解析:该反应ΔH<0,为放热反应,升高温度,平衡向逆反应方向移动,n(CH3OH)减小,n(CO2)增大,减小,A错;反应达平衡时,CO2的转化率为×100%=75%,B对;3 min时,c(CH3OH)=c(CO2),由于3 min后c(CH3OH)增大,c(CO2)减小,即v正>v逆,因此用CO2的浓度表示的正反应速率大于用CH3OH的浓度表示的逆反应速率,C错;0~10 min内,v(CO2)==0.075 mol·L-1·min-1,根据同一反应中用不同物质表示的反应速率之比等于化学计量数之比,v(H2)=3v(CO2)=0.225 mol·L-1·min-1,D错。
答案:B
5.(2010·武汉市武昌区调研)一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
解析:以Z表示的反应速率为v(Z)==0.0005 mol/(L·s),根据同一反应中不同物质表示的反应速率之比等于化学计量数之比,则v(X)=2v(Z)=0.001 mol/(L·s),A对;将容器体积变为20 L,则压强减小,平衡向逆反应方向移动,Z的物质的量减小,则Z的平衡浓度小于原来的1/2,B错;增大压强,平衡向正反应方向移动,Y的转化率增大,C错;升高温度,X的体积分数增大,说明平衡向逆反应方向移动,而升高温度平衡向吸热反应方向移动,则正反应为放热反应,ΔH<0,D错。
答案:A
6.(2010·沪州市摸底考试)在两个恒容的密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g) CO(g)+H2(g);(乙)CO(g)+H2O(g) CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④断裂氢氧键的速率等于断裂氢氢键速率的2倍 ⑤混合气体密度不变 ⑥单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1 ⑦同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量,其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤ B.③④⑥
C.①⑥⑦ D.④⑦
解析:甲容器中,碳为固态,该可逆反应属于气体体积不相等的反应;乙容器中,反应属于等气体分子数的反应,气体相对分子质量、密度、压强都始终不变,①②⑤错误;各组分浓度相等,不能判断反应是否都达到了平衡状态,③错误。断裂氢氧键速率等于断裂氢氢键速率的2倍,经转化得,氢氧键的断裂速率等于生成氢氧键的速率,④正确;消耗水蒸气与生成氢气是同一反应方向,⑥错误;消耗氢气的物质的量等于同时生成水蒸气的物质的量,经转化得消耗氢气的物质的量等于生成氢气的物质的量,⑦正确。
答案:D
7.(2010·邯郸摸底考试)某密闭容器中充入等物质的量的气体A和B,在一定压强和温度下发生反应:A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确的是( )
A.30 min时降低温度,40 min时升高温度
B. 0~8 min内A的平均反应速率为0.08 mol·L-1·min-1
C. 反应方程式中的x=1,正反应为吸热反应
D. 54 min时C的体积分数大于40 min时
解析:根据时间—浓度变化图,20 min时反应达到平衡,此时A、B浓度减小1 mol·L-1,C的浓度为2 mol·L-1,推知x=1,则有:A(g)+B(g) 2C(g)。根据时间—速率图象,30 min时,正、逆反应速率降低,但平衡没有移动,不可能是降低温度引起的,可能是减小压强。40 min时改变条件导致正、逆反应速率均增大,但40 min瞬间A、B、C的浓度均不变,故改变的条件是升高温度。又因为逆反应速率增大的倍数大于正反应,平衡向逆反应方向移动,故54 min达到平衡时,C的体积分数小于40 min时,且推知反应为放热反应。0~8 min内,Δc(A)=2.0 mol·L-1-1.36 mol·L-1=0.64 mol·L-1,Δt=8 min,故v(A)=0.08 mol·L-1·min-1。综合上述,选项B正确。
答案:B
8.(2010·赣州市质检)在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
A.2 B.3
C.可能是2,也可能是3 D.无法确定
解析:根据恒温恒容条件下的等效平衡规律:对于反应前后气体的分子数不等的可逆反应,只要通过化学计量数换算成相同物质时浓度相等,就可以建立等效平衡;对于反应前后气体的分子数相等的可逆反应,只要通过化学计量数换算成相同物质时浓度之比与原来相等,就可以建立等效平衡。当x为2或3时,均能成立。
答案:C
9.在相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g);ΔH=-92.6 kJ/mol,实验测得起始与平衡时有关数据如下表所示:,
实验编号 起始时各物质的量/mol 达到平衡时体系能量的变化
N2 H2 NH3
① 1 3 0 23.15 kJ
② 0.9 2.7 0.2 Q
下列叙述错误的是( )
A.达到平衡时两容器中压强相同
B.平衡时两容器内NH3的体积分数均为
C.平均时容器②中Q=23.15 kJ
D.若容器①的容积为0.5 L,则平衡时放出的热量小于23.15 kJ
解析:将容器②中NH3的量转化为N2、H2后知,两个容器中相同的物质起始量相同,故它们可构成恒容条件下的等效平衡,平衡时两容器内各物质的量对应相等,A对;但通过反应生成NH3的量容器②的比①的少,故②中反应放出的热量少于23.15 kJ,C错;当容器容积扩大时,相当于减小压强,平衡向左移动,放出的热量减少,D对;由热化学方程式及平衡时放出的热量数值知,平衡时生成了0.5 mol NH3,混合气体共为3.5 mol,故B对。
答案:C
10.在一定容积的密闭容器中发生反应:X(g)+Y(g) Z(g)+W(s);ΔH>0。若开始投入1 mol X和1 mol Y,在一定条件下达到平衡,改变条件,其变化关系符合甲、乙图象。,下列有关判断正确的是( )
A.甲图表示温度对X转化率的影响,且Ⅰ温度较低
B.乙图一定表示压强对X体积分数的影响,且Ⅳ压强较高
C.甲图一定表示压强对X体积分数的影响,且Ⅰ压强较高
D.甲、乙图都可以表示温度、压强对平衡的影响,且Ⅰ>Ⅱ,Ⅲ<Ⅳ
解析:W为固态,该可逆反应的正反应是气体体积减小的吸热反应。若甲图表示压强对平衡的影响,根据先拐先平数值大,Ⅰ的压强较大,Ⅱ到Ⅰ(增大压强),平衡向右移动,X的转化率增大;若甲图表示温度对平衡影响,则Ⅰ的温度较高,Ⅱ到Ⅰ(升温),平衡向正方向移动,X的转化率增大,均符合题意。同理,乙图也可以表示温度、压强对平衡的影响,且Ⅳ一定大于(或高于)Ⅲ,只有D项正确。
答案:D
11.已知某反应A(g)+B(g) C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。,(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。,(3)在相同温度和压强下,对反应A(g)+B(g)??C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
,
A B C D
甲 a mol a mol 0 0
乙 2a mol a mol 0 0
丙 a mol a mol a mol a mol
丁 a mol 0 a mol a mol
上述四种情况达到平衡后,n(C)的大小顺序是________。
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是________。
A.气体平均摩尔质量不再变化
B. 气体压强不再变化
C. 气体密度不再变化
D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1
F. C生成的速率等于B消耗的速率
解析:(2)使用催化剂可以降低反应所需要的能量,但不影响反应的反应热;(3)依题意,四组实验中,温度、压强相等,容器的容积不一定相等。采用“一边倒”法,将产物转化成起始反应物,列表如下:,
A B C D
甲 a mol a mol 0 0
乙 2a mol a mol 0 0
丙 2a mol 2a mol 0 0
丁 2a mol a mol 0 0
等温等压下,起始物质投料物质的量(物质的量浓度)之比相同,达到同一平衡状态。根据表格数据知,甲和丙达到同一平均状态;乙和丁达到同一平衡状态。乙平衡状态,可以看成甲达到平衡后,向体系中增大A的浓度,平衡向右移动,C浓度增大。所以,达到平衡时,C的物质的量:乙=丁>甲=丙。
答案:(1)E1-E2 (2)减小 不变 (3)A (4)升高温度、增加B的浓度 (5)D
12.(2010·北京市东城区检测)一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g) CH3OH(g)达到化学平衡状态。
(1)500℃时,从反应开始到达到化学平衡状态,以H2的浓度变化表示的化学反应速率是________(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是________(填字母)。,a.v生成(CH3OH)=v消耗(CO),b.混合气体的密度不再改变,c.混合气体的平均相对分子质量不再改变,d.CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。,a.c(H2)减小,b.正反应速率加快,逆反应速率减慢,c.CH3OH的物质的量增加,d.重新达到平衡时,c(H2)/c(CH3OH)减小
解析:(1)0~tB时间内,生成nB mol CH3OH,则消耗2nB mol H2,则Δc(H2)=2nB/3 mol/L,v(H2)=2nB/(3tB)mol·L-1·min-1。,(2)选项a,任何时刻都有v生成(CH3OH)=v消耗(CO)。选项b,因混合气体的体积不变,混合气体的质量不变,任何时刻混合气体的密度都保持不变。选项c,根据=,m气体总不变,不变,说明n气体总不变,所以反应达到了平衡状态。选项d,各种物质的浓度不变,也说明了反应已达到平衡状态。,(3)压缩容器容积相当于增大体系压强,则平衡向着正反应方向移动,正、逆反应速率都增大,但由于容积缩小为原平衡的,达新平衡时c(H2)比原平衡时的大,由于平衡向正反应方向移动,重新达到平衡时c(H2)/c(CH3OH)减小,所以选项a、b错误,c、d正确。
答案:(1)mol·L-1·min-1 (2)cd (3)cd
13.(2010·武昌调研)有甲、乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g)。①向甲中通入4 mol A、2 mol B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
(1)若W%=40%,且建立平衡的过程中乙的压强有变化,则x=________。
(2)若W%=40%,且平衡时甲、乙的压强不同,则乙中平衡时c(A)=________。
(3)若x=4,则W%________40%(填“大于”、“小于”或“等于”)。
解析:(1)甲、乙为等效平衡,建立平衡的过程中乙的压强有变化,说明反应前后气体分子数不相等,则通过化学计量数换算成相同物质的浓度相等,根据化学方程式,3 mol C等效于mol A和mol B,故+1=4,解得x=2。(2)甲、乙为等效平衡,由于平衡时甲、乙压强不同,则反应前后气体分子数相等,故x=3。假设乙平衡建立过程中C转化的物质的量为n mol,则平衡时A、B、C的物质的量分别为(1+n)mol、(0.5+n)mol、(3-n)mol,则×100%=40%,解得n=1.2,故平衡时n(A)=1+×1.2=1.8(mol),c(A)=1.8 mol/L。(3)若x=4,则乙中等效于起始时通入2.5 mol A和1.25 mol B,相对于甲,乙中压强减小,平衡向正反应方向移动,因此C的体积分数增大,故W%大于40%。
答案:(1)2 (2)1.8 mol/L (3)大于,,
1.(2009·广州)下列有关化学反应速率的认识,正确的是( )
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大
B.温度升高,分子动能增加,减小了活化能,故反应速率增大
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
D.H+和OH-的反应活化能接近于零,反应几乎在瞬间完成
解析:增大压强,体积减小,活化分子总数不变,但活化分子浓度增大,反应速率增大,A不正确。温度升高,更多分子吸收能量成为活化分子,反应速率增大,活化能不变,B不正确。使用催化剂,降低活化能,使更多分子成为活化分子,反应速率增大,C不正确。
答案:D
2.(2010·赣州市质检)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体。下列措施对改变该反应的速率几乎没有影响的是( )
A.用相同浓度但温度较高的盐酸代替常温下的盐酸
B.增大反应体系的压强或减小反应体系的压强
C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙
D.改用与原盐酸含有相同H+浓度的稀硫酸
解析:温度高,反应速率提高;压强是通过改变气体的浓度来改变化学反应速率的,而该反应为固体碳酸钙与液体盐酸的反应,反应物中没有气体,故改变压强对该反应的速率几乎没有影响;粉末状态的固体表面积大,反应速率快;尽管强调了稀硫酸与原盐酸中的H+浓度相同,但硫酸与碳酸钙反应生成的CaSO4微溶,覆盖在碳酸钙表面,从而使碳酸钙与H+的接触面积减小,导致反应速率变慢。
答案:B
3.(2010·南昌市调研)已知NO2与N2O4可相互转化:2NO2(g) N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。下列推理分析合理的是( )
A.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
解析:根据反应达平衡后物质的浓度之比,可知初始反应浓度增加的曲线表示NO2变化曲线,前10 min内,v(NO2)=0.04 mol/(L·min);反应进行到10 min时,生成NO2 0.8 mol,吸收热量为9.68 kJ;a、b、c、d四点中只有b和d两点位于平衡状态,只有该两点正、逆反应速率相等;25 min时导致平衡移动的原因是增加NO2的浓度。,答案:B
4.(2010·北京市抽样)已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1
解析:该反应ΔH<0,为放热反应,升高温度,平衡向逆反应方向移动,n(CH3OH)减小,n(CO2)增大,减小,A错;反应达平衡时,CO2的转化率为×100%=75%,B对;3 min时,c(CH3OH)=c(CO2),由于3 min后c(CH3OH)增大,c(CO2)减小,即v正>v逆,因此用CO2的浓度表示的正反应速率大于用CH3OH的浓度表示的逆反应速率,C错;0~10 min内,v(CO2)==0.075 mol·L-1·min-1,根据同一反应中用不同物质表示的反应速率之比等于化学计量数之比,v(H2)=3v(CO2)=0.225 mol·L-1·min-1,D错。
答案:B
5.(2010·武汉市武昌区调研)一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
解析:以Z表示的反应速率为v(Z)==0.0005 mol/(L·s),根据同一反应中不同物质表示的反应速率之比等于化学计量数之比,则v(X)=2v(Z)=0.001 mol/(L·s),A对;将容器体积变为20 L,则压强减小,平衡向逆反应方向移动,Z的物质的量减小,则Z的平衡浓度小于原来的1/2,B错;增大压强,平衡向正反应方向移动,Y的转化率增大,C错;升高温度,X的体积分数增大,说明平衡向逆反应方向移动,而升高温度平衡向吸热反应方向移动,则正反应为放热反应,ΔH<0,D错。
答案:A
6.(2010·沪州市摸底考试)在两个恒容的密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g) CO(g)+H2(g);(乙)CO(g)+H2O(g) CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④断裂氢氧键的速率等于断裂氢氢键速率的2倍 ⑤混合气体密度不变 ⑥单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1 ⑦同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量,其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤ B.③④⑥
C.①⑥⑦ D.④⑦
解析:甲容器中,碳为固态,该可逆反应属于气体体积不相等的反应;乙容器中,反应属于等气体分子数的反应,气体相对分子质量、密度、压强都始终不变,①②⑤错误;各组分浓度相等,不能判断反应是否都达到了平衡状态,③错误。断裂氢氧键速率等于断裂氢氢键速率的2倍,经转化得,氢氧键的断裂速率等于生成氢氧键的速率,④正确;消耗水蒸气与生成氢气是同一反应方向,⑥错误;消耗氢气的物质的量等于同时生成水蒸气的物质的量,经转化得消耗氢气的物质的量等于生成氢气的物质的量,⑦正确。
答案:D
7.(2010·邯郸摸底考试)某密闭容器中充入等物质的量的气体A和B,在一定压强和温度下发生反应:A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确的是( )
A.30 min时降低温度,40 min时升高温度
B. 0~8 min内A的平均反应速率为0.08 mol·L-1·min-1
C. 反应方程式中的x=1,正反应为吸热反应
D. 54 min时C的体积分数大于40 min时
解析:根据时间—浓度变化图,20 min时反应达到平衡,此时A、B浓度减小1 mol·L-1,C的浓度为2 mol·L-1,推知x=1,则有:A(g)+B(g) 2C(g)。根据时间—速率图象,30 min时,正、逆反应速率降低,但平衡没有移动,不可能是降低温度引起的,可能是减小压强。40 min时改变条件导致正、逆反应速率均增大,但40 min瞬间A、B、C的浓度均不变,故改变的条件是升高温度。又因为逆反应速率增大的倍数大于正反应,平衡向逆反应方向移动,故54 min达到平衡时,C的体积分数小于40 min时,且推知反应为放热反应。0~8 min内,Δc(A)=2.0 mol·L-1-1.36 mol·L-1=0.64 mol·L-1,Δt=8 min,故v(A)=0.08 mol·L-1·min-1。综合上述,选项B正确。
答案:B
8.(2010·赣州市质检)在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
A.2 B.3
C.可能是2,也可能是3 D.无法确定
解析:根据恒温恒容条件下的等效平衡规律:对于反应前后气体的分子数不等的可逆反应,只要通过化学计量数换算成相同物质时浓度相等,就可以建立等效平衡;对于反应前后气体的分子数相等的可逆反应,只要通过化学计量数换算成相同物质时浓度之比与原来相等,就可以建立等效平衡。当x为2或3时,均能成立。
答案:C
9.在相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g);ΔH=-92.6 kJ/mol,实验测得起始与平衡时有关数据如下表所示:,
实验编号 起始时各物质的量/mol 达到平衡时体系能量的变化
N2 H2 NH3
① 1 3 0 23.15 kJ
② 0.9 2.7 0.2 Q
下列叙述错误的是( )
A.达到平衡时两容器中压强相同
B.平衡时两容器内NH3的体积分数均为
C.平均时容器②中Q=23.15 kJ
D.若容器①的容积为0.5 L,则平衡时放出的热量小于23.15 kJ
解析:将容器②中NH3的量转化为N2、H2后知,两个容器中相同的物质起始量相同,故它们可构成恒容条件下的等效平衡,平衡时两容器内各物质的量对应相等,A对;但通过反应生成NH3的量容器②的比①的少,故②中反应放出的热量少于23.15 kJ,C错;当容器容积扩大时,相当于减小压强,平衡向左移动,放出的热量减少,D对;由热化学方程式及平衡时放出的热量数值知,平衡时生成了0.5 mol NH3,混合气体共为3.5 mol,故B对。
答案:C
10.在一定容积的密闭容器中发生反应:X(g)+Y(g) Z(g)+W(s);ΔH>0。若开始投入1 mol X和1 mol Y,在一定条件下达到平衡,改变条件,其变化关系符合甲、乙图象。,下列有关判断正确的是( )
A.甲图表示温度对X转化率的影响,且Ⅰ温度较低
B.乙图一定表示压强对X体积分数的影响,且Ⅳ压强较高
C.甲图一定表示压强对X体积分数的影响,且Ⅰ压强较高
D.甲、乙图都可以表示温度、压强对平衡的影响,且Ⅰ>Ⅱ,Ⅲ<Ⅳ
解析:W为固态,该可逆反应的正反应是气体体积减小的吸热反应。若甲图表示压强对平衡的影响,根据先拐先平数值大,Ⅰ的压强较大,Ⅱ到Ⅰ(增大压强),平衡向右移动,X的转化率增大;若甲图表示温度对平衡影响,则Ⅰ的温度较高,Ⅱ到Ⅰ(升温),平衡向正方向移动,X的转化率增大,均符合题意。同理,乙图也可以表示温度、压强对平衡的影响,且Ⅳ一定大于(或高于)Ⅲ,只有D项正确。
答案:D
11.已知某反应A(g)+B(g) C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。,(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。,(3)在相同温度和压强下,对反应A(g)+B(g)??C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
,
A B C D
甲 a mol a mol 0 0
乙 2a mol a mol 0 0
丙 a mol a mol a mol a mol
丁 a mol 0 a mol a mol
上述四种情况达到平衡后,n(C)的大小顺序是________。
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是________。
A.气体平均摩尔质量不再变化
B. 气体压强不再变化
C. 气体密度不再变化
D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1
F. C生成的速率等于B消耗的速率
解析:(2)使用催化剂可以降低反应所需要的能量,但不影响反应的反应热;(3)依题意,四组实验中,温度、压强相等,容器的容积不一定相等。采用“一边倒”法,将产物转化成起始反应物,列表如下:,
A B C D
甲 a mol a mol 0 0
乙 2a mol a mol 0 0
丙 2a mol 2a mol 0 0
丁 2a mol a mol 0 0
等温等压下,起始物质投料物质的量(物质的量浓度)之比相同,达到同一平衡状态。根据表格数据知,甲和丙达到同一平均状态;乙和丁达到同一平衡状态。乙平衡状态,可以看成甲达到平衡后,向体系中增大A的浓度,平衡向右移动,C浓度增大。所以,达到平衡时,C的物质的量:乙=丁>甲=丙。
答案:(1)E1-E2 (2)减小 不变 (3)A (4)升高温度、增加B的浓度 (5)D
12.(2010·北京市东城区检测)一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g) CH3OH(g)达到化学平衡状态。
(1)500℃时,从反应开始到达到化学平衡状态,以H2的浓度变化表示的化学反应速率是________(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是________(填字母)。,a.v生成(CH3OH)=v消耗(CO),b.混合气体的密度不再改变,c.混合气体的平均相对分子质量不再改变,d.CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。,a.c(H2)减小,b.正反应速率加快,逆反应速率减慢,c.CH3OH的物质的量增加,d.重新达到平衡时,c(H2)/c(CH3OH)减小
解析:(1)0~tB时间内,生成nB mol CH3OH,则消耗2nB mol H2,则Δc(H2)=2nB/3 mol/L,v(H2)=2nB/(3tB)mol·L-1·min-1。,(2)选项a,任何时刻都有v生成(CH3OH)=v消耗(CO)。选项b,因混合气体的体积不变,混合气体的质量不变,任何时刻混合气体的密度都保持不变。选项c,根据=,m气体总不变,不变,说明n气体总不变,所以反应达到了平衡状态。选项d,各种物质的浓度不变,也说明了反应已达到平衡状态。,(3)压缩容器容积相当于增大体系压强,则平衡向着正反应方向移动,正、逆反应速率都增大,但由于容积缩小为原平衡的,达新平衡时c(H2)比原平衡时的大,由于平衡向正反应方向移动,重新达到平衡时c(H2)/c(CH3OH)减小,所以选项a、b错误,c、d正确。
答案:(1)mol·L-1·min-1 (2)cd (3)cd
13.(2010·武昌调研)有甲、乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g)。①向甲中通入4 mol A、2 mol B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
(1)若W%=40%,且建立平衡的过程中乙的压强有变化,则x=________。
(2)若W%=40%,且平衡时甲、乙的压强不同,则乙中平衡时c(A)=________。
(3)若x=4,则W%________40%(填“大于”、“小于”或“等于”)。
解析:(1)甲、乙为等效平衡,建立平衡的过程中乙的压强有变化,说明反应前后气体分子数不相等,则通过化学计量数换算成相同物质的浓度相等,根据化学方程式,3 mol C等效于mol A和mol B,故+1=4,解得x=2。(2)甲、乙为等效平衡,由于平衡时甲、乙压强不同,则反应前后气体分子数相等,故x=3。假设乙平衡建立过程中C转化的物质的量为n mol,则平衡时A、B、C的物质的量分别为(1+n)mol、(0.5+n)mol、(3-n)mol,则×100%=40%,解得n=1.2,故平衡时n(A)=1+×1.2=1.8(mol),c(A)=1.8 mol/L。(3)若x=4,则乙中等效于起始时通入2.5 mol A和1.25 mol B,相对于甲,乙中压强减小,平衡向正反应方向移动,因此C的体积分数增大,故W%大于40%。
答案:(1)2 (2)1.8 mol/L (3)大于,,
同课章节目录
