高中化学苏教版必修一 3.2.1 铁、铜的获取及应用 铁和铜及其化合物复习(共16张PPT)
文档属性
| 名称 | 高中化学苏教版必修一 3.2.1 铁、铜的获取及应用 铁和铜及其化合物复习(共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-28 00:00:00 | ||
图片预览






文档简介
(共16张PPT)
1.存在形式
铁:磁铁矿(Fe3O4)、赤铁矿(Fe2O3)
化合态
一.铁的获取和应用
游离态的铁来自陨石
2.铁的冶炼
原料:
C+O2=CO2
CO2+C=CO
CO+Fe2O3=Fe+CO2
设备:
炼铁高炉
铁矿石、焦炭、空气、石灰石等
原理:
(制备还原剂)
氧化还原
产物:
生铁
除碳
钢
条件:
高温
造渣(除脉石):
CaCO3
=
CO2↑+CaO
CaO+SiO2
=CaSiO3
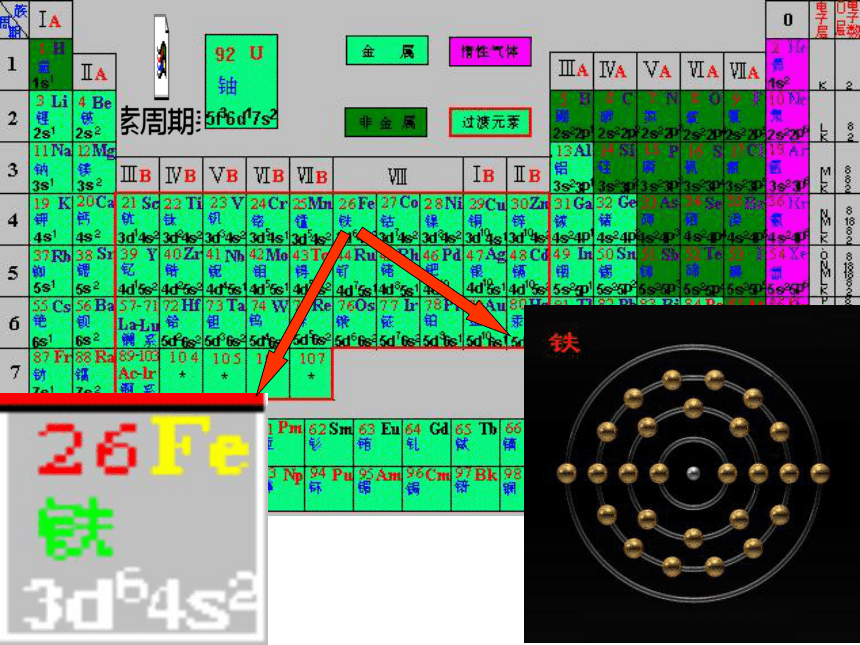
1.在元素周期表中的位置
铁位于第四周期第Ⅷ族,过渡元素
原子结构示意图为
2.铁的物理性质
铁具有银白色金属光泽,纯铁质软,
密度大(7.86g/cm3),
熔沸点高(熔点15350C,沸点是27500C)
,
有良好的延展性、导电性和导热性,
有铁磁性,能被磁铁吸引
二.铁的性质
3.铁的化学性质
Fe
–
2e
=
Fe2+
Fe
–
3e
=
Fe3+
Fe表现还原性
(1)铁与强氧化剂反应
Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O
a.铁与氯气、硝酸、浓硫酸等强氧化剂反应可显+3价
b.常温下,铁遇浓硫酸和浓硝酸钝化。
+3
+3
(2)铁与弱氧化剂反应
Fe
+
2H+
=
Fe2+
+
H2↑
(稀HCl或稀H2SO4)
+2
Fe
+
Cu2+
=
Cu+Fe2+
(与盐的反应)
+2
Fe+2Fe3+=3Fe2+
+2
(Fe3+的氧化性)
a.铁与H+、Cu2+、Fe3+等弱氧化剂反应
可显+2价
b.Fe与过量HNO3→Fe3+
Fe与少量HNO3→Fe2+
(3)与水的反应
(4)与氧气反应
(纯氧气)
4Fe(OH)2+O2+2H2O=4
Fe(OH)3
化学式
Fe(OH)2
Fe(OH)3
颜
色
状
态
溶解性
制备
加热
与
H+
转
化
Fe(OH)2的制备
①新制可溶性的Fe2+盐
②加热煮沸NaOH溶液
③胶头滴管伸入液面以下
④液面上加有机保护层
四、铁的氧化物
氧化亚铁
FeO
三氧化二铁
Fe2O3
四氧化三铁
Fe3O4(FeO?Fe2O3)
色态
俗称
铁元素价态
溶解性
稳定性
五、Fe3+
Fe2+的检验
Fe3+
:向溶液中滴加KSCN,若溶液变成血红色,则说明有Fe3+。
Fe2+:向溶液中滴加KSCN,无明显现象,再滴加适量的氯水或双氧水,溶液变成血红色,则说明有Fe2+
Fe、Fe2+、Fe3+的相互转化——“铁三角”关系
Fe
Fe3+
Fe2+
S、I2、H+、Cu2+、Ag+
、Fe3+
Cl2、Br2、O2、浓H2SO4、HNO3
Fe2O3:C、CO、H2、Al
Fe3+:Al、Fe等还原
FeO:C、CO、H2、Al
Fe2+:Al、Fe等还原
Cl2、Br2、O2、浓H2SO4、HNO3
酸性KMnO4、Na2O2、H2O2等
Fe、Cu、I-等
小结
1、配制氯化铁和氯化亚铁溶液要注意什么,具体如何操作?
2、氯化铁溶液中混有少量的氯化亚铁如何除去,反之呢?
3、如何验证氯化铁溶液中混有氯化亚铁?
例1:下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是(
)
A.FeO
B.Fe2O3
C.FeCl3
D.FeSO4
例2:为了防止试剂变质,配制FeSO4的溶液在试剂瓶中除加入少量H2SO4外,还要加入(
)
A.加入Cu
B.通入Cl2
C.加入Fe
D.加入KSCN
AD
C
3.向含有FeCl3、BaCl2的混合液中通入SO2,有白色沉淀生成,过滤后,向溶液中滴入KSCN溶液,无明显现象,由此得出的正确说法是(
)
A。白色沉淀是BaSO3
B。白色沉淀是BaSO4
C。白色沉淀是BaSO3
、BaSO4的混合物
D。FeCl3被还原为FeCl2
4.能与Fe3+反应且能说明Fe3+具有氧化性的是
(
)
①SCN-
②Fe
③Fe3+
④Cu
⑤H2S
⑥OH-
A.①②③
B.②④⑤
C.①③⑥
D.①②⑤
BD
B
1.存在形式
铁:磁铁矿(Fe3O4)、赤铁矿(Fe2O3)
化合态
一.铁的获取和应用
游离态的铁来自陨石
2.铁的冶炼
原料:
C+O2=CO2
CO2+C=CO
CO+Fe2O3=Fe+CO2
设备:
炼铁高炉
铁矿石、焦炭、空气、石灰石等
原理:
(制备还原剂)
氧化还原
产物:
生铁
除碳
钢
条件:
高温
造渣(除脉石):
CaCO3
=
CO2↑+CaO
CaO+SiO2
=CaSiO3
1.在元素周期表中的位置
铁位于第四周期第Ⅷ族,过渡元素
原子结构示意图为
2.铁的物理性质
铁具有银白色金属光泽,纯铁质软,
密度大(7.86g/cm3),
熔沸点高(熔点15350C,沸点是27500C)
,
有良好的延展性、导电性和导热性,
有铁磁性,能被磁铁吸引
二.铁的性质
3.铁的化学性质
Fe
–
2e
=
Fe2+
Fe
–
3e
=
Fe3+
Fe表现还原性
(1)铁与强氧化剂反应
Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O
a.铁与氯气、硝酸、浓硫酸等强氧化剂反应可显+3价
b.常温下,铁遇浓硫酸和浓硝酸钝化。
+3
+3
(2)铁与弱氧化剂反应
Fe
+
2H+
=
Fe2+
+
H2↑
(稀HCl或稀H2SO4)
+2
Fe
+
Cu2+
=
Cu+Fe2+
(与盐的反应)
+2
Fe+2Fe3+=3Fe2+
+2
(Fe3+的氧化性)
a.铁与H+、Cu2+、Fe3+等弱氧化剂反应
可显+2价
b.Fe与过量HNO3→Fe3+
Fe与少量HNO3→Fe2+
(3)与水的反应
(4)与氧气反应
(纯氧气)
4Fe(OH)2+O2+2H2O=4
Fe(OH)3
化学式
Fe(OH)2
Fe(OH)3
颜
色
状
态
溶解性
制备
加热
与
H+
转
化
Fe(OH)2的制备
①新制可溶性的Fe2+盐
②加热煮沸NaOH溶液
③胶头滴管伸入液面以下
④液面上加有机保护层
四、铁的氧化物
氧化亚铁
FeO
三氧化二铁
Fe2O3
四氧化三铁
Fe3O4(FeO?Fe2O3)
色态
俗称
铁元素价态
溶解性
稳定性
五、Fe3+
Fe2+的检验
Fe3+
:向溶液中滴加KSCN,若溶液变成血红色,则说明有Fe3+。
Fe2+:向溶液中滴加KSCN,无明显现象,再滴加适量的氯水或双氧水,溶液变成血红色,则说明有Fe2+
Fe、Fe2+、Fe3+的相互转化——“铁三角”关系
Fe
Fe3+
Fe2+
S、I2、H+、Cu2+、Ag+
、Fe3+
Cl2、Br2、O2、浓H2SO4、HNO3
Fe2O3:C、CO、H2、Al
Fe3+:Al、Fe等还原
FeO:C、CO、H2、Al
Fe2+:Al、Fe等还原
Cl2、Br2、O2、浓H2SO4、HNO3
酸性KMnO4、Na2O2、H2O2等
Fe、Cu、I-等
小结
1、配制氯化铁和氯化亚铁溶液要注意什么,具体如何操作?
2、氯化铁溶液中混有少量的氯化亚铁如何除去,反之呢?
3、如何验证氯化铁溶液中混有氯化亚铁?
例1:下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是(
)
A.FeO
B.Fe2O3
C.FeCl3
D.FeSO4
例2:为了防止试剂变质,配制FeSO4的溶液在试剂瓶中除加入少量H2SO4外,还要加入(
)
A.加入Cu
B.通入Cl2
C.加入Fe
D.加入KSCN
AD
C
3.向含有FeCl3、BaCl2的混合液中通入SO2,有白色沉淀生成,过滤后,向溶液中滴入KSCN溶液,无明显现象,由此得出的正确说法是(
)
A。白色沉淀是BaSO3
B。白色沉淀是BaSO4
C。白色沉淀是BaSO3
、BaSO4的混合物
D。FeCl3被还原为FeCl2
4.能与Fe3+反应且能说明Fe3+具有氧化性的是
(
)
①SCN-
②Fe
③Fe3+
④Cu
⑤H2S
⑥OH-
A.①②③
B.②④⑤
C.①③⑥
D.①②⑤
BD
B
