选修4 专题一 第二单元 化学能与电能的转化 电解池工作原理 课件(27张PPT)
文档属性
| 名称 | 选修4 专题一 第二单元 化学能与电能的转化 电解池工作原理 课件(27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-28 00:00:00 | ||
图片预览




文档简介
(共27张PPT)
高二年《化学反应原理》苏教版
专题一化学反应能量与变化
(2)两个活性不同的电极
(3)电解质溶液(一般与活泼性强的电极能发生氧化还原反应)
(4)形成闭合回路
(1)自发进行的氧化还原反应
1、构成原电池的条件是什么?
负极:
正极:
电池总反应:
Zn
–
2e-
=
Zn2+
Cu2+
+
2e-
=
Cu
Zn+Cu2+
=
Zn2++Cu
2、原电池的电极反应式?
3、原电池中的能量转化形式是什么?
化学能转化成电能
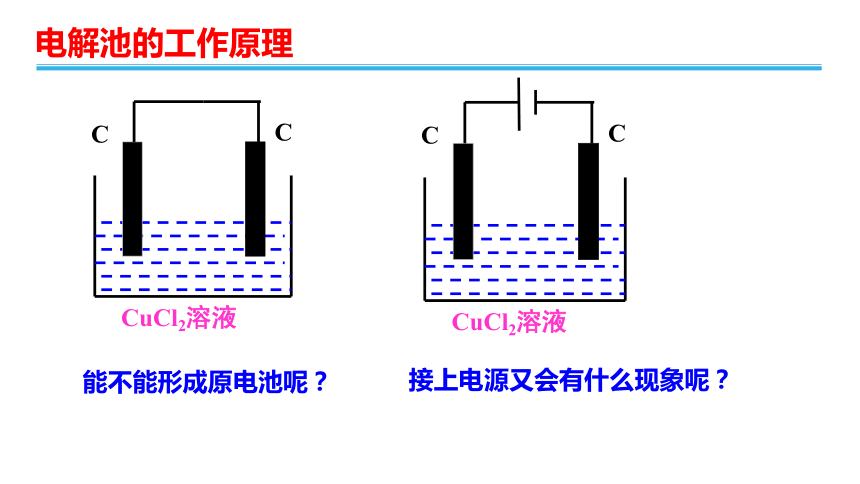
能不能形成原电池呢?
接上电源又会有什么现象呢?
(1)向氯化铜溶液中通入直流电
实验:将两根石墨棒分别跟直流电源的正极和负极连接,浸入U型管的CuCl2溶液中
,再接通12V直流电,观察现象。约3~5min后切断电源。
动一动
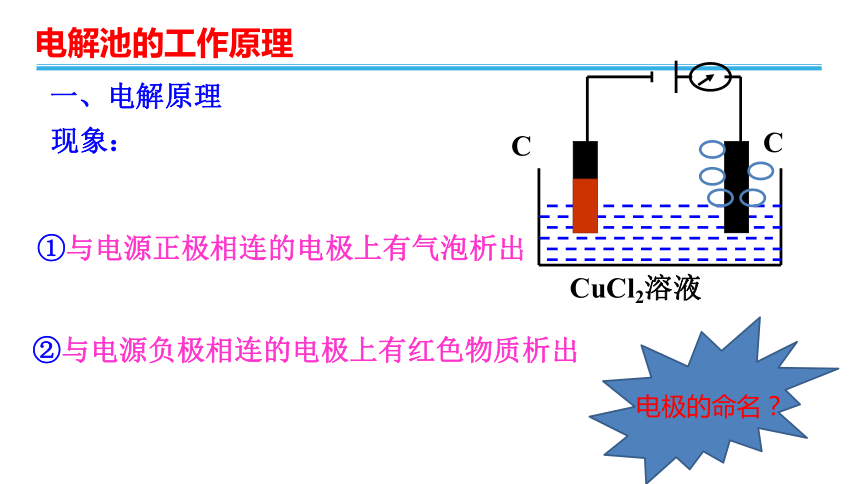
一、电解原理
现象:
②与电源负极相连的电极上有红色物质析出
①与电源正极相连的电极上有气泡析出
电极的命名?
一、电解原理
1.电解:
使电流通过电解质溶液而在阴、阳两极
引起氧化还原反应的过程。
2.电解池:
电能转化为化学能的装置
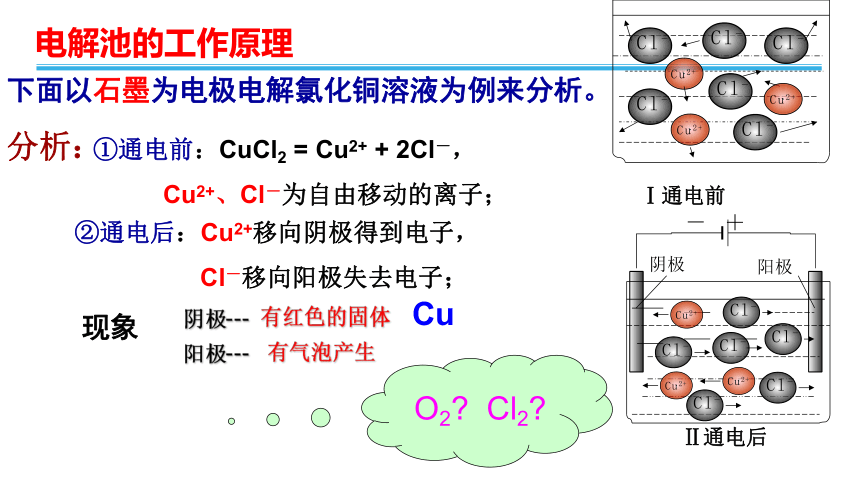
分析:
①通电前:CuCl2
=
Cu2+
+
2Cl-,
Cu2+、Cl-为自由移动的离子;
②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;
Ⅰ通电前
有红色的固体
Cu
有气泡产生
O2?
Cl2?
下面以石墨为电极电解氯化铜溶液为例来分析。
有气泡,湿润KI-淀
粉试纸变蓝,气体有刺激性气味
碳棒上有一层红色的物质析出
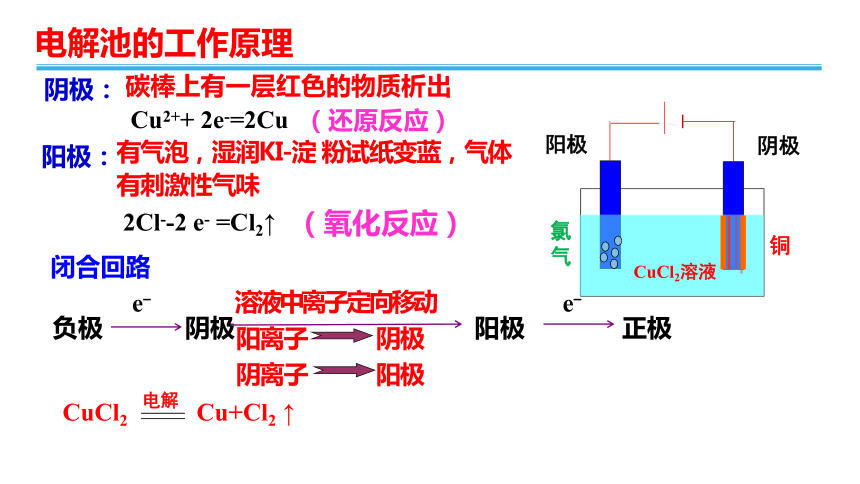
阴极:
阳极:
阳离子
阴极
阴离子
阳极
闭合回路
2Cl--2
e-
=Cl2↑
Cu2++
2e-=2Cu
(氧化反应)
(还原反应)
电解:CuCl2
Cu+Cl2
↑
2Cl--2
e-
=Cl2
阴离子移向
阳离子移向
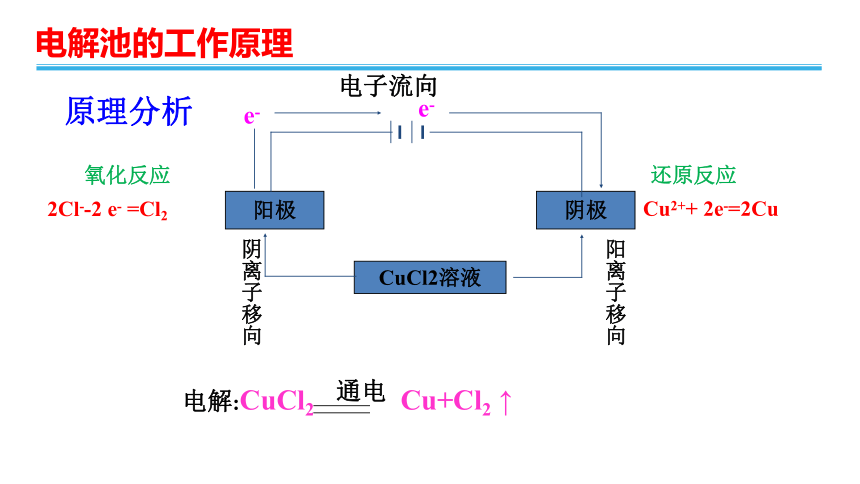
电子流向
阳极
阴极
CuCl2溶液
e-
e-
氧化反应
还原反应
Cu2++
2e-=2Cu
原理分析
实验探究电解原理
(1)电解熔融的氯化钠
电解熔融电解质又会发生什么反应呢?
电解法制钠
通电前,
Na+
Cl-
在
__________运动。
通电后,
Na+向__
极(与电源____相连)移动,Cl-向__
极(与电源___
相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生_______反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
总反应为_______________________。
阴
无规则自由
负极
阳
正极
电解池阴
氧化
还原
电源正
2Na++
2e-==2Na
2Cl--2e-==Cl2↑
电解熔融氯化钠
熔融NaCl
阴极
阳极
e-
e-
2Cl--2e-
=
Cl2?
2Na++
2e-
=
2Na
(还原反应)
(氧化反应)
3.电解池构成条件
(1)
外加直流电源
(2)
两个电极
(3)有
电解质溶液或熔融电解质
阳极:接电源正极
阴极:接电源负极
惰性电极:C、Pt、Au等
活性电极:Fe、Cu、Ag等
电极
材料
名称
(4)形成闭合回路
阴极放电顺序(阳离子得电子能力)
阳极放电顺序(阴离子失电子能力)
活性金属电极>S2->
I->Br->Cl->OH->非还原性含氧酸根>F-
含氧酸根、
F-在水溶液中不放电
Al3+~
K+水溶液中不放电,熔融状态放电
Ag+>Hg2+>
Fe3+>
Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>
H+(水)
>Al3+>Mg2+>Na+
>Ca2+>K+
放电:阴阳离子在阴阳两级失去或者得到电子,发生氧化还原反应的过程叫做放电。
4.阴阳离子放电顺序
溶液中氢离子和氢氧根离子定向移动了吗?为什么它们没有放电?
写出用石墨做电极电解CuSO4溶液的电极反应式及总电解方程式
阴极:
阳极:
③两极相加得总方程式
4OHˉ
-4eˉ
=O2↑+2H2O
2Cu2+
+
4eˉ
=2Cu
OH-
>
SO42ˉ
H+
<
Cu2+
①首先分析、比较出阴阳极的放电离子
②然后写电极反应式
:
5.电极反应式与电解离子方程式书写
阴极:
阳极:
(注意:来自弱电解质的离子改用分子形式,否则仍为离子)
(按离子方程式要求处理)
(氧化反应)
(还原反应)
分析电解反应的一般思路:
明确溶液中存在哪些离子
根据阳极氧化,阴极还原分析得出产物
阴阳两极附近有哪些离子
阳极
阴极
氧气
氢
气
Na2SO4溶液
阳极:
4OH-
-
4e-
=2H2O+O2
↑
阴极:
4H
++
4e-
=
2H2
↑
写出用惰性电极电解Na2SO4溶液和NaCl溶液时所发生的电极反应方程式
练一练
阳极
阴极
氯气
氢
气
NaCl溶液
阳极:
2Cl-
-
2e-
=
Cl
2↑
阴极:
2H
++
2e-
=H2
↑
写出用惰性电极电解Na2SO4溶液和NaCl溶液时所发生的电极反应方程式
练一练
电能转化为化学能
阳极(接电源正极)
阴极(接电源负极)
阴离子向阳极迁移
阳离子向阴极迁移
化学能转化为电能
负极
正极
阴离子向负极迁移
阳离子向正极迁移
都是氧化还原反应
6.原电池与电解池的比较:
电解池
能量转换
离子的迁移方向
发生氧化反应的电极
发生还原反应的电极
原电池
相同点
(从原理分析)
电解原理
1.电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程
2.电解池的构成条件,熟悉电解装置示意图及电
极反应式的书写
阳极:金属活性电极>S2-
>
I-
>
Br-
>
Cl-
>
OH-
>
含氧酸根
>
F-
阴极:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+
小结
石墨
石墨
CuSO4溶液
(A)
CuSO4溶液
CuSO4溶液
(C)
(B)
铁
铜
铜
铁
1.写出下列装置中所发生的电极反应方程式
惰性电极
课后作业
CuSO4溶液
(B)
铜
铁
阳极:Cu—
2e-
=
Cu2+
阴极:Cu2++
2e-
=Cu
1.写出下列装置中所发生的电极反应方程式
课后作业
CuSO4溶液
(C)
铁
铜
阳极:
Fe—
2e-
=
Fe2+
阴极:Cu2++
2e-
=Cu
2.写出下列装置中所发生的电极反应方程式
课后作业
3.下图所示装置中a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法正确的是(
)
A
A、X是正极,Y是负极
B、X是负极,Y是正极
C、CuSO4溶液的PH值逐渐增大
D、CuSO4溶液的PH值不变
有碱性物质生成
即H+反应
阴极
负极
阴极
阳极
用惰性电极电解CuSO4溶液
课后作业
4.电解NO制备
NH4NO3的原理如图所示,X、Y为Pt电极,为使电解产物全部转化为NH4NO3,需补充
物质A。下列说法正确的是(
)
A、物质A为NH3
B、X电极为电解池阳极
C、Y电极上发生了还原反应
D、Y电极反应式:
NO-3e-+4OH—
==
NO3—+2H2O
A
阴极
阳极
氧化反应
NO-3e-+
2H2O==
NO3—+4H+
8NO
+
12H2O
==
3NH4NO3+2HNO3
HNO3
+
NH3
==
NH4NO3
课后作业
高二年《化学反应原理》苏教版
专题一化学反应能量与变化
(2)两个活性不同的电极
(3)电解质溶液(一般与活泼性强的电极能发生氧化还原反应)
(4)形成闭合回路
(1)自发进行的氧化还原反应
1、构成原电池的条件是什么?
负极:
正极:
电池总反应:
Zn
–
2e-
=
Zn2+
Cu2+
+
2e-
=
Cu
Zn+Cu2+
=
Zn2++Cu
2、原电池的电极反应式?
3、原电池中的能量转化形式是什么?
化学能转化成电能
能不能形成原电池呢?
接上电源又会有什么现象呢?
(1)向氯化铜溶液中通入直流电
实验:将两根石墨棒分别跟直流电源的正极和负极连接,浸入U型管的CuCl2溶液中
,再接通12V直流电,观察现象。约3~5min后切断电源。
动一动
一、电解原理
现象:
②与电源负极相连的电极上有红色物质析出
①与电源正极相连的电极上有气泡析出
电极的命名?
一、电解原理
1.电解:
使电流通过电解质溶液而在阴、阳两极
引起氧化还原反应的过程。
2.电解池:
电能转化为化学能的装置
分析:
①通电前:CuCl2
=
Cu2+
+
2Cl-,
Cu2+、Cl-为自由移动的离子;
②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;
Ⅰ通电前
有红色的固体
Cu
有气泡产生
O2?
Cl2?
下面以石墨为电极电解氯化铜溶液为例来分析。
有气泡,湿润KI-淀
粉试纸变蓝,气体有刺激性气味
碳棒上有一层红色的物质析出
阴极:
阳极:
阳离子
阴极
阴离子
阳极
闭合回路
2Cl--2
e-
=Cl2↑
Cu2++
2e-=2Cu
(氧化反应)
(还原反应)
电解:CuCl2
Cu+Cl2
↑
2Cl--2
e-
=Cl2
阴离子移向
阳离子移向
电子流向
阳极
阴极
CuCl2溶液
e-
e-
氧化反应
还原反应
Cu2++
2e-=2Cu
原理分析
实验探究电解原理
(1)电解熔融的氯化钠
电解熔融电解质又会发生什么反应呢?
电解法制钠
通电前,
Na+
Cl-
在
__________运动。
通电后,
Na+向__
极(与电源____相连)移动,Cl-向__
极(与电源___
相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生_______反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
总反应为_______________________。
阴
无规则自由
负极
阳
正极
电解池阴
氧化
还原
电源正
2Na++
2e-==2Na
2Cl--2e-==Cl2↑
电解熔融氯化钠
熔融NaCl
阴极
阳极
e-
e-
2Cl--2e-
=
Cl2?
2Na++
2e-
=
2Na
(还原反应)
(氧化反应)
3.电解池构成条件
(1)
外加直流电源
(2)
两个电极
(3)有
电解质溶液或熔融电解质
阳极:接电源正极
阴极:接电源负极
惰性电极:C、Pt、Au等
活性电极:Fe、Cu、Ag等
电极
材料
名称
(4)形成闭合回路
阴极放电顺序(阳离子得电子能力)
阳极放电顺序(阴离子失电子能力)
活性金属电极>S2->
I->Br->Cl->OH->非还原性含氧酸根>F-
含氧酸根、
F-在水溶液中不放电
Al3+~
K+水溶液中不放电,熔融状态放电
Ag+>Hg2+>
Fe3+>
Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>
H+(水)
>Al3+>Mg2+>Na+
>Ca2+>K+
放电:阴阳离子在阴阳两级失去或者得到电子,发生氧化还原反应的过程叫做放电。
4.阴阳离子放电顺序
溶液中氢离子和氢氧根离子定向移动了吗?为什么它们没有放电?
写出用石墨做电极电解CuSO4溶液的电极反应式及总电解方程式
阴极:
阳极:
③两极相加得总方程式
4OHˉ
-4eˉ
=O2↑+2H2O
2Cu2+
+
4eˉ
=2Cu
OH-
>
SO42ˉ
H+
<
Cu2+
①首先分析、比较出阴阳极的放电离子
②然后写电极反应式
:
5.电极反应式与电解离子方程式书写
阴极:
阳极:
(注意:来自弱电解质的离子改用分子形式,否则仍为离子)
(按离子方程式要求处理)
(氧化反应)
(还原反应)
分析电解反应的一般思路:
明确溶液中存在哪些离子
根据阳极氧化,阴极还原分析得出产物
阴阳两极附近有哪些离子
阳极
阴极
氧气
氢
气
Na2SO4溶液
阳极:
4OH-
-
4e-
=2H2O+O2
↑
阴极:
4H
++
4e-
=
2H2
↑
写出用惰性电极电解Na2SO4溶液和NaCl溶液时所发生的电极反应方程式
练一练
阳极
阴极
氯气
氢
气
NaCl溶液
阳极:
2Cl-
-
2e-
=
Cl
2↑
阴极:
2H
++
2e-
=H2
↑
写出用惰性电极电解Na2SO4溶液和NaCl溶液时所发生的电极反应方程式
练一练
电能转化为化学能
阳极(接电源正极)
阴极(接电源负极)
阴离子向阳极迁移
阳离子向阴极迁移
化学能转化为电能
负极
正极
阴离子向负极迁移
阳离子向正极迁移
都是氧化还原反应
6.原电池与电解池的比较:
电解池
能量转换
离子的迁移方向
发生氧化反应的电极
发生还原反应的电极
原电池
相同点
(从原理分析)
电解原理
1.电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程
2.电解池的构成条件,熟悉电解装置示意图及电
极反应式的书写
阳极:金属活性电极>S2-
>
I-
>
Br-
>
Cl-
>
OH-
>
含氧酸根
>
F-
阴极:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+
小结
石墨
石墨
CuSO4溶液
(A)
CuSO4溶液
CuSO4溶液
(C)
(B)
铁
铜
铜
铁
1.写出下列装置中所发生的电极反应方程式
惰性电极
课后作业
CuSO4溶液
(B)
铜
铁
阳极:Cu—
2e-
=
Cu2+
阴极:Cu2++
2e-
=Cu
1.写出下列装置中所发生的电极反应方程式
课后作业
CuSO4溶液
(C)
铁
铜
阳极:
Fe—
2e-
=
Fe2+
阴极:Cu2++
2e-
=Cu
2.写出下列装置中所发生的电极反应方程式
课后作业
3.下图所示装置中a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法正确的是(
)
A
A、X是正极,Y是负极
B、X是负极,Y是正极
C、CuSO4溶液的PH值逐渐增大
D、CuSO4溶液的PH值不变
有碱性物质生成
即H+反应
阴极
负极
阴极
阳极
用惰性电极电解CuSO4溶液
课后作业
4.电解NO制备
NH4NO3的原理如图所示,X、Y为Pt电极,为使电解产物全部转化为NH4NO3,需补充
物质A。下列说法正确的是(
)
A、物质A为NH3
B、X电极为电解池阳极
C、Y电极上发生了还原反应
D、Y电极反应式:
NO-3e-+4OH—
==
NO3—+2H2O
A
阴极
阳极
氧化反应
NO-3e-+
2H2O==
NO3—+4H+
8NO
+
12H2O
==
3NH4NO3+2HNO3
HNO3
+
NH3
==
NH4NO3
课后作业
