选修4 专题一 第二单元 化学能与电能的转化 课件(21张PPT)
文档属性
| 名称 | 选修4 专题一 第二单元 化学能与电能的转化 课件(21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-29 17:18:11 | ||
图片预览





文档简介
(共21张PPT)
普通高中化学(苏教版)选修4
专题一
第二单元
化学能与电能的转化
化学能
热能
电能
1.原电池定义:
利用氧化还原反应原理,将化学能转变为电能的装置。
Zn
+
2H+
=
Zn2+
+
H2↑
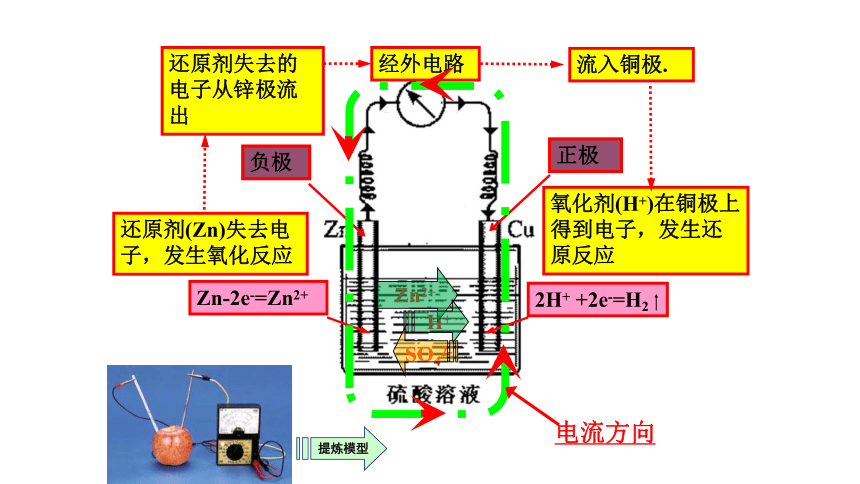
请将下图提炼为课本中的单池原电池结构并完成下列问题。
负极反应方程式:
正极反应方程式:
阳离子移动方向:
电子流动方向:
阴离子移动方向:
电流流动方向:
负极
正极
Zn-2e-=Zn2+
2H+
+2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
提炼模型
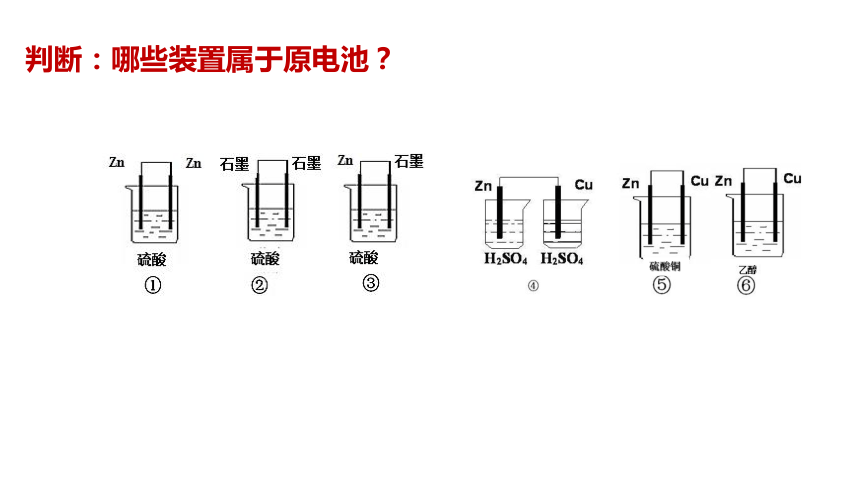
判断:哪些装置属于原电池?
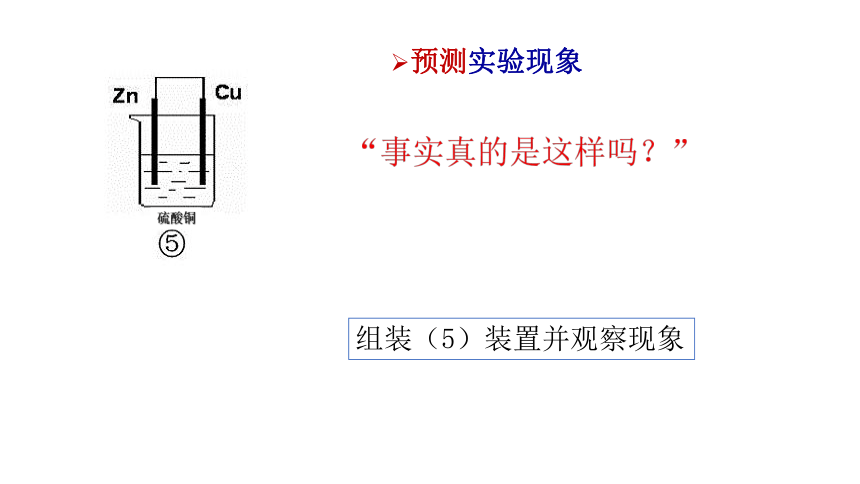
硫酸铜
预测实验现象
“事实真的是这样吗?”
组装(5)装置并观察现象
硫酸铜
铜片表面有红色物质析出;锌片表面有黑色物质析出
,断开导线继续有黑色物质析出
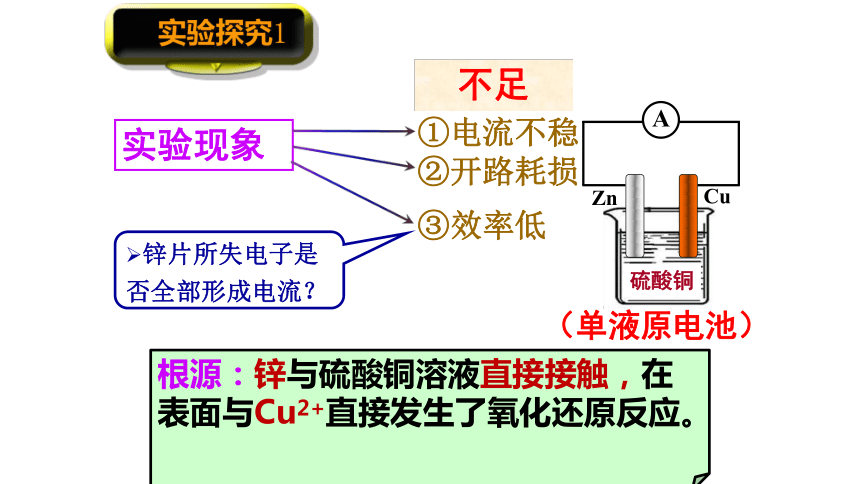
实验探究1
实验验证黑色物质为铜。
课外活动
电流不稳定
组装(5)装置并观察现象
Cu
Cu
Cu
实验现象
不足
①电流不稳
②开路耗损
硫酸铜
Cu
Zn
A
(单液原电池)
锌片所失电子是否全部形成电流?
③效率低
实验探究1
根源:锌与硫酸铜溶液直接接触,在表面与Cu2+直接发生了氧化还原反应。
提出设想
NaCl溶液
?
实验探究1
非
Cu2+
Zn
Cu
A
CuSO4溶液
浸NaCl滤纸
导线
外电路
内电路
根源
电极插入电解质溶液
闭合回路
表针同样偏转,且电流稳定
按上述设计装置进行实验
实验探究2
铜片表面有铜析出,锌片逐渐溶解表面无铜析出,取出“浸NaCl滤纸条”表针回零。
实验探究2
A
CuSO4溶液
NaCl溶液
Zn
Cu
浸NaCl滤纸
结论:氧化剂和还原剂在没有直接接触的情况也可以构成原电池(双液),但需用到浸有NaCl饱和溶液的滤纸条(化学上叫“盐桥”)。
实验探究2
实验室常用盐桥
盐桥中通常装有含琼胶的KCl饱和溶液
浸NaCl滤纸
效果更好
A
CuSO4溶液
Zn
Cu
教材实验
2
优点:
①电流稳定
②开路零耗
③效率高
实验探究3
NaCl溶液
浸NaCl滤纸
ZnSO4溶液
与【探究2】现象相同
电流更持久
电流表
分析示意图
分析示意图
负极(锌片):
Zn
-2e
-
=
Zn
2+
正极(铜片):
Cu2+
+
2e
-
=
Cu
电池反应:Zn
+
Cu2+
=
Zn
2+
+
Cu
盐桥的作用:
①形成闭合回路(离子通道)
②平衡溶液电荷(离子库)
归纳总结
(导电)
(导电、还原反应)
ZnSO4溶液
CuSO4溶液
巩固提升
2、利用Fe
+
Cu2+=Fe2+
+Cu设计一个双液原电池,画出示意图,写出电极反应、外电路中电子的流向。
Cu
Fe
CuSO4
FeSO4
e-
负极:Fe
–
2e-
=Fe2+
正极:Cu2+
+2e-
=Cu
归纳出设计双液原电池的步骤,
先拆分、后选材。
巩固提升
3、下列关于原电池的叙述正确的是(
)
A、原电池的正极和负极必须是两种不同的金属
B、原电池是将化学能转变为电能的装置
C、原电池中电子流出的一极是负极,该极被还原
D、原电池放电时,电流的方向是从负极到正极
4、稀H2SO4的烧杯中放入导线连接的锌片和铜片,叙述正确的是(
)
A、正极附近的SO42—离子
浓度逐渐增大
B、电子通过导线由铜片流向锌片
C、正极有O2逸出
D、铜片上有H2逸出
B
巩固提升
D
课后练习
5、判断下列电池并写出电极反应方程式:
Thank
You!
普通高中化学(苏教版)选修4
专题一
第二单元
化学能与电能的转化
化学能
热能
电能
1.原电池定义:
利用氧化还原反应原理,将化学能转变为电能的装置。
Zn
+
2H+
=
Zn2+
+
H2↑
请将下图提炼为课本中的单池原电池结构并完成下列问题。
负极反应方程式:
正极反应方程式:
阳离子移动方向:
电子流动方向:
阴离子移动方向:
电流流动方向:
负极
正极
Zn-2e-=Zn2+
2H+
+2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
提炼模型
判断:哪些装置属于原电池?
硫酸铜
预测实验现象
“事实真的是这样吗?”
组装(5)装置并观察现象
硫酸铜
铜片表面有红色物质析出;锌片表面有黑色物质析出
,断开导线继续有黑色物质析出
实验探究1
实验验证黑色物质为铜。
课外活动
电流不稳定
组装(5)装置并观察现象
Cu
Cu
Cu
实验现象
不足
①电流不稳
②开路耗损
硫酸铜
Cu
Zn
A
(单液原电池)
锌片所失电子是否全部形成电流?
③效率低
实验探究1
根源:锌与硫酸铜溶液直接接触,在表面与Cu2+直接发生了氧化还原反应。
提出设想
NaCl溶液
?
实验探究1
非
Cu2+
Zn
Cu
A
CuSO4溶液
浸NaCl滤纸
导线
外电路
内电路
根源
电极插入电解质溶液
闭合回路
表针同样偏转,且电流稳定
按上述设计装置进行实验
实验探究2
铜片表面有铜析出,锌片逐渐溶解表面无铜析出,取出“浸NaCl滤纸条”表针回零。
实验探究2
A
CuSO4溶液
NaCl溶液
Zn
Cu
浸NaCl滤纸
结论:氧化剂和还原剂在没有直接接触的情况也可以构成原电池(双液),但需用到浸有NaCl饱和溶液的滤纸条(化学上叫“盐桥”)。
实验探究2
实验室常用盐桥
盐桥中通常装有含琼胶的KCl饱和溶液
浸NaCl滤纸
效果更好
A
CuSO4溶液
Zn
Cu
教材实验
2
优点:
①电流稳定
②开路零耗
③效率高
实验探究3
NaCl溶液
浸NaCl滤纸
ZnSO4溶液
与【探究2】现象相同
电流更持久
电流表
分析示意图
分析示意图
负极(锌片):
Zn
-2e
-
=
Zn
2+
正极(铜片):
Cu2+
+
2e
-
=
Cu
电池反应:Zn
+
Cu2+
=
Zn
2+
+
Cu
盐桥的作用:
①形成闭合回路(离子通道)
②平衡溶液电荷(离子库)
归纳总结
(导电)
(导电、还原反应)
ZnSO4溶液
CuSO4溶液
巩固提升
2、利用Fe
+
Cu2+=Fe2+
+Cu设计一个双液原电池,画出示意图,写出电极反应、外电路中电子的流向。
Cu
Fe
CuSO4
FeSO4
e-
负极:Fe
–
2e-
=Fe2+
正极:Cu2+
+2e-
=Cu
归纳出设计双液原电池的步骤,
先拆分、后选材。
巩固提升
3、下列关于原电池的叙述正确的是(
)
A、原电池的正极和负极必须是两种不同的金属
B、原电池是将化学能转变为电能的装置
C、原电池中电子流出的一极是负极,该极被还原
D、原电池放电时,电流的方向是从负极到正极
4、稀H2SO4的烧杯中放入导线连接的锌片和铜片,叙述正确的是(
)
A、正极附近的SO42—离子
浓度逐渐增大
B、电子通过导线由铜片流向锌片
C、正极有O2逸出
D、铜片上有H2逸出
B
巩固提升
D
课后练习
5、判断下列电池并写出电极反应方程式:
Thank
You!
