第一单元 弱电解质的电离平衡 课件(20张PPT)
文档属性
| 名称 | 第一单元 弱电解质的电离平衡 课件(20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-29 17:31:39 | ||
图片预览







文档简介
(共20张PPT)
专题3
弱电解质的电离平衡
第一节
强电解质和弱电解质
潮湿的手触摸正在工作的电器,可能会发生触电事故.
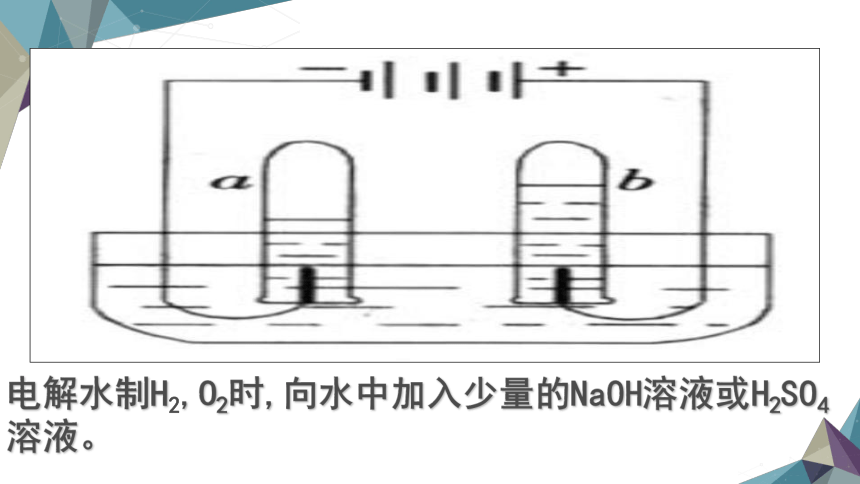
电解水制H2,O2时,向水中加入少量的NaOH溶液或H2SO4溶液。
(1)掌握强电解质与弱电解质的概念;
(2)了解强、弱电解质在水溶液中电离程度的差异及原因.
电解质:
非电解质:
(一)电解质和非电解质
在水溶液中或熔融状态下能够导电的化合物。
在水溶液中或熔融状态下都不能导电的化合物。
复习巩固
1.醋酸和盐酸是常见的两种酸,根据你的经验,你认为它们的电离程度有无差异?
2.你能设计实验验证你的猜想吗?
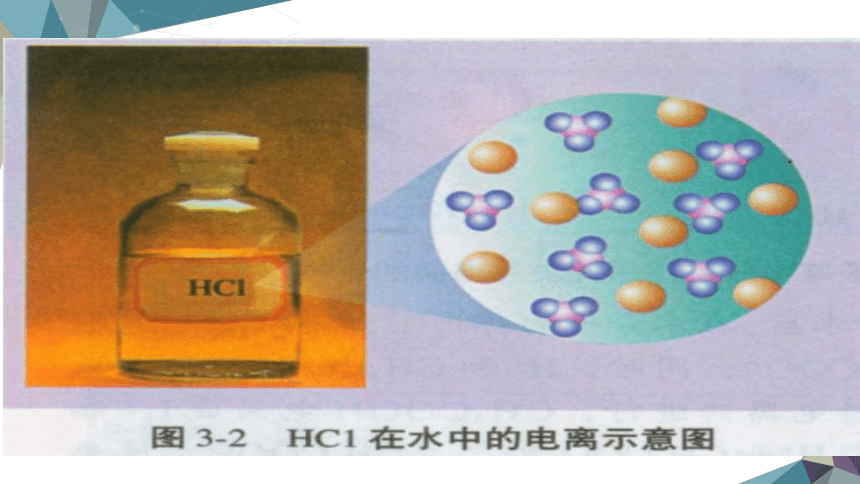
电解质在水溶液中或熔化状态下离解成自由移动离子的过程
实验1:
测量物质的量浓度均为1
mol/L
盐酸、醋酸的pH。
(资料:pH
=
-
lg
c(H+))
pH试纸使用方法:
1.将pH试纸放在表面皿上
2.用洁净的玻璃棒沾取待测液点在试纸中央
3.和标准比色卡对照
实验2:
物质的量浓度均为1mol/L的盐酸和醋酸与等质量镁条反应。
大
小
前者电离程度小,后者大
慢
快
前者电离程度小,后者大
表3-1
盐酸和醋酸的性质比较
溶液的pH
方法
醋酸
盐酸
对实验现象的解释
与镁条反应
根据你的经验,你认为相同浓度的氢氧化钠溶液与氨水的电离程度有无差异?请提出你的假设并设计实验加以验证
实验假设
实验方案
实验现象
结论
(二)强电解质和弱电解质
强电解质:
弱电解质:
在水溶液或熔融状态里只能部分电离的电解质。
在水溶液或熔融状态里能完全电离的
电解质
强电解质
弱电解质
电离程度
完全电离
部分电离
水溶液里溶质粒子存在形态
阴、阳离子
阴、阳离子和分子
电离过程
不可逆
=
可逆
思考并讨论
1.难溶物一定是弱电解质吗?
2.强电解质溶液的导电能力一定强吗?
3.强电解质溶液的导电能力一定强于弱电解质吗?
1.下列物质能导电的是__________,
属于强电解质的是________________,
属于弱电解质的是__________________,
属于非电解质的是______________。
a.铜丝
b.金刚石
c.石墨
d.NaCl
e.稀硫酸
f.蔗糖
g.CO2
h.NaOH固体
i.碳酸
j.
NH3·H2O
l.醋酸铵溶液
m.
BaSO4
n.
熔融的硝酸钾
a
c
e
l
n
d
h
m
n
i
j
f
g
交流与讨论
化
合
物
电解质
非电解质
强电解质
弱电解质
强酸:HCl、H2SO4、HNO3、HClO4、
HBr、HI、HMnO4
强碱:NaOH、Ca(OH)2、Ba(OH)2、
KOH、RbOH…
大部分盐:BaSO4
NaCl
CaCO3
........
弱酸:HF、HClO、H2CO3、H2SO3、
H3PO4、CH3COOH
弱碱:NH3·H2O、Fe(OH)2、Fe(OH)3、……
少部分盐:Pb(AC)
2
水
大部分有机物:除有机酸、碱、盐之外
非金属的氧化物:CO、CO2、SO2、SO3、NO、NO2……
总结:
大部分的金属氧化物:CuO
MgO
1.下列事实一定能说明醋酸是弱电解质的__________
①醋酸与水能以任意比互溶;
②醋酸能和碳酸钙反应放出CO2
;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1mol/L的醋酸PH比0.1mol/L盐酸的PH大;
⑤醋酸溶液导电能力低于盐酸;
随堂练习
③
④
2、下列关于强、弱电解质的叙述正确的是( )
A强电解质都是离子化合物,弱电解质都是共价化合物
B强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
D
强电解质的导电能力强,弱电解质的导电能力弱
C
3、有关电解质的下列叙述,正确的是( )
A.盐酸的导电性比醋酸强
B.K2O的水溶液能导电,所以K2O是电解质
C.强电解质中一定含离子键
D.离子导电必须能自由移动
D
专题3
弱电解质的电离平衡
第一节
强电解质和弱电解质
潮湿的手触摸正在工作的电器,可能会发生触电事故.
电解水制H2,O2时,向水中加入少量的NaOH溶液或H2SO4溶液。
(1)掌握强电解质与弱电解质的概念;
(2)了解强、弱电解质在水溶液中电离程度的差异及原因.
电解质:
非电解质:
(一)电解质和非电解质
在水溶液中或熔融状态下能够导电的化合物。
在水溶液中或熔融状态下都不能导电的化合物。
复习巩固
1.醋酸和盐酸是常见的两种酸,根据你的经验,你认为它们的电离程度有无差异?
2.你能设计实验验证你的猜想吗?
电解质在水溶液中或熔化状态下离解成自由移动离子的过程
实验1:
测量物质的量浓度均为1
mol/L
盐酸、醋酸的pH。
(资料:pH
=
-
lg
c(H+))
pH试纸使用方法:
1.将pH试纸放在表面皿上
2.用洁净的玻璃棒沾取待测液点在试纸中央
3.和标准比色卡对照
实验2:
物质的量浓度均为1mol/L的盐酸和醋酸与等质量镁条反应。
大
小
前者电离程度小,后者大
慢
快
前者电离程度小,后者大
表3-1
盐酸和醋酸的性质比较
溶液的pH
方法
醋酸
盐酸
对实验现象的解释
与镁条反应
根据你的经验,你认为相同浓度的氢氧化钠溶液与氨水的电离程度有无差异?请提出你的假设并设计实验加以验证
实验假设
实验方案
实验现象
结论
(二)强电解质和弱电解质
强电解质:
弱电解质:
在水溶液或熔融状态里只能部分电离的电解质。
在水溶液或熔融状态里能完全电离的
电解质
强电解质
弱电解质
电离程度
完全电离
部分电离
水溶液里溶质粒子存在形态
阴、阳离子
阴、阳离子和分子
电离过程
不可逆
=
可逆
思考并讨论
1.难溶物一定是弱电解质吗?
2.强电解质溶液的导电能力一定强吗?
3.强电解质溶液的导电能力一定强于弱电解质吗?
1.下列物质能导电的是__________,
属于强电解质的是________________,
属于弱电解质的是__________________,
属于非电解质的是______________。
a.铜丝
b.金刚石
c.石墨
d.NaCl
e.稀硫酸
f.蔗糖
g.CO2
h.NaOH固体
i.碳酸
j.
NH3·H2O
l.醋酸铵溶液
m.
BaSO4
n.
熔融的硝酸钾
a
c
e
l
n
d
h
m
n
i
j
f
g
交流与讨论
化
合
物
电解质
非电解质
强电解质
弱电解质
强酸:HCl、H2SO4、HNO3、HClO4、
HBr、HI、HMnO4
强碱:NaOH、Ca(OH)2、Ba(OH)2、
KOH、RbOH…
大部分盐:BaSO4
NaCl
CaCO3
........
弱酸:HF、HClO、H2CO3、H2SO3、
H3PO4、CH3COOH
弱碱:NH3·H2O、Fe(OH)2、Fe(OH)3、……
少部分盐:Pb(AC)
2
水
大部分有机物:除有机酸、碱、盐之外
非金属的氧化物:CO、CO2、SO2、SO3、NO、NO2……
总结:
大部分的金属氧化物:CuO
MgO
1.下列事实一定能说明醋酸是弱电解质的__________
①醋酸与水能以任意比互溶;
②醋酸能和碳酸钙反应放出CO2
;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1mol/L的醋酸PH比0.1mol/L盐酸的PH大;
⑤醋酸溶液导电能力低于盐酸;
随堂练习
③
④
2、下列关于强、弱电解质的叙述正确的是( )
A强电解质都是离子化合物,弱电解质都是共价化合物
B强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
D
强电解质的导电能力强,弱电解质的导电能力弱
C
3、有关电解质的下列叙述,正确的是( )
A.盐酸的导电性比醋酸强
B.K2O的水溶液能导电,所以K2O是电解质
C.强电解质中一定含离子键
D.离子导电必须能自由移动
D
