浙教版科学八升九暑假同步提高专题讲义(机构用)第5讲 物质的转化(二)(含答案)
文档属性
| 名称 | 浙教版科学八升九暑假同步提高专题讲义(机构用)第5讲 物质的转化(二)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 278.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-06-28 18:14:05 | ||
图片预览




文档简介
第五讲 物质的转化(二)
[衔接导入]
铜器
现于约5000年到6000年间的西亚两河流域地区。苏美尔文明时期的雕有狮子形象的大型铜刀是早期青铜器的代表。青铜器在2000多年前逐渐由铁器所取代。中国青铜器制作精美,在世界各地青铜器中堪称艺术价值最高。中国青铜器代表着中国在先秦时期高超的技术与文化。
流行于新石器时代晚期至秦汉时代,以商周器物最为精美。最初出现的是小型工具或饰物。夏代始有青铜容器和兵器。商中期,青铜器品种已很丰富,并出现了铭文和精细的花纹。商晚期至西周早期,是青铜器发展的鼎盛时期,器型多种多样,浑厚凝重,铭文逐渐加长,花纹繁缛富丽。随后,青铜器胎体开始变薄,纹饰逐渐简化。春秋晚期至战国,由于铁器的推广使用,铜制工具越来越少。
秦汉时期,随着瓷器和漆器进入日常生活,铜制容器品种减少,装饰简单,多为素面,胎体也更为轻薄。中国古代铜器,是我们的祖先对人类物质文明的巨大贡献,虽然从目前的考古资料来看,中国铜器的出现,晚于世界上其他一些地方,但是就铜器的使用规模、铸造工艺、造型艺术及品种而言,世界上没有一个地方的铜器可以与中国古代铜器相比拟。这也是中国古代铜器在世界艺术史上占有独特地位并引起普遍重视的原因之一。
青铜器的颜色真正做出来的时候是很漂亮的,是黄金般的土黄色,因为埋在土里生锈才一点一点变成绿色的。由于青铜器完全是由手工制造所以没有任何两件是一模一样的,每一件都是独一无二、举世无双的。 随着原始社会的发展,鼎由最初的烧煮食物的炊具逐步演变为一种礼器,成为权利与财富的象征。鼎的多少,反映了地位的高低;鼎的轻重,标志着权力的大小。在商周时期,中国的青铜器形成了独特的造型系列:容器、乐器、兵器、车马器,等等。青铜器上市满了饕餮纹,夔纹或人形与兽面结合的纹饰,形成神灵的图纹,反映了人类从原始的愚昧状态向文明的一种过渡。
[知识新授]
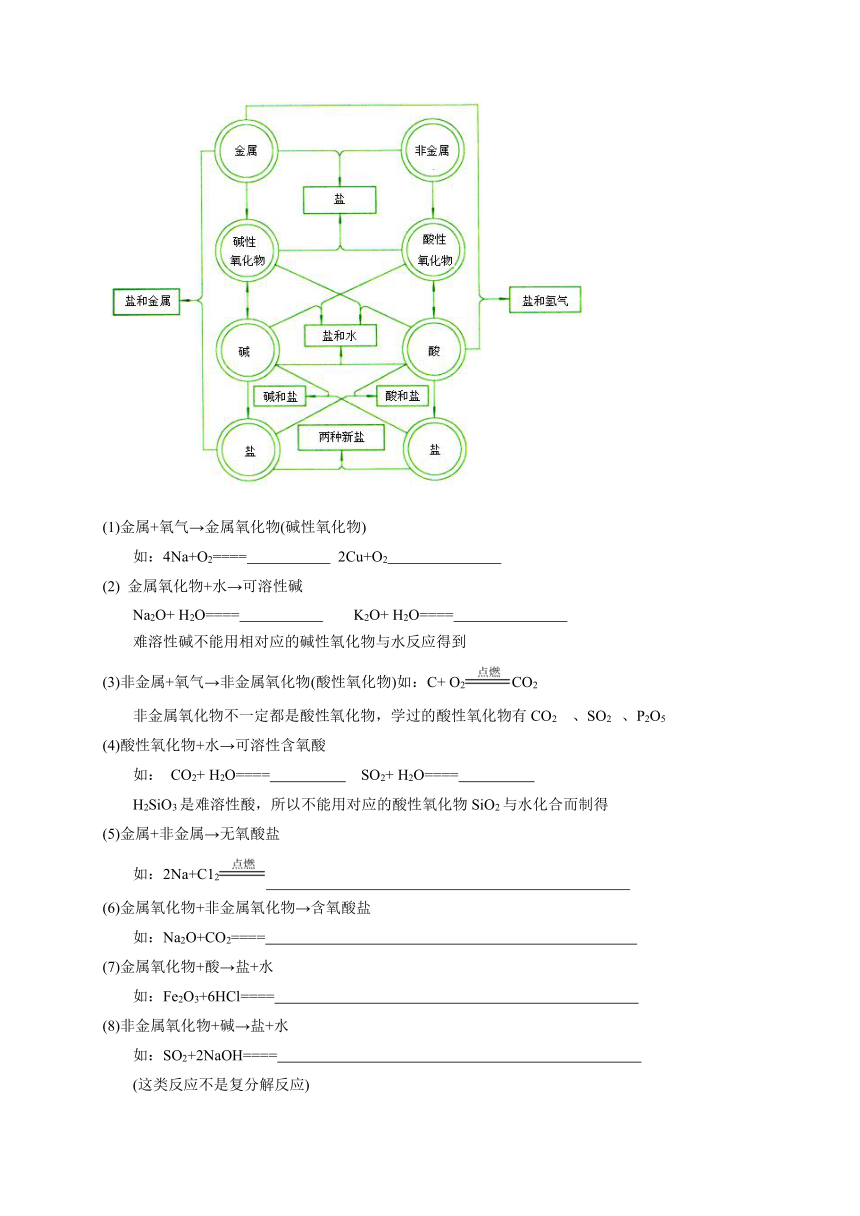
一、化合物之间的转化
鸡蛋外壳与稀盐酸的反应:
现象:一会下沉,一会又浮上来,不断地上下沉浮。
二、物质转化的关系
(1)金属+氧气→金属氧化物(碱性氧化物)
如:4Na+O2==== 2Cu+O2
(2) 金属氧化物+水→可溶性碱
Na2O+ H2O==== K2O+ H2O====
难溶性碱不能用相对应的碱性氧化物与水反应得到
(3)非金属+氧气→非金属氧化物(酸性氧化物)如:C+ O2CO2
非金属氧化物不一定都是酸性氧化物,学过的酸性氧化物有CO2 、SO2 、P2O5
(4)酸性氧化物+水→可溶性含氧酸
如: CO2+ H2O==== SO2+ H2O====
H2SiO3是难溶性酸,所以不能用对应的酸性氧化物SiO2与水化合而制得
(5)金属+非金属→无氧酸盐
如:2Na+C12
(6)金属氧化物+非金属氧化物→含氧酸盐
如:Na2O+CO2====
(7)金属氧化物+酸→盐+水
如:Fe2O3+6HCl====
(8)非金属氧化物+碱→盐+水
如:SO2+2NaOH====
(这类反应不是复分解反应)
(9)酸+碱→盐+水 如:HCl+NaOH====
(10)可溶性碱+可溶性盐→新碱+新盐(其中有一种为沉淀)
如:NaOH+ FeCl3====
(11)酸+盐→新酸+新盐(条件:酸可溶于水,且生成物中要有沉淀、气体或水)
如:H2SO4+BaCl2====
(12)盐+盐→新盐+新盐(条件:反应物均溶于水且生成物中要有沉淀)
如:NaCl+AgNO3====
(13)金属+盐→新金属+新盐
如:Fe+CuSO4====
(14)金属+酸→盐+氢气
如:Fe+2HCl====
条件:酸是除浓硫酸和浓硝酸以外的酸,且参加反应的金属是金属活动性顺序表中氢以前的金属
(15)碱→碱性氧化物+水:2Fe(OH)3Fe2O3+ 3H2O
(16)酸→酸性氧化物+水:H2CO3 CO2↑+ H2O
三、物质的鉴别方法
(1)限用一种试剂鉴别:用水鉴别、用酸碱指示剂鉴别、用酸碱盐鉴别和用燃烧的木条鉴别。
(2)不用另加试剂鉴别:两两混合法,特征现象法
[经典例题]
[例1]下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.CCOCO2Na2CO3溶液
B.CuCu(NO3)2溶液Cu(OH)2
C.CaOCa(OH)2溶液NaOH溶液
D.FeFe2O3Fe2(SO)4溶液
[例2]下列物质间的转化:①C→Cu ②Cu→CuCl2③CaO→CaCl2④Fe→Fe(OH)2⑤Ba(OH)2→NaOH,可以通过一步反应完成的是( )
A.①②③ B.③④⑤ C.①③⑤ D.②④⑤
[例3]如下两个转化都可以通过一步反应实现:CO→CO2、H2SO4→MgSO4.对上述转化过程分析正确的是( )
A.都能通过与非金属单质反应实现
B.都能通过与金属氧化物反应实现
C.都能通过化合反应实现
D.都能通过置换反应实现
[例4]有科学家提出回收利用CO2的构想:将工厂排出的气体(含较多CO2)吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH).该技术流程如下:
(说明:吸收池中盛有饱和的K2CO3溶液,主要反应为:K2CO3+H2O+CO2═2KHCO3)下列有关说法错误的是( )
A.该方法可以减少碳排放
B.可循环利用的物质A是K2CO3
C.分解池中的主要反应属于分解反应
D.合成塔中的主要反应属于化合反应
[例5]下表中“﹣﹣”表示相连的物质间能发生反应,“→”表示这种物质经一步反应可转化为另一种物质.则甲、乙、丙、丁四种物质不符合对应“转化关系”的是( )
选项
A
B
C
D
转化关系
物
质
甲
Ca(OH)2
C
Fe
Na2CO3
乙
HCl
O2
HCl
Ca(OH)2
丙
Na2CO3
Fe2O3
CuCl2
BaCl2
丁
Ba(OH)2
CO
NaOH
H2SO4
[例6]物质间存在着一定的反应关系和转化关系.下列各组物质可以按照所给图示进行直接转化的是( )
A.S→SO2→Na2SO4→NaOH B.HCl→NaCl→CaCl2→HCl
C.CO2→Na2CO3→CaCO3→CO2 D.Fe→Fe2O3→FeSO4→Fe
[例7]工业上可以用食盐为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:
①“沉淀池”中发生反应的化学方程式是
②若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
③在“设备(II)”中固体A与水反应的化学方程式是 .生成物与母液反应的化学方程式是
④对“设备(II)”中母液处理后,除水以外可在本流程中再利用的物质有 (填化学式)
⑤请写出一个该生产流程的优点 .
[例8]某市继续实施农村集中供水工程,集中供水覆盖人口已达到90%以上.自来水厂常用氯气杀毒,用明矾、氯化铁等凝剂净化水.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺流程如下:
回答下列问题:
(1)流程中需用30%的盐酸“酸溶”焙烧后的残渣(主要成分是氧化铁),写出反应的化学方程式 .
(2)二氧化硫能形成酸雨,危害环境.常用下列方法除去;
方法1.将含二氧化硫的废气通入氨水中吸收二氧化硫.氨水的PH 7(填写“大于”“等于”或“小于”).
方法2.将含有二氧化硫的废气通入石灰石悬浊液中,在空气作用下生成硫酸钙和二氧化碳,从而除去二氧化硫.写出反应的化学方程式: .
(3)自来水厂通常用电解饱和食盐水制备Cl2,反应的化学方程式为:2NaCl+2H2O2NaOH+Cl2↑+H2↑.现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?
[例9]氨对工业及国防具有重要意义,下图为某化学小组同学模拟工业合成氨原理设计如图实验.
A B C D E
完成以下实验中相关问题:
(1)检查装置气密性.
(2)关闭ac,打开b,从长颈漏斗中加入稀盐酸,A中发生反应生成氢气的化学方程式为 ,在E出口处收集H2并验纯.
(3)关闭a、b、c在盛满空气的多孔玻璃钟罩内用激光点燃足量白磷,此操作的目的是 .
(4)待多孔玻璃钟罩冷却到室温,先打开a,再加热D处的酒精灯,最后打开止水夹 ,H2、N2在催化剂的作用下生成NH3,该反应的化学方程式为 .实验过程中C装置的作用是 ,E装置的现象为 ,此现象说明NH3溶于水后溶液呈 性.
(5)实验室用固体Ca(OH)2和固体NH4Cl混合在加热条件下制NH3,应选用如图哪个装置 (填“A”或“B”),该反应的化学方程式为 .
[例10]如图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题.
资料卡:通空气时发生的反应为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,由沉淀获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3 Fe3O4+4H2O.
(1)流程中通入一定量空气后进行的操作A为 ,在实验室进行该操作要使用的玻璃仪器有烧杯、玻璃棒和 .
(2)副产品P是 (填化学式).由溶液N获得该副产品的操作顺序是 (填序号)
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
(3)流程中控制“一定量空气”的目的是 .
从后续反应过程来看,若要使原料不浪费,往FeSO4溶液中加入适量NaOH溶液和一定量空气时,应控制m FeSO4:mNaOH:m O2= .(最简整数比)
[课后作业]
已知Co有三种氧化物:CoO、CO2O3、CO3O4.9.30g Co(OH)2在空气中加热至290℃时,已完全脱水生成8.30g氧化物A;继续加热A至1000℃时,剩余固体为7.50g氧化物B.下列说法正确的是( )
A.Co的三种氧化物中,CO3O4中氧元素的质量分数最大
B.氧化物A的化学式为CoO
C.氧化物B的化学式为CO2O3
D.A到B的过程中,损失的是氧元素的质量
利用废旧泡沫塑料可以制取燃油和燃气.如图所示,将废旧泡沫塑料碎片在酒精灯上熔成颗粒后放入试管中,加入少量三氯化铝作为催化剂,现象如下.
(1)试管内出现白色烟雾后,有红棕色黏稠物产生
(2)继续加热,一段时间后试管内有气泡产生,U形管内出现红棕色冷凝液体
(3)当试管内有连续的气泡产生时,点燃导管尖嘴处气体,火焰明亮;在火焰上方罩一洁净烧杯,片刻后取下并注入澄清石灰水,溶液变浑浊.
根据上述实验操作及对现象,下列说法不正确的是( )
A.粘稠的红棕色物质和红棕色冷凝液体可能含有同种物质
B.塑料碎片在酒精灯上熔成颗粒状可能是物理变化
C.废旧泡沫塑料中一定含有碳元素
D.可以确定可燃气体是纯净物
我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:下面是联合工艺法制备新型自来水消毒剂ClO2的反应原理:
①电解氯化钠溶液NaCI+3H2ONaC1O3+3H2↑
②氢气与氯气合成氯化氢
③生成二氧化氯 2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O
此方法的原子利用率最大为( )
A.37.6% B.53.6% C.62.2% D.94.4%
下表所列各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是( )
物质
选项
甲
乙
丙
丁
A
H2O
CO2
CuO
O2
B
CuSO4
H2SO4
HCl
Fe
C
NaCl
Na2CO3
KNO3
NaOH
D
CaO
CaCO3
Ca(OH)2
H2O
下列关于碳和碳的氧化物知识网络图(图中“→”表示转化关系,“…”表示相互能反应)说法正确的是( )
A.“C…CO2”的反应是放热反应
B.“CO→CO2”的反应类型为置换反应
C.“CO2→CaCO3”的反应可用于检验二氧化碳
D.“CO2?H2CO3”的反应可用酚酞试剂验证
纳米碳酸钡是一种重要的无机化工产品,如图是生产纳米碳酸钡的工艺流程,请回答下列问题:
(1)试剂A名称是 ,试写出其与BaCO3反应的化学方程式 .
(2)操作1名称为 ,操作2所得主要副产物为 (填化学式).检验洗涤是否干净可选用试剂为 (填化学式)溶液.
(3)上述流程可循环利用的物质是 .
(4)资料:二氧化硅难溶于水,但可以和氢氧化钠、氢氟酸等物质反应.某同学根据资料重新设计方案提纯碳酸钡:取碳酸钡和二氧化硅混合物,滴加足量的 ,过滤、洗涤、烘干得碳酸钡固体.
兴趣小组同学发现实验室一片久置的铜片表面附着有一层绿色固体,查阅资料得知绿色固体是铜绿[化学式为Cu2(OH)2CO3],能与稀硫酸反应产生硫酸铜、水和二氧化碳,加热产生氧化铜、水和二氧化碳.下面是小组同学回收铜的实验流程:
(1)Ⅰ、Ⅱ、Ⅲ都需要进行过滤的操作,过滤用到的玻璃仪器是烧杯、玻璃棒和 .溶液A所含的溶质有 (填化学式)
(2)写出下列反应的化学方程式:步骤Ⅰ ,步骤Ⅴ .
(3)同一久置铜片分别通过途径甲和途径乙最终得到的铜的质量是:途径甲 (选填“大于”、“等于”或“小于”)途径乙.
(4)途径甲比途径乙更好的理由是 (答一点).
氢气燃烧能放出大量的热,且生成物只有水,“氢能”将是未来最理想的新能源:
(1)图1是工业上制备氢气的微观示意图,其中不同的球代表不同的原子.下列说法正确的是 (填选项).
A.反应前后共有4种原子 B.反应前后元素化合价都不变
C.化学变化中分子和原子均可再分 D.该化学反应中,甲、丁两种分子的个数比是1:1
(2)某化学家根据“原子经济”的思想设计如图2制备氢气的反应步骤(反应条件略):
①图中Ⅰ、Ⅳ反应属于复分解反应,写出其中一个反应的化学方程式 ;
②在整个流程中,循环利用的物质是 .
(3)科学家正致力于利用太阳能和水制取氢气的研究(如图3),利用该方法获得氢能的优点 .
有五种化合物,它们两两之间发生的某些转化关系如图箭头所示.请回答:
(1)Na2SO4→NaCl的转化反应属于反应 (填基本反应类型);这一类型反应能发生必须具备的条件之一是 (填一种).
(2)NaOH→Na2SO4 ;(反应的化学方程式)
(3)在图中的物质间转化关系中有的可以逆向转化.他们分别是: → ; → (填化学式).
2013年12月,杭州、萧山等地不少市民曾反映,自来水里有股奇怪的味道,一些市民怀疑是自来水厂往自来水中通入了过量的氯气.经浙江省和沿岸地市环保部门对钱塘江全流域开展的排查,异味来自于钱塘江沿岸企业所排放的一种叫邻叔丁基苯酚的物质.其实,世界环保联盟建议全面禁止用氯气对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2,ClO2是一种黄绿色、有刺激性气味的气体,冷却至11.0℃以下时变成红色液体.易溶于水,见光易分解,易与碱反应,杀菌、漂白能力均优于氯气.
(1)邻叔丁基苯酚常温下为无色或淡黄色液体,微溶于水,具有轻微的苯酚臭味,这属于邻叔丁基苯酚的 (填“物理”或“化学”)性质.
(2)目前欧洲一些国家采用氯酸钠(NaClO3)与浓盐酸反应制取ClO2(Kestiog法),反应的化学方程式为:2NaClO3+4HCl=2ClO2+Cl2↑+2H2O+2NaCl.我国最近研究成功用氯气和亚氯酸钠(NaClO2)反应制取ClO2,该反应的化学方程式为Cl2+2NaClO3=2ClO2+2NaCl,此法与Kestiog法相比,其优点是 .
(3)某实验小组用如图所示装置探究用潮湿的KClO3与草酸在60℃时反应制取ClO2获得成功.在装置中:A为ClO2的发生装置,B为ClO2收集装置,C为尾气吸收装置.
①为了收集到液态ClO2,对装置A、装置B分别应控制的条件是 .
②为较好地防止ClO2泄漏,C的烧杯中应盛放的液体是 .
[参考答案]
[经典例题]
1.C.
2.C.
3.B.
4.D.
5.C
6.C
7.①NH3+NaCl+H2O+CO2═NaHCO3+NH4Cl;
②过滤;
③CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;
④NH3;NaCl;⑤部分物质循环利用或原料便宜易得.
8.(1)Fe2O3+6HCl=2FeCl3+3H2O;(2)方法1,大于;方法2:2CaCO3+2SO2+O2=2CaSO4+2CO2;(3)需要含杂质10%的粗盐是130吨,同时生成烧碱80吨.
9.(2)Zn+2HCl=ZnCl2+H2↑;
(3)除去空气中的氧气得到较纯净的氮气;
(4)c;N2+3H22NH3;除去水蒸气;酚酞试液变红;碱;
(5)B;Ca(OH)2+2NH4ClCaCl2+2H2O+2NH3↑.
10.(1)过滤,漏斗;(2)Na2SO4;b→c→a→d;(3)控制Fe(OH)2的转化量;19:20:4.
[课后作业]
1.D
2.D.
3.D
4.A.
5.C
6.(1)稀盐酸;BaCO3+2HCl═BaCl2+H2O+CO2↑;
(2)过滤;KCl;AgNO3;
(3)CO2;
(4)氢氧化钠溶液.
7.(1) 漏斗; CuSO4和H2SO4;
(2)Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O; CuO+COCu+CO2.
(3)等于.
(4)安全、易操作等(合理即可).
8.(1)D.
(2)①CaBr2+H2OCaO+2HBr 或HgBr2+CaOCaBr2+HgO;②CaBr2、HgO;
(3)原料是水,资源不受限制;利用太阳能分解水,不消耗电能.
9.(1)复分解反应;生成物中有沉淀;(2)2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;(3)Na2SO4,NaOH;Na2CO3,NaOH.
10.(1)物理;
(2)不产生氯气等有害气体,比较环保,并且收集到的二氧化氯比较纯净;
(3)①装置A需要加热到60℃以上,装置B需要避光;②氢氧化钠溶液;
[衔接导入]
铜器
现于约5000年到6000年间的西亚两河流域地区。苏美尔文明时期的雕有狮子形象的大型铜刀是早期青铜器的代表。青铜器在2000多年前逐渐由铁器所取代。中国青铜器制作精美,在世界各地青铜器中堪称艺术价值最高。中国青铜器代表着中国在先秦时期高超的技术与文化。
流行于新石器时代晚期至秦汉时代,以商周器物最为精美。最初出现的是小型工具或饰物。夏代始有青铜容器和兵器。商中期,青铜器品种已很丰富,并出现了铭文和精细的花纹。商晚期至西周早期,是青铜器发展的鼎盛时期,器型多种多样,浑厚凝重,铭文逐渐加长,花纹繁缛富丽。随后,青铜器胎体开始变薄,纹饰逐渐简化。春秋晚期至战国,由于铁器的推广使用,铜制工具越来越少。
秦汉时期,随着瓷器和漆器进入日常生活,铜制容器品种减少,装饰简单,多为素面,胎体也更为轻薄。中国古代铜器,是我们的祖先对人类物质文明的巨大贡献,虽然从目前的考古资料来看,中国铜器的出现,晚于世界上其他一些地方,但是就铜器的使用规模、铸造工艺、造型艺术及品种而言,世界上没有一个地方的铜器可以与中国古代铜器相比拟。这也是中国古代铜器在世界艺术史上占有独特地位并引起普遍重视的原因之一。
青铜器的颜色真正做出来的时候是很漂亮的,是黄金般的土黄色,因为埋在土里生锈才一点一点变成绿色的。由于青铜器完全是由手工制造所以没有任何两件是一模一样的,每一件都是独一无二、举世无双的。 随着原始社会的发展,鼎由最初的烧煮食物的炊具逐步演变为一种礼器,成为权利与财富的象征。鼎的多少,反映了地位的高低;鼎的轻重,标志着权力的大小。在商周时期,中国的青铜器形成了独特的造型系列:容器、乐器、兵器、车马器,等等。青铜器上市满了饕餮纹,夔纹或人形与兽面结合的纹饰,形成神灵的图纹,反映了人类从原始的愚昧状态向文明的一种过渡。
[知识新授]
一、化合物之间的转化
鸡蛋外壳与稀盐酸的反应:
现象:一会下沉,一会又浮上来,不断地上下沉浮。
二、物质转化的关系
(1)金属+氧气→金属氧化物(碱性氧化物)
如:4Na+O2==== 2Cu+O2
(2) 金属氧化物+水→可溶性碱
Na2O+ H2O==== K2O+ H2O====
难溶性碱不能用相对应的碱性氧化物与水反应得到
(3)非金属+氧气→非金属氧化物(酸性氧化物)如:C+ O2CO2
非金属氧化物不一定都是酸性氧化物,学过的酸性氧化物有CO2 、SO2 、P2O5
(4)酸性氧化物+水→可溶性含氧酸
如: CO2+ H2O==== SO2+ H2O====
H2SiO3是难溶性酸,所以不能用对应的酸性氧化物SiO2与水化合而制得
(5)金属+非金属→无氧酸盐
如:2Na+C12
(6)金属氧化物+非金属氧化物→含氧酸盐
如:Na2O+CO2====
(7)金属氧化物+酸→盐+水
如:Fe2O3+6HCl====
(8)非金属氧化物+碱→盐+水
如:SO2+2NaOH====
(这类反应不是复分解反应)
(9)酸+碱→盐+水 如:HCl+NaOH====
(10)可溶性碱+可溶性盐→新碱+新盐(其中有一种为沉淀)
如:NaOH+ FeCl3====
(11)酸+盐→新酸+新盐(条件:酸可溶于水,且生成物中要有沉淀、气体或水)
如:H2SO4+BaCl2====
(12)盐+盐→新盐+新盐(条件:反应物均溶于水且生成物中要有沉淀)
如:NaCl+AgNO3====
(13)金属+盐→新金属+新盐
如:Fe+CuSO4====
(14)金属+酸→盐+氢气
如:Fe+2HCl====
条件:酸是除浓硫酸和浓硝酸以外的酸,且参加反应的金属是金属活动性顺序表中氢以前的金属
(15)碱→碱性氧化物+水:2Fe(OH)3Fe2O3+ 3H2O
(16)酸→酸性氧化物+水:H2CO3 CO2↑+ H2O
三、物质的鉴别方法
(1)限用一种试剂鉴别:用水鉴别、用酸碱指示剂鉴别、用酸碱盐鉴别和用燃烧的木条鉴别。
(2)不用另加试剂鉴别:两两混合法,特征现象法
[经典例题]
[例1]下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.CCOCO2Na2CO3溶液
B.CuCu(NO3)2溶液Cu(OH)2
C.CaOCa(OH)2溶液NaOH溶液
D.FeFe2O3Fe2(SO)4溶液
[例2]下列物质间的转化:①C→Cu ②Cu→CuCl2③CaO→CaCl2④Fe→Fe(OH)2⑤Ba(OH)2→NaOH,可以通过一步反应完成的是( )
A.①②③ B.③④⑤ C.①③⑤ D.②④⑤
[例3]如下两个转化都可以通过一步反应实现:CO→CO2、H2SO4→MgSO4.对上述转化过程分析正确的是( )
A.都能通过与非金属单质反应实现
B.都能通过与金属氧化物反应实现
C.都能通过化合反应实现
D.都能通过置换反应实现
[例4]有科学家提出回收利用CO2的构想:将工厂排出的气体(含较多CO2)吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH).该技术流程如下:
(说明:吸收池中盛有饱和的K2CO3溶液,主要反应为:K2CO3+H2O+CO2═2KHCO3)下列有关说法错误的是( )
A.该方法可以减少碳排放
B.可循环利用的物质A是K2CO3
C.分解池中的主要反应属于分解反应
D.合成塔中的主要反应属于化合反应
[例5]下表中“﹣﹣”表示相连的物质间能发生反应,“→”表示这种物质经一步反应可转化为另一种物质.则甲、乙、丙、丁四种物质不符合对应“转化关系”的是( )
选项
A
B
C
D
转化关系
物
质
甲
Ca(OH)2
C
Fe
Na2CO3
乙
HCl
O2
HCl
Ca(OH)2
丙
Na2CO3
Fe2O3
CuCl2
BaCl2
丁
Ba(OH)2
CO
NaOH
H2SO4
[例6]物质间存在着一定的反应关系和转化关系.下列各组物质可以按照所给图示进行直接转化的是( )
A.S→SO2→Na2SO4→NaOH B.HCl→NaCl→CaCl2→HCl
C.CO2→Na2CO3→CaCO3→CO2 D.Fe→Fe2O3→FeSO4→Fe
[例7]工业上可以用食盐为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:
①“沉淀池”中发生反应的化学方程式是
②若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
③在“设备(II)”中固体A与水反应的化学方程式是 .生成物与母液反应的化学方程式是
④对“设备(II)”中母液处理后,除水以外可在本流程中再利用的物质有 (填化学式)
⑤请写出一个该生产流程的优点 .
[例8]某市继续实施农村集中供水工程,集中供水覆盖人口已达到90%以上.自来水厂常用氯气杀毒,用明矾、氯化铁等凝剂净化水.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺流程如下:
回答下列问题:
(1)流程中需用30%的盐酸“酸溶”焙烧后的残渣(主要成分是氧化铁),写出反应的化学方程式 .
(2)二氧化硫能形成酸雨,危害环境.常用下列方法除去;
方法1.将含二氧化硫的废气通入氨水中吸收二氧化硫.氨水的PH 7(填写“大于”“等于”或“小于”).
方法2.将含有二氧化硫的废气通入石灰石悬浊液中,在空气作用下生成硫酸钙和二氧化碳,从而除去二氧化硫.写出反应的化学方程式: .
(3)自来水厂通常用电解饱和食盐水制备Cl2,反应的化学方程式为:2NaCl+2H2O2NaOH+Cl2↑+H2↑.现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?
[例9]氨对工业及国防具有重要意义,下图为某化学小组同学模拟工业合成氨原理设计如图实验.
A B C D E
完成以下实验中相关问题:
(1)检查装置气密性.
(2)关闭ac,打开b,从长颈漏斗中加入稀盐酸,A中发生反应生成氢气的化学方程式为 ,在E出口处收集H2并验纯.
(3)关闭a、b、c在盛满空气的多孔玻璃钟罩内用激光点燃足量白磷,此操作的目的是 .
(4)待多孔玻璃钟罩冷却到室温,先打开a,再加热D处的酒精灯,最后打开止水夹 ,H2、N2在催化剂的作用下生成NH3,该反应的化学方程式为 .实验过程中C装置的作用是 ,E装置的现象为 ,此现象说明NH3溶于水后溶液呈 性.
(5)实验室用固体Ca(OH)2和固体NH4Cl混合在加热条件下制NH3,应选用如图哪个装置 (填“A”或“B”),该反应的化学方程式为 .
[例10]如图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题.
资料卡:通空气时发生的反应为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,由沉淀获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3 Fe3O4+4H2O.
(1)流程中通入一定量空气后进行的操作A为 ,在实验室进行该操作要使用的玻璃仪器有烧杯、玻璃棒和 .
(2)副产品P是 (填化学式).由溶液N获得该副产品的操作顺序是 (填序号)
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
(3)流程中控制“一定量空气”的目的是 .
从后续反应过程来看,若要使原料不浪费,往FeSO4溶液中加入适量NaOH溶液和一定量空气时,应控制m FeSO4:mNaOH:m O2= .(最简整数比)
[课后作业]
已知Co有三种氧化物:CoO、CO2O3、CO3O4.9.30g Co(OH)2在空气中加热至290℃时,已完全脱水生成8.30g氧化物A;继续加热A至1000℃时,剩余固体为7.50g氧化物B.下列说法正确的是( )
A.Co的三种氧化物中,CO3O4中氧元素的质量分数最大
B.氧化物A的化学式为CoO
C.氧化物B的化学式为CO2O3
D.A到B的过程中,损失的是氧元素的质量
利用废旧泡沫塑料可以制取燃油和燃气.如图所示,将废旧泡沫塑料碎片在酒精灯上熔成颗粒后放入试管中,加入少量三氯化铝作为催化剂,现象如下.
(1)试管内出现白色烟雾后,有红棕色黏稠物产生
(2)继续加热,一段时间后试管内有气泡产生,U形管内出现红棕色冷凝液体
(3)当试管内有连续的气泡产生时,点燃导管尖嘴处气体,火焰明亮;在火焰上方罩一洁净烧杯,片刻后取下并注入澄清石灰水,溶液变浑浊.
根据上述实验操作及对现象,下列说法不正确的是( )
A.粘稠的红棕色物质和红棕色冷凝液体可能含有同种物质
B.塑料碎片在酒精灯上熔成颗粒状可能是物理变化
C.废旧泡沫塑料中一定含有碳元素
D.可以确定可燃气体是纯净物
我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:下面是联合工艺法制备新型自来水消毒剂ClO2的反应原理:
①电解氯化钠溶液NaCI+3H2ONaC1O3+3H2↑
②氢气与氯气合成氯化氢
③生成二氧化氯 2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O
此方法的原子利用率最大为( )
A.37.6% B.53.6% C.62.2% D.94.4%
下表所列各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是( )
物质
选项
甲
乙
丙
丁
A
H2O
CO2
CuO
O2
B
CuSO4
H2SO4
HCl
Fe
C
NaCl
Na2CO3
KNO3
NaOH
D
CaO
CaCO3
Ca(OH)2
H2O
下列关于碳和碳的氧化物知识网络图(图中“→”表示转化关系,“…”表示相互能反应)说法正确的是( )
A.“C…CO2”的反应是放热反应
B.“CO→CO2”的反应类型为置换反应
C.“CO2→CaCO3”的反应可用于检验二氧化碳
D.“CO2?H2CO3”的反应可用酚酞试剂验证
纳米碳酸钡是一种重要的无机化工产品,如图是生产纳米碳酸钡的工艺流程,请回答下列问题:
(1)试剂A名称是 ,试写出其与BaCO3反应的化学方程式 .
(2)操作1名称为 ,操作2所得主要副产物为 (填化学式).检验洗涤是否干净可选用试剂为 (填化学式)溶液.
(3)上述流程可循环利用的物质是 .
(4)资料:二氧化硅难溶于水,但可以和氢氧化钠、氢氟酸等物质反应.某同学根据资料重新设计方案提纯碳酸钡:取碳酸钡和二氧化硅混合物,滴加足量的 ,过滤、洗涤、烘干得碳酸钡固体.
兴趣小组同学发现实验室一片久置的铜片表面附着有一层绿色固体,查阅资料得知绿色固体是铜绿[化学式为Cu2(OH)2CO3],能与稀硫酸反应产生硫酸铜、水和二氧化碳,加热产生氧化铜、水和二氧化碳.下面是小组同学回收铜的实验流程:
(1)Ⅰ、Ⅱ、Ⅲ都需要进行过滤的操作,过滤用到的玻璃仪器是烧杯、玻璃棒和 .溶液A所含的溶质有 (填化学式)
(2)写出下列反应的化学方程式:步骤Ⅰ ,步骤Ⅴ .
(3)同一久置铜片分别通过途径甲和途径乙最终得到的铜的质量是:途径甲 (选填“大于”、“等于”或“小于”)途径乙.
(4)途径甲比途径乙更好的理由是 (答一点).
氢气燃烧能放出大量的热,且生成物只有水,“氢能”将是未来最理想的新能源:
(1)图1是工业上制备氢气的微观示意图,其中不同的球代表不同的原子.下列说法正确的是 (填选项).
A.反应前后共有4种原子 B.反应前后元素化合价都不变
C.化学变化中分子和原子均可再分 D.该化学反应中,甲、丁两种分子的个数比是1:1
(2)某化学家根据“原子经济”的思想设计如图2制备氢气的反应步骤(反应条件略):
①图中Ⅰ、Ⅳ反应属于复分解反应,写出其中一个反应的化学方程式 ;
②在整个流程中,循环利用的物质是 .
(3)科学家正致力于利用太阳能和水制取氢气的研究(如图3),利用该方法获得氢能的优点 .
有五种化合物,它们两两之间发生的某些转化关系如图箭头所示.请回答:
(1)Na2SO4→NaCl的转化反应属于反应 (填基本反应类型);这一类型反应能发生必须具备的条件之一是 (填一种).
(2)NaOH→Na2SO4 ;(反应的化学方程式)
(3)在图中的物质间转化关系中有的可以逆向转化.他们分别是: → ; → (填化学式).
2013年12月,杭州、萧山等地不少市民曾反映,自来水里有股奇怪的味道,一些市民怀疑是自来水厂往自来水中通入了过量的氯气.经浙江省和沿岸地市环保部门对钱塘江全流域开展的排查,异味来自于钱塘江沿岸企业所排放的一种叫邻叔丁基苯酚的物质.其实,世界环保联盟建议全面禁止用氯气对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2,ClO2是一种黄绿色、有刺激性气味的气体,冷却至11.0℃以下时变成红色液体.易溶于水,见光易分解,易与碱反应,杀菌、漂白能力均优于氯气.
(1)邻叔丁基苯酚常温下为无色或淡黄色液体,微溶于水,具有轻微的苯酚臭味,这属于邻叔丁基苯酚的 (填“物理”或“化学”)性质.
(2)目前欧洲一些国家采用氯酸钠(NaClO3)与浓盐酸反应制取ClO2(Kestiog法),反应的化学方程式为:2NaClO3+4HCl=2ClO2+Cl2↑+2H2O+2NaCl.我国最近研究成功用氯气和亚氯酸钠(NaClO2)反应制取ClO2,该反应的化学方程式为Cl2+2NaClO3=2ClO2+2NaCl,此法与Kestiog法相比,其优点是 .
(3)某实验小组用如图所示装置探究用潮湿的KClO3与草酸在60℃时反应制取ClO2获得成功.在装置中:A为ClO2的发生装置,B为ClO2收集装置,C为尾气吸收装置.
①为了收集到液态ClO2,对装置A、装置B分别应控制的条件是 .
②为较好地防止ClO2泄漏,C的烧杯中应盛放的液体是 .
[参考答案]
[经典例题]
1.C.
2.C.
3.B.
4.D.
5.C
6.C
7.①NH3+NaCl+H2O+CO2═NaHCO3+NH4Cl;
②过滤;
③CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;
④NH3;NaCl;⑤部分物质循环利用或原料便宜易得.
8.(1)Fe2O3+6HCl=2FeCl3+3H2O;(2)方法1,大于;方法2:2CaCO3+2SO2+O2=2CaSO4+2CO2;(3)需要含杂质10%的粗盐是130吨,同时生成烧碱80吨.
9.(2)Zn+2HCl=ZnCl2+H2↑;
(3)除去空气中的氧气得到较纯净的氮气;
(4)c;N2+3H22NH3;除去水蒸气;酚酞试液变红;碱;
(5)B;Ca(OH)2+2NH4ClCaCl2+2H2O+2NH3↑.
10.(1)过滤,漏斗;(2)Na2SO4;b→c→a→d;(3)控制Fe(OH)2的转化量;19:20:4.
[课后作业]
1.D
2.D.
3.D
4.A.
5.C
6.(1)稀盐酸;BaCO3+2HCl═BaCl2+H2O+CO2↑;
(2)过滤;KCl;AgNO3;
(3)CO2;
(4)氢氧化钠溶液.
7.(1) 漏斗; CuSO4和H2SO4;
(2)Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O; CuO+COCu+CO2.
(3)等于.
(4)安全、易操作等(合理即可).
8.(1)D.
(2)①CaBr2+H2OCaO+2HBr 或HgBr2+CaOCaBr2+HgO;②CaBr2、HgO;
(3)原料是水,资源不受限制;利用太阳能分解水,不消耗电能.
9.(1)复分解反应;生成物中有沉淀;(2)2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;(3)Na2SO4,NaOH;Na2CO3,NaOH.
10.(1)物理;
(2)不产生氯气等有害气体,比较环保,并且收集到的二氧化氯比较纯净;
(3)①装置A需要加热到60℃以上,装置B需要避光;②氢氧化钠溶液;
同课章节目录
