高中化学鲁科版 选修三 第1章 本章自我评价 原子结构复习课件(共22张PPT)
文档属性
| 名称 | 高中化学鲁科版 选修三 第1章 本章自我评价 原子结构复习课件(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-29 00:00:00 | ||
图片预览




文档简介
(共22张PPT)
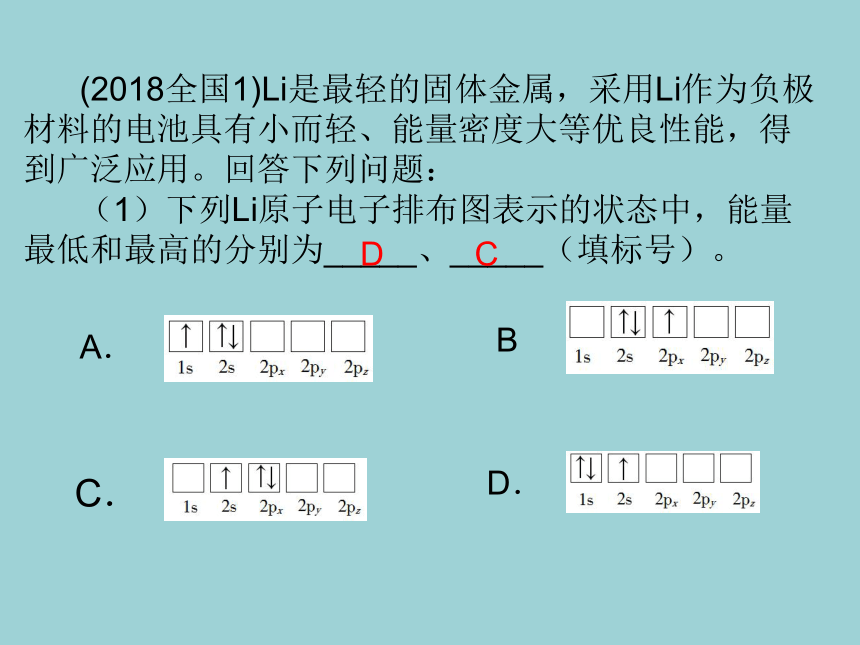
(2018全国1)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
D
C
1
.
电子云:电子在原子核外出现的概率分布图。
1s电子在原子核外出现的概率分布图
核外电子运动状态的描述
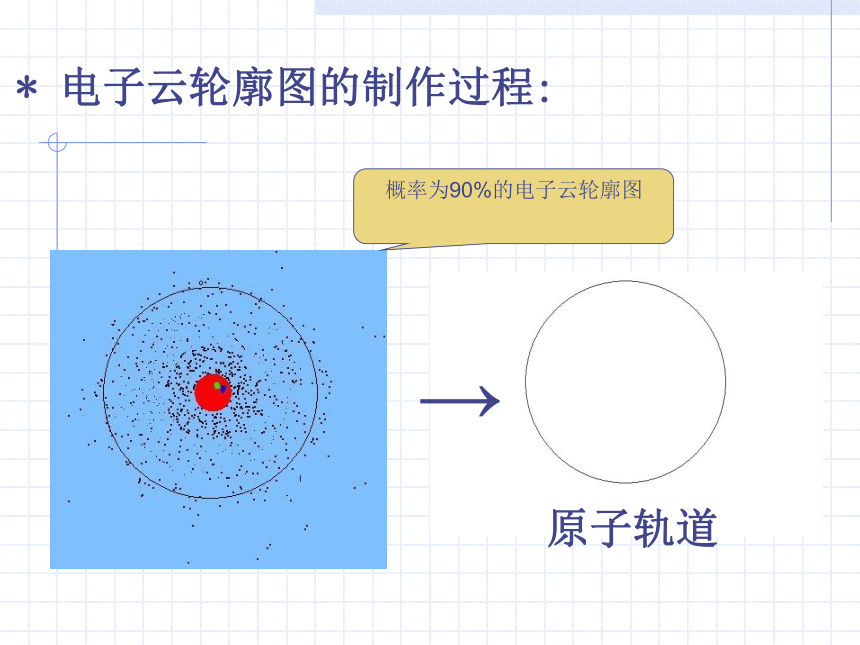
电子云轮廓图的制作过程:
→
概率为90%的电子云轮廓图
原子轨道
(2)基态S原子电子占据最高能级的电子云轮廓图为_________形。
(3)基态K原子中,核外电子占据最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。
(4)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
形象化描述。在基态14C
原子中,核外存在
对自旋相反的电子。
哑铃
球形
N
电子云
2
关键点:一定要记住电子排入轨道的顺序,这是本章最重要的内容。从第四能层开始,该能层的ns与np能级之间插入了(n-1)层的d能级,其能量关系是:ns<
(n-1)d
<np
核外电子排布的表示方法:
外围电子排布的表示方法:
简化的电子排布式:
轨道表示式:
结构示意图:
电子排入轨道的顺序
用轨道表示出铁原子的核外电子排布
↑↓
↑↓
↑↓
↑↓
洪特规则
泡利原理
能量最低原理
核外电子排布规律
1s
2s
3s
4s
2p
3p
3d
1请写出Fe2+与Fe3+
价电子排布图
2分析铁离子,亚铁离子稳定性与结构的关系
元素周期表
元素周期表中各周期最多容纳的元素数目分别为:2、8、8、18、18、32、32、50
结构(族、周期)
分区(依据)
除ds区外,区的名称来自最后填入的电子的能级的符号。
铁元素在周期表中位于(
)区,铜元素在周期表的(
)区
d
ds
化合价:
元素周期律
金属性与非金属性:
原子半径:
第一电离能:
电离能反映了不同元素的原子失电子的难易,
同时也与元素的金属性密切相关。
每个周期的第一个元素第一电离能最
最后一个元素的第一电离能最
。
同族元素从上至下,元素的第一电离能逐渐
。
(5)Li+与H?具有相同的电子构型,r(Li+)小于r(H?),原因是______。
Li+核电荷数较大
(5)Li2O是离子晶体,其晶格能可通过图(a)的
Born?Haber循环计算得到。
可知,Li原子的第一电离能为
kJ·mol?1
电负性:用来描述不同元素的原子对键合电子吸引力的大小。以氟的电负性为4.0,锂的电负性为1.0作为相对标准,得出了各元素的电负性。
也可以作为判断金属性和非金属性强弱的尺度,金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”电负性的电负性在1.8左右。它们既有金属性,又有非金属性。
电负性的相对大小可以判断成键类型。
对角线规则:右下方(左上方)主族元素
电负性、对角线规则
(6)拟卤溴化碘(IBr)的化学性质类似卤素单质,它与水反应的化学方程式为
__________
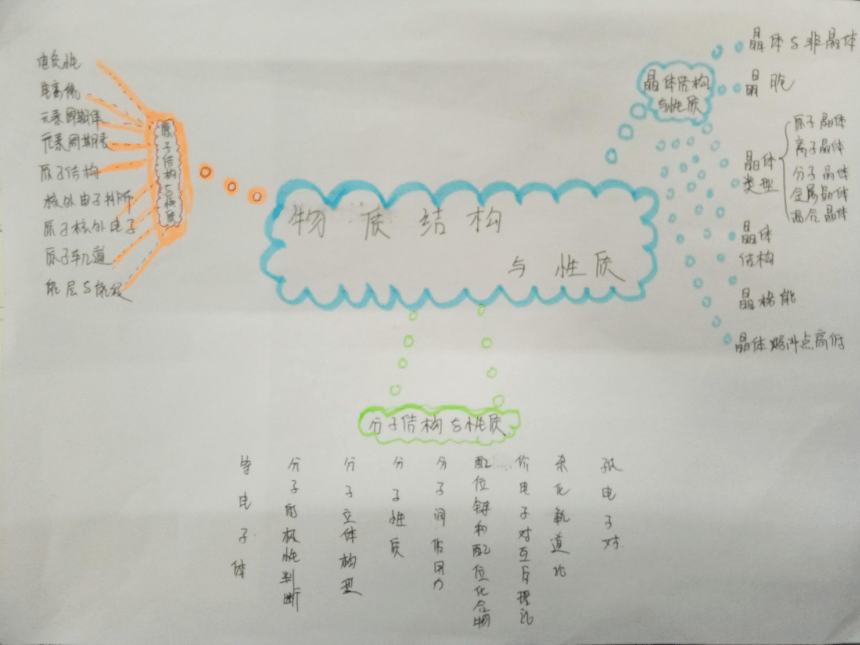
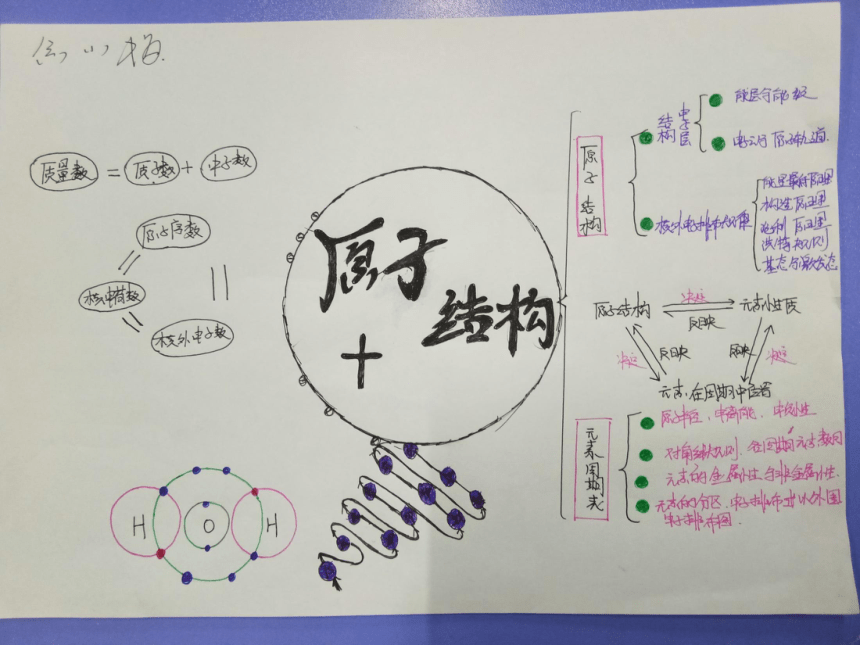
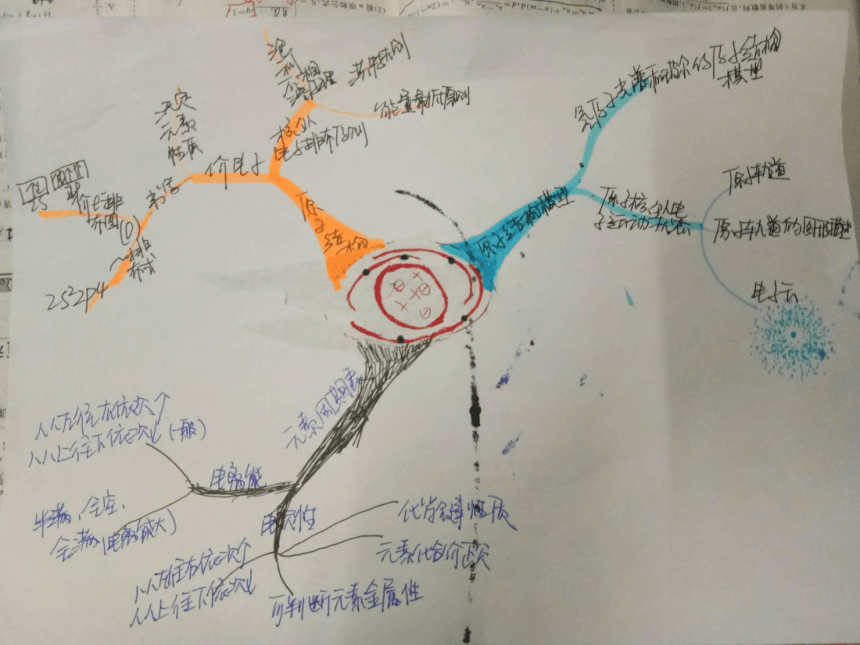
内容结构
(2018全国1)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
D
C
1
.
电子云:电子在原子核外出现的概率分布图。
1s电子在原子核外出现的概率分布图
核外电子运动状态的描述
电子云轮廓图的制作过程:
→
概率为90%的电子云轮廓图
原子轨道
(2)基态S原子电子占据最高能级的电子云轮廓图为_________形。
(3)基态K原子中,核外电子占据最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。
(4)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
形象化描述。在基态14C
原子中,核外存在
对自旋相反的电子。
哑铃
球形
N
电子云
2
关键点:一定要记住电子排入轨道的顺序,这是本章最重要的内容。从第四能层开始,该能层的ns与np能级之间插入了(n-1)层的d能级,其能量关系是:ns<
(n-1)d
<np
核外电子排布的表示方法:
外围电子排布的表示方法:
简化的电子排布式:
轨道表示式:
结构示意图:
电子排入轨道的顺序
用轨道表示出铁原子的核外电子排布
↑↓
↑↓
↑↓
↑↓
洪特规则
泡利原理
能量最低原理
核外电子排布规律
1s
2s
3s
4s
2p
3p
3d
1请写出Fe2+与Fe3+
价电子排布图
2分析铁离子,亚铁离子稳定性与结构的关系
元素周期表
元素周期表中各周期最多容纳的元素数目分别为:2、8、8、18、18、32、32、50
结构(族、周期)
分区(依据)
除ds区外,区的名称来自最后填入的电子的能级的符号。
铁元素在周期表中位于(
)区,铜元素在周期表的(
)区
d
ds
化合价:
元素周期律
金属性与非金属性:
原子半径:
第一电离能:
电离能反映了不同元素的原子失电子的难易,
同时也与元素的金属性密切相关。
每个周期的第一个元素第一电离能最
最后一个元素的第一电离能最
。
同族元素从上至下,元素的第一电离能逐渐
。
(5)Li+与H?具有相同的电子构型,r(Li+)小于r(H?),原因是______。
Li+核电荷数较大
(5)Li2O是离子晶体,其晶格能可通过图(a)的
Born?Haber循环计算得到。
可知,Li原子的第一电离能为
kJ·mol?1
电负性:用来描述不同元素的原子对键合电子吸引力的大小。以氟的电负性为4.0,锂的电负性为1.0作为相对标准,得出了各元素的电负性。
也可以作为判断金属性和非金属性强弱的尺度,金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”电负性的电负性在1.8左右。它们既有金属性,又有非金属性。
电负性的相对大小可以判断成键类型。
对角线规则:右下方(左上方)主族元素
电负性、对角线规则
(6)拟卤溴化碘(IBr)的化学性质类似卤素单质,它与水反应的化学方程式为
__________
内容结构
