5.1 从黑火药到酸雨——全球性的环境问题──酸雨 课件(31张PPT)
文档属性
| 名称 | 5.1 从黑火药到酸雨——全球性的环境问题──酸雨 课件(31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-29 20:52:49 | ||
图片预览











文档简介
(共31张PPT)
二氧化硫的性质
第1课时
沪科版
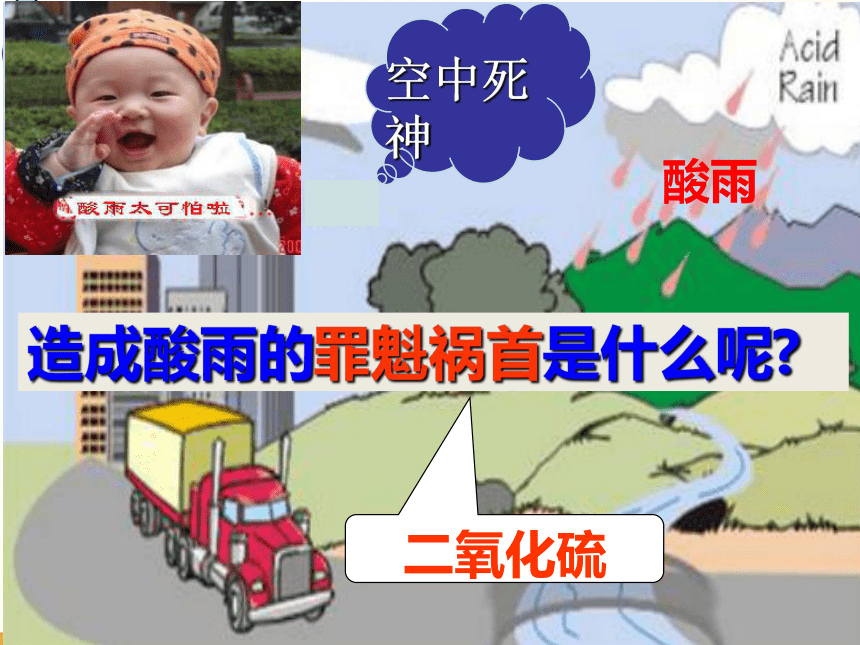
全球性的环境问题---酸雨
酸雨的危害:
酸雨
造成酸雨的罪魁祸首是什么呢?
二氧化硫
1、掌握二氧化硫的物理性质
2、重点掌握二氧化硫的化学性质及用途。
化学性质
SO2是一种_____色、有__________气味、有_______、密度比空气_______、容易_______,易溶于
。(常温常压下,1体积水可溶40体积的SO2)
自主学习
一、物理性质
思考1:
SO2溶于水仅仅只是溶解吗?有没有发生化学反应?
如果有,怎样证明发生了化学反应?
【二
、探究SO2的化学性质】
【实验一】
1.将一支盛有二氧化硫气体的试管倒立在水中,在水面下打开胶塞,轻轻晃动试管,观察液面______。
2.取少量SO2水溶液于试管中,滴加少量紫色石蕊试液,现象:紫色石蕊试液变______,由此说明溶液呈______性
1.酸性氧化物通性
SO2
+
H2O
H2SO3
(弱酸,酸性>H2CO3)
可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
(1)
与水反应
SO2少量:
SO2足量:
(2)
与碱反应
思考:SO2缓慢通入到澄清石灰水中可能看到的现象?
SO2+2NaOH=Na2SO3+H2O
SO2+
NaOH=NaHSO3
SO2
+
Ca(OH)2
=
CaSO3
+
H2O
CaSO3
+
SO2
+
H2O
=
Ca(HSO3)2
2SO2
+
Ca(OH)2
=
Ca(HSO3)2
(3)和碱性氧化物反应
不能
(4)与某些盐的反应
2NaHCO3+SO2
=
SO2+
NaHCO3
=
NaHSO3+CO2
如何除去CO2中混有的SO2气体?
SO2少量:
SO2足量:
Na2SO3
+2CO2
+H2O
SO2+
Na2SO3+H2O
=
2NaHSO3
【实验二】向SO2
水溶液中滴加
2-3滴品红溶液,用力振荡试管,观察现象;再给试管加热,观察溶液的颜色变化,你是否闻到了什么气味?
品红褪色;加热后溶液又变红色,并闻到了刺激性的气味。
2.SO2具有漂白性
使品红溶液褪色
特性
鉴别SO2
SO2
SO2能与某些有色物质(
如品红)化合成不稳定的无色物质。加热后,无色物质会分解,从而恢复物质原来的颜色。
效果:暂时性,加热可复原
不能使酸碱指示剂试液褪色
问题:“黄”银耳是怎样变白的呢?这样的白银耳能食用吗?为什么?
食用这类食品,对人体的肝、肾脏等会造成严重损害,并会致癌。
思考2:
SO2的漂白原理与氯水的漂白原理是否相同?
几种具有漂白性物质的性质比较:
具
有
漂
白
性
的
物
质
物质
HClO
SO2
木炭
实质
氧化还原反应
非氧化还原反应(化合)
物理吸附
效果
永久性
暂时性
暂时性
范围
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
可漂白某些有色物质,不能使石蕊试液褪色
可吸附某些有色物质的分子
思考3:S元素还有哪些常见化合价?根据SO2中S元素的化合价,推测它应具有怎样的化学性质?
还原性
SO2
+4
S
H2S
0
-2
SO3
+6
H2SO4
+6
氧化性
【实验三】将SO2
气体通入氢硫酸中,观察现象,并说明SO2表现何种性质?
SO2
+
2H2S
==
3
S
↓+
2H2O
3.二氧化硫的氧化性
产生黄色沉淀
【实验四】在一支试管中滴加少量高锰酸钾溶液(一种强氧化剂),然后再滴入少量SO2水溶液,观察现象,并说明SO2表现何种性质?
紫红色的高锰酸钾溶液褪色,由此说明SO2表现还原性。
二氧化硫还可以与其它强氧化剂的反应,如新制的氯水、溴水、
H2O2、O2等。
3.二氧化硫的还原性
SO3+H2O=H2SO4
思考与交流
SO2和氯水都有漂白性,将二者等物质的量混合后漂白性是否会更好呢?
SO2+2H2O+Cl2=H2SO4+2HCl
SO2+2H2O+Cl2=4H+
+
SO42-+2Cl-
不能
生成两种强酸,酸性增强
so2是产生酸雨的主要原因。那么,so2是不是有百害而无一利呢?
三、SO2的“功”与“过”
⑵用于杀菌和消毒。
⑶作食物和干果的防腐剂。
⑷制造硫酸。
⑴可以漂白纸浆、毛、丝、草编制品等。
请谈谈本节课你收获了什么…..
还原性
[巩固训练]
氧化性
还原性
漂白性
还原性
水溶液呈酸性
随堂练习
2.下列可以用来鉴别SO2
和CO2
的方法是[
]
A、通入紫色石蕊试液
B、闻气味
C、通入澄清石灰水
D、通入品红溶液中
B
D
其他方法?
3、现有某混合气体可能含有SO2和CO2,通过以下装置鉴定。依次通过的顺序是
。(装置可重复使用)
①②①③
4.
二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将(
)
A
和氯气单独通过时相同
B、和SO2单独通过时相同
C、是二者作用效果之和
D、可能失去漂白性
D
5.全社会都在倡导诚信,然而总是有一部分不法商贩却在背道而驰。如有些商贩为了使银耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的。这些不法商贩所制取银耳利用的是
(
)
A.S的漂白性
B.S的还原性
C.SO2的漂白性
D.SO2的还原性
C
6.下列物质:①
NaOH;②氯水;③空气;④氢硫酸;⑤Na2SO3;⑥Na2CO3;其中能与SO2在一定条件下发生反应的是(
)
①②④⑤
B.
②④⑤⑥
C.
②③④⑥
D.
全部
D
7.下列四种有色溶液与SO2作用,均能褪色,①品红溶液;②酸性高锰酸钾溶液;③溴水;④滴有酚酞的NaOH溶液,其实质相同的是(
)
A.
①④
B.
①②③
C.
②③④
D.
②③
D
利用课余时间,全面了解二氧化硫的用途和危害。思考我们该如何科学、合理的使用二氧化硫,让这位“空中死神”为人类造福!
从生活中来,再回到生活中去。
二氧化硫的性质
第1课时
沪科版
全球性的环境问题---酸雨
酸雨的危害:
酸雨
造成酸雨的罪魁祸首是什么呢?
二氧化硫
1、掌握二氧化硫的物理性质
2、重点掌握二氧化硫的化学性质及用途。
化学性质
SO2是一种_____色、有__________气味、有_______、密度比空气_______、容易_______,易溶于
。(常温常压下,1体积水可溶40体积的SO2)
自主学习
一、物理性质
思考1:
SO2溶于水仅仅只是溶解吗?有没有发生化学反应?
如果有,怎样证明发生了化学反应?
【二
、探究SO2的化学性质】
【实验一】
1.将一支盛有二氧化硫气体的试管倒立在水中,在水面下打开胶塞,轻轻晃动试管,观察液面______。
2.取少量SO2水溶液于试管中,滴加少量紫色石蕊试液,现象:紫色石蕊试液变______,由此说明溶液呈______性
1.酸性氧化物通性
SO2
+
H2O
H2SO3
(弱酸,酸性>H2CO3)
可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
(1)
与水反应
SO2少量:
SO2足量:
(2)
与碱反应
思考:SO2缓慢通入到澄清石灰水中可能看到的现象?
SO2+2NaOH=Na2SO3+H2O
SO2+
NaOH=NaHSO3
SO2
+
Ca(OH)2
=
CaSO3
+
H2O
CaSO3
+
SO2
+
H2O
=
Ca(HSO3)2
2SO2
+
Ca(OH)2
=
Ca(HSO3)2
(3)和碱性氧化物反应
不能
(4)与某些盐的反应
2NaHCO3+SO2
=
SO2+
NaHCO3
=
NaHSO3+CO2
如何除去CO2中混有的SO2气体?
SO2少量:
SO2足量:
Na2SO3
+2CO2
+H2O
SO2+
Na2SO3+H2O
=
2NaHSO3
【实验二】向SO2
水溶液中滴加
2-3滴品红溶液,用力振荡试管,观察现象;再给试管加热,观察溶液的颜色变化,你是否闻到了什么气味?
品红褪色;加热后溶液又变红色,并闻到了刺激性的气味。
2.SO2具有漂白性
使品红溶液褪色
特性
鉴别SO2
SO2
SO2能与某些有色物质(
如品红)化合成不稳定的无色物质。加热后,无色物质会分解,从而恢复物质原来的颜色。
效果:暂时性,加热可复原
不能使酸碱指示剂试液褪色
问题:“黄”银耳是怎样变白的呢?这样的白银耳能食用吗?为什么?
食用这类食品,对人体的肝、肾脏等会造成严重损害,并会致癌。
思考2:
SO2的漂白原理与氯水的漂白原理是否相同?
几种具有漂白性物质的性质比较:
具
有
漂
白
性
的
物
质
物质
HClO
SO2
木炭
实质
氧化还原反应
非氧化还原反应(化合)
物理吸附
效果
永久性
暂时性
暂时性
范围
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
可漂白某些有色物质,不能使石蕊试液褪色
可吸附某些有色物质的分子
思考3:S元素还有哪些常见化合价?根据SO2中S元素的化合价,推测它应具有怎样的化学性质?
还原性
SO2
+4
S
H2S
0
-2
SO3
+6
H2SO4
+6
氧化性
【实验三】将SO2
气体通入氢硫酸中,观察现象,并说明SO2表现何种性质?
SO2
+
2H2S
==
3
S
↓+
2H2O
3.二氧化硫的氧化性
产生黄色沉淀
【实验四】在一支试管中滴加少量高锰酸钾溶液(一种强氧化剂),然后再滴入少量SO2水溶液,观察现象,并说明SO2表现何种性质?
紫红色的高锰酸钾溶液褪色,由此说明SO2表现还原性。
二氧化硫还可以与其它强氧化剂的反应,如新制的氯水、溴水、
H2O2、O2等。
3.二氧化硫的还原性
SO3+H2O=H2SO4
思考与交流
SO2和氯水都有漂白性,将二者等物质的量混合后漂白性是否会更好呢?
SO2+2H2O+Cl2=H2SO4+2HCl
SO2+2H2O+Cl2=4H+
+
SO42-+2Cl-
不能
生成两种强酸,酸性增强
so2是产生酸雨的主要原因。那么,so2是不是有百害而无一利呢?
三、SO2的“功”与“过”
⑵用于杀菌和消毒。
⑶作食物和干果的防腐剂。
⑷制造硫酸。
⑴可以漂白纸浆、毛、丝、草编制品等。
请谈谈本节课你收获了什么…..
还原性
[巩固训练]
氧化性
还原性
漂白性
还原性
水溶液呈酸性
随堂练习
2.下列可以用来鉴别SO2
和CO2
的方法是[
]
A、通入紫色石蕊试液
B、闻气味
C、通入澄清石灰水
D、通入品红溶液中
B
D
其他方法?
3、现有某混合气体可能含有SO2和CO2,通过以下装置鉴定。依次通过的顺序是
。(装置可重复使用)
①②①③
4.
二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将(
)
A
和氯气单独通过时相同
B、和SO2单独通过时相同
C、是二者作用效果之和
D、可能失去漂白性
D
5.全社会都在倡导诚信,然而总是有一部分不法商贩却在背道而驰。如有些商贩为了使银耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的。这些不法商贩所制取银耳利用的是
(
)
A.S的漂白性
B.S的还原性
C.SO2的漂白性
D.SO2的还原性
C
6.下列物质:①
NaOH;②氯水;③空气;④氢硫酸;⑤Na2SO3;⑥Na2CO3;其中能与SO2在一定条件下发生反应的是(
)
①②④⑤
B.
②④⑤⑥
C.
②③④⑥
D.
全部
D
7.下列四种有色溶液与SO2作用,均能褪色,①品红溶液;②酸性高锰酸钾溶液;③溴水;④滴有酚酞的NaOH溶液,其实质相同的是(
)
A.
①④
B.
①②③
C.
②③④
D.
②③
D
利用课余时间,全面了解二氧化硫的用途和危害。思考我们该如何科学、合理的使用二氧化硫,让这位“空中死神”为人类造福!
从生活中来,再回到生活中去。
