浓硫酸1
图片预览






文档简介
(共21张PPT)
清华大学电机系大四学生刘海洋,为了验证“笨狗熊”的说法能否成立,在2002年1月29日和2月23日先后两次有预谋地把掺有火碱、浓硫酸的饮料,倒在北京动物园饲养的狗熊的嘴里和身上。
尘封的记忆:
可怜的熊
那么浓硫酸为什么会伤害到狗熊呢
酸的通性
⑴使酸碱指示剂的变色
⑵与活泼金属的反应
⑶与碱性氧化物的反应
⑷与碱的反应
⑸与某些盐的反应
知识回顾
稀硫酸显酸性的原因是什么?
H2SO4
=
SO42-+2H+
思考交流
实验室里用金属与酸反应制取氢气往往使用稀硫酸或盐酸,而不用浓硫酸或硝酸,这是为什么
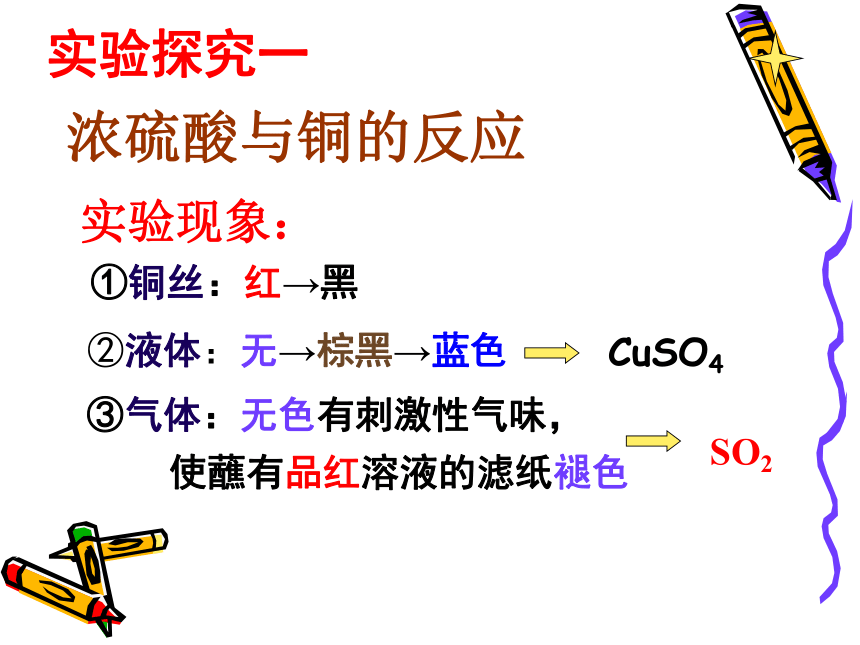
①铜丝:红→黑
②液体:无→棕黑→蓝色
③气体:无色有刺激性气味,
使蘸有品红溶液的滤纸褪色
SO2
实验现象:
CuSO4
实验探究一
浓硫酸与铜的反应
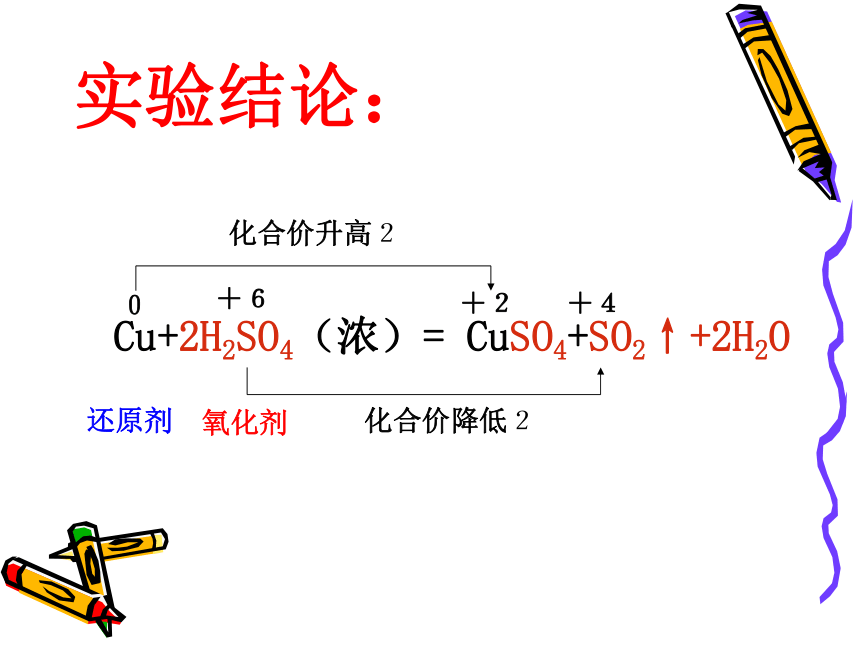
实验结论:
Cu+2H2SO4(浓)= CuSO4+SO2↑+2H2O
0
+6
+2
+4
化合价升高2
化合价降低2
还原剂
氧化剂
常温下为什么可以用铁制或铝制的容器运输浓硫酸
结论:
常温下浓硫酸会和Fe,Al发生钝化反应,生成致密的氧化膜,阻止反应的进一步进行
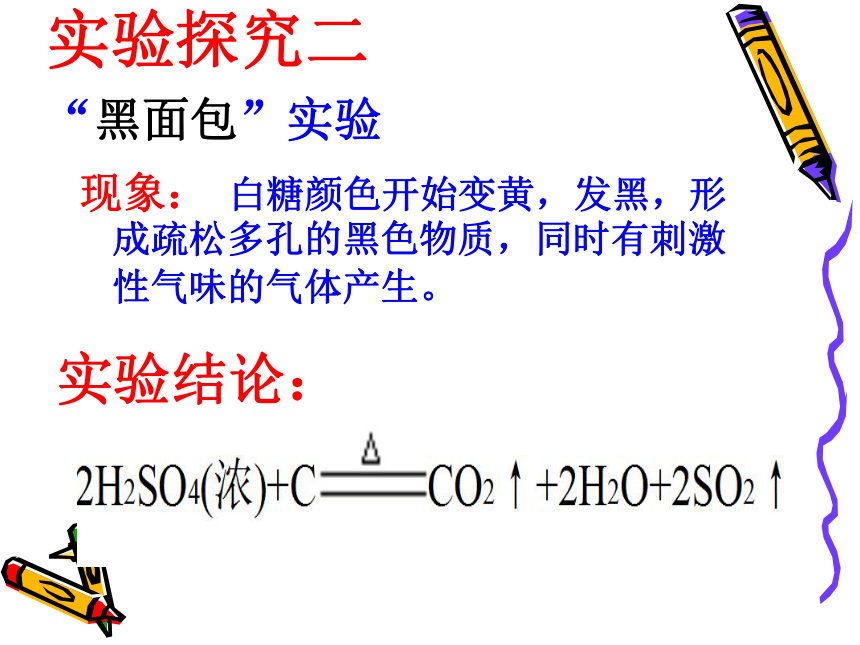
实验探究二
“黑面包”实验
现象: 白糖颜色开始变黄,发黑,形成疏松多孔的黑色物质,同时有刺激性气味的气体产生。
实验结论:
为什么看到蔗糖由白变黑了 为什么有气体放出 这个实验中体现出浓硫酸的什么性质
结论:蔗糖是由C、H、O三种元素构成的,浓硫酸可使其按H∶O=2∶1的比例脱水,剩下C,同时C又和浓硫酸反应:
△
2H2SO4(浓)+ C CO2↑+2SO2↑+2H2O
体现了浓硫酸的脱水性和强氧化性。
⑴浓硫酸具有强氧化性,能与大多数金属和非金属反应;
⑵加热时浓硫酸的氧化性更强;
⑶铝、铁在常温下与浓硫酸发生钝化作用。
小结要点:
二、浓硫酸的物理性质
浓硫酸是一种无色油状液体。高沸点难挥发的强酸,密度大,极易溶于水。
三、硫酸的用途:
小结
一. 浓硫酸的化学性质
1.具有酸的通性
2.浓硫酸的特性
(1)强氧化性 (2)脱水性 (3)吸水性
二.浓硫酸的物理性质
三.硫酸的用途
可怜的熊
那么浓硫酸为什么会伤害到狗熊呢
[课堂练习]
1、把下列现象中硫酸所表现出来的性质填写在空白处。
(1)把锌粒放入稀硫酸中时,有氢气放出。( )
(2)在烧杯中敞口放置浓硫酸时质量增加。( )
(3)用玻璃棒蘸取浓硫酸滴在纸上,纸变黑( )
(4)把木炭放入热的浓硫酸中时,有气体放出( )
(5)铁、铝与冷的浓硫酸中钝化。( )
酸性
吸水性
氧化性
氧化性
脱水性
A、稀硫酸与锌粒反应
B、二氧化硫与氧气反应
C、浓硫酸与铜反应
D、三氧化硫与水反应
2、在下列反应中,硫元素表现出氧化性的是( )
c
3、下列反应中,既能说明浓硫酸具有脱水性,又能说明浓硫酸具有强氧化性的是
A、C和浓硫酸 B、Cu和浓H2SO4
C、蔗糖和浓硫酸 D、Al和浓H2SO4
c
4.用废铜屑与硫酸反应制CuSO4,以下两种方法,哪一种方法好?为什么?
2
5.在一定体积的18mol/L的浓硫酸中加入过量铜片,并加热,被还原的硫酸为0.9mol,则浓硫酸的实际体积为( )
A.等于50ml B.大于50ml
C.等于100ml D.大于100ml
Cu + 2H2SO4(浓)= CuSO4 + SO2 ↑+ 2H2O
解析:
实际参加反应的H2SO4为2× 0.9mol=1.8mol,即100ml。因为随着反应的进行,浓H2SO4溶液逐渐变稀,而Cu与稀H2SO4溶液不反应,故浓H2SO4溶液的实际体积大100ml。
D
清华大学电机系大四学生刘海洋,为了验证“笨狗熊”的说法能否成立,在2002年1月29日和2月23日先后两次有预谋地把掺有火碱、浓硫酸的饮料,倒在北京动物园饲养的狗熊的嘴里和身上。
尘封的记忆:
可怜的熊
那么浓硫酸为什么会伤害到狗熊呢
酸的通性
⑴使酸碱指示剂的变色
⑵与活泼金属的反应
⑶与碱性氧化物的反应
⑷与碱的反应
⑸与某些盐的反应
知识回顾
稀硫酸显酸性的原因是什么?
H2SO4
=
SO42-+2H+
思考交流
实验室里用金属与酸反应制取氢气往往使用稀硫酸或盐酸,而不用浓硫酸或硝酸,这是为什么
①铜丝:红→黑
②液体:无→棕黑→蓝色
③气体:无色有刺激性气味,
使蘸有品红溶液的滤纸褪色
SO2
实验现象:
CuSO4
实验探究一
浓硫酸与铜的反应
实验结论:
Cu+2H2SO4(浓)= CuSO4+SO2↑+2H2O
0
+6
+2
+4
化合价升高2
化合价降低2
还原剂
氧化剂
常温下为什么可以用铁制或铝制的容器运输浓硫酸
结论:
常温下浓硫酸会和Fe,Al发生钝化反应,生成致密的氧化膜,阻止反应的进一步进行
实验探究二
“黑面包”实验
现象: 白糖颜色开始变黄,发黑,形成疏松多孔的黑色物质,同时有刺激性气味的气体产生。
实验结论:
为什么看到蔗糖由白变黑了 为什么有气体放出 这个实验中体现出浓硫酸的什么性质
结论:蔗糖是由C、H、O三种元素构成的,浓硫酸可使其按H∶O=2∶1的比例脱水,剩下C,同时C又和浓硫酸反应:
△
2H2SO4(浓)+ C CO2↑+2SO2↑+2H2O
体现了浓硫酸的脱水性和强氧化性。
⑴浓硫酸具有强氧化性,能与大多数金属和非金属反应;
⑵加热时浓硫酸的氧化性更强;
⑶铝、铁在常温下与浓硫酸发生钝化作用。
小结要点:
二、浓硫酸的物理性质
浓硫酸是一种无色油状液体。高沸点难挥发的强酸,密度大,极易溶于水。
三、硫酸的用途:
小结
一. 浓硫酸的化学性质
1.具有酸的通性
2.浓硫酸的特性
(1)强氧化性 (2)脱水性 (3)吸水性
二.浓硫酸的物理性质
三.硫酸的用途
可怜的熊
那么浓硫酸为什么会伤害到狗熊呢
[课堂练习]
1、把下列现象中硫酸所表现出来的性质填写在空白处。
(1)把锌粒放入稀硫酸中时,有氢气放出。( )
(2)在烧杯中敞口放置浓硫酸时质量增加。( )
(3)用玻璃棒蘸取浓硫酸滴在纸上,纸变黑( )
(4)把木炭放入热的浓硫酸中时,有气体放出( )
(5)铁、铝与冷的浓硫酸中钝化。( )
酸性
吸水性
氧化性
氧化性
脱水性
A、稀硫酸与锌粒反应
B、二氧化硫与氧气反应
C、浓硫酸与铜反应
D、三氧化硫与水反应
2、在下列反应中,硫元素表现出氧化性的是( )
c
3、下列反应中,既能说明浓硫酸具有脱水性,又能说明浓硫酸具有强氧化性的是
A、C和浓硫酸 B、Cu和浓H2SO4
C、蔗糖和浓硫酸 D、Al和浓H2SO4
c
4.用废铜屑与硫酸反应制CuSO4,以下两种方法,哪一种方法好?为什么?
2
5.在一定体积的18mol/L的浓硫酸中加入过量铜片,并加热,被还原的硫酸为0.9mol,则浓硫酸的实际体积为( )
A.等于50ml B.大于50ml
C.等于100ml D.大于100ml
Cu + 2H2SO4(浓)= CuSO4 + SO2 ↑+ 2H2O
解析:
实际参加反应的H2SO4为2× 0.9mol=1.8mol,即100ml。因为随着反应的进行,浓H2SO4溶液逐渐变稀,而Cu与稀H2SO4溶液不反应,故浓H2SO4溶液的实际体积大100ml。
D
