硝酸
图片预览







文档简介
(共22张PPT)
第4节(第3课时) 硝酸
(Nitric acid)
第四章 非金属及其化合物
玻尔是丹麦著名的物理学家,曾获
得诺贝尔奖。第二次世界大战期间,由于
德军即将占领丹麦,玻尔被迫要离开自己
的祖国。他坚信以后一定能再返祖国,决
定把心爱的诺贝尔奖章留下。为了不使
奖章落入德军手中,他将诺贝尔金质奖章溶解在一种溶液里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。这是一个多么聪明的办法啊!
化学史话
玻尔巧藏诺贝尔金质奖章
观察与总结:
一、硝酸的物理性质
(1)纯HNO3是 色、易 ,有 气味
的液体.
挥发
刺激性
无
(2)能与水任意比互溶.
常用浓硝酸质量分数为69%。
质量分数为98%以上的硝酸为“发烟硝酸”。
(3)纯HNO3的沸点是83℃,密度为1.5027g/cm3。
[展示]一瓶硝酸
雾
思考与讨论
久置的硝酸为何会变黄?
4HNO3 4NO2↑+O2↑ +2H2O
△
或光照
1、不稳定性:
二、硝酸的化学性质
(HNO3浓度越高,越易分解)
溶液变黄:因为浓硝酸分解产生NO2溶于硝酸所致。
信息一:浓硝酸需放在棕色瓶中
信息二:NO2呈红棕色
保存?
棕色瓶、低温、避光保存。
什么样的物质需用棕色瓶保存?
见光易分解的物质:如浓HNO3 、氯水、AgBr、AgI 等。
2.酸的通性(HNO3=H++NO3-)
1.使指示剂变色;
2.与碱反应;
3.与某些金属氧化物反应;
4.与某些盐起反应
HNO3+NaOH=
2HNO3+CuO=
2HNO3 +CaCO3=
5.硝酸与某些金属反应,产生氢气吗?
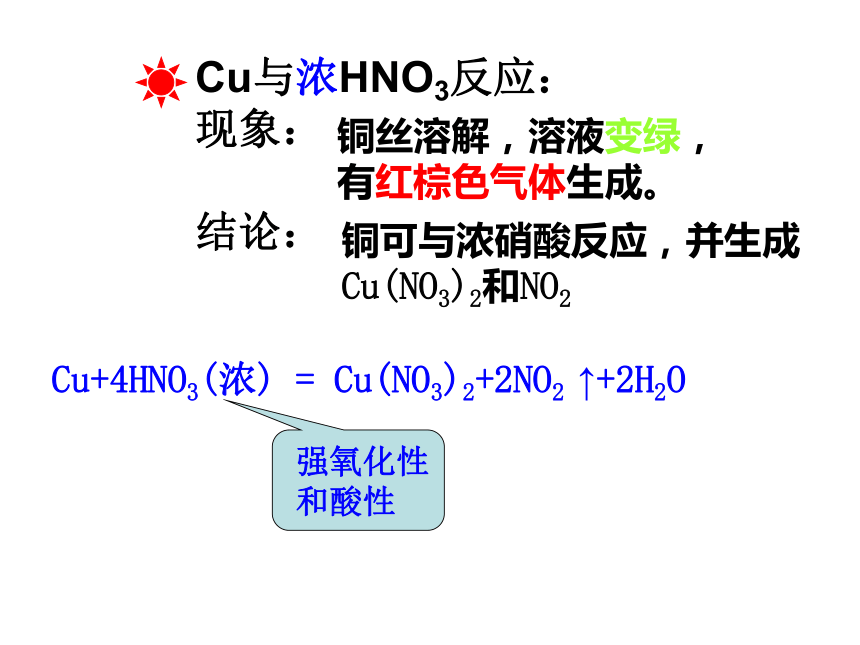
Cu与浓HNO3反应:
现象:
结论:
铜丝溶解,溶液变绿,
有红棕色气体生成。
铜可与浓硝酸反应,并生成
Cu(NO3)2和NO2
Cu+4HNO3(浓) = Cu(NO3)2+2NO2 ↑+2H2O
强氧化性
和酸性
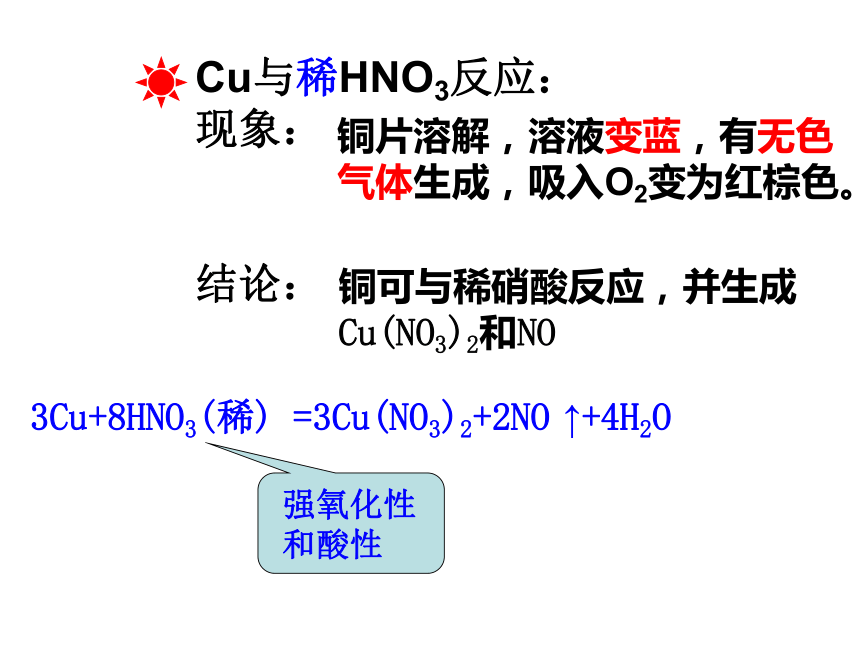
Cu与稀HNO3反应:
现象:
结论:
铜片溶解,溶液变蓝,有无色
气体生成,吸入O2变为红棕色。
铜可与稀硝酸反应,并生成
Cu(NO3)2和NO
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO ↑+4H2O
强氧化性
和酸性
3、强氧化性
硝酸与金属反应的规律:
1)金属与HNO3反应时,金属被氧化成高价硝酸盐:
R+HNO3→R(NO3)x+NOx+H2O
一般情况下:浓HNO3被还原为NO2 ,
稀HNO3被还原为NO 。
①与金属反应:HNO3可与绝大多数金属反应
(除Pt、Au外)
2)常温下,浓硝酸使铁、铝等金属钝化
3)硝酸浓度越高,氧化性越强.(浓HNO3>稀HNO3)
[练习] 浓硝酸与Ag的反应:
稀硝酸与Ag的反应:
大洋网讯 林女士带着结婚项链、耳环来到黄兴路步行街某金店清洗。只见老板李某当着林的面,把物品放入准备好的盆子里清洗,没料到一条14克的项链从液体中捞出来,竟成了细细的一团,链条细如发丝,丈夫听说结婚项链遭受“横祸”,便把它送到有关部门鉴定,一称只有2.81克,1条14克的项链经过清洗竟整整短缺11.19克!事后了解,金项链变“瘦”的原因真相大白:洗首饰店的老板用一种化学药水洗金子,金子与药水起化学反应,首饰表面部分溶解,店老板通过其它方式,把处于液态的金子重新复原,牟取暴利。
[扩展视野]
3体积浓盐酸与1体积浓硝酸的混合物叫做王水。它的氧化能力更强,可以溶解铂和金。
帮
你
记
忆
(3:1)
②与非金属反应:
热的浓HNO3与C的反应:
4HNO3(浓) + C = CO2 + 4NO2 + 2H2O
规律:浓硝酸与非金属反应(C、S、P),一般将
非金属氧化为最高价氧化物或最高价含氧酸;自
身被还原为NO2
强氧化性
③与低价化合物反应:
H2S、HI、HBr、 SO2、
Na2SO3、FeO等
[练习]下列各组离子因发生氧化还原反应而不能大量共存的是( )。 A.HCO3-、OH-、Na+、Cl- B.Fe2+、H+、NO3-、Cl- C.Cu2+、Na+、S2-、SO42- D.H+、K+、SO32-、S2-
BD
硝 酸
物理性质
化学性质
1.不稳定性
2. 强酸性
3.强氧化性
(1)与金属Cu
(2)与非金属C
(3)与低价化合物
小 结
注意:①稀硝酸遇石蕊变红(体现酸性),
②浓硝酸遇石蕊先变红(体现酸性),
加热后褪色(体现强氧化性)。
合作讨论
己知紫色石蕊试液滴入硝酸现象如下:
分别体现了浓硝酸和稀硝酸的什么性质?
浓硝酸:先变红,加热褪色
稀硝酸:变红,加热不褪色
1.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是( )
A.测定密度 B.放入硝酸中
C.放入盐酸中 D.观察外观
D
试一试
2.单质跟浓HNO3 混合出现的情况依次为:①反应生成相应的硝酸盐②反应生成最高价氧化物③单质呈钝态④不发生反应 符合上述情况的单质是: ( )
A.Cu P Zn Au B.Ag C Al Pt
C.Fe C Zn Hg D.C S Fe Au
B
试一试
3. 将铜粉放入稀H2SO4中,加热无明显现象发生,当加入下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该物质是: ( )
A. Fe2(SO4)3 B. Na2SO4
C. KNO3 D. FeSO4
C
想一想
4.工业上拟用Cu与适量硝酸制备Cu(NO3)2 ,
下面是三位同学提出的三个方案:
甲: 铜
浓硝酸
乙: 铜
稀硝酸
丙: 铜
空气
△
硝酸
请问:那一种方案最好 为什么
Cu(NO3)2
Cu(NO3)2
Cu(NO3)2
CuO
思考题
5.下列各项中表现硝酸的哪种性质?
1)98%的硝酸在空气中“发烟” ( )
2)浓硝酸需保存在棕色瓶中 ( )
3)金属与硝酸反应不产生氢气 ( )
A 强酸性 B 强氧化性
C 挥发性 D 不稳定性
6.下列关于硝酸的叙述正确的是 ( )
A 稀硝酸是弱酸,浓硝酸是强酸
B 铜与浓硝酸和稀硝酸都能反应生成
二氧化氮
C 浓硝酸和稀硝酸都是强氧化剂
D 稀硝酸与活泼金属反应主要放出氢气,
而浓硝酸则使金属钝化
C
D
B
C
随堂练习:
2 在石蕊试纸上滴上浓硝酸,会有什么现象?
先变红,后褪色
3 将浓HCl, 浓H2SO4,浓HNO3分别滴在三块 蓝色石蕊试纸上,会有什么现象?
浓HCl变红色
浓H2SO4先变红,后变黑
浓HNO3先变红,后褪色
问题: 1 、若把硝酸分解产生的气体收集起来,在倒置在水槽中,液体能否充满整个容器?
4NO2+ O2+ 2H2O== 4HNO3
4.有关硝酸化学性质的叙述中,正确的是 ( )
A.浓硝酸有强氧化性、稀硝酸有弱氧化性B.浓硝酸与铁常温下不反应
C.硝酸与Na2S反应制得H2S
D.浓硝酸常因分解产生NO2又溶解于硝酸而 呈黄色
课堂练习
D
第4节(第3课时) 硝酸
(Nitric acid)
第四章 非金属及其化合物
玻尔是丹麦著名的物理学家,曾获
得诺贝尔奖。第二次世界大战期间,由于
德军即将占领丹麦,玻尔被迫要离开自己
的祖国。他坚信以后一定能再返祖国,决
定把心爱的诺贝尔奖章留下。为了不使
奖章落入德军手中,他将诺贝尔金质奖章溶解在一种溶液里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。这是一个多么聪明的办法啊!
化学史话
玻尔巧藏诺贝尔金质奖章
观察与总结:
一、硝酸的物理性质
(1)纯HNO3是 色、易 ,有 气味
的液体.
挥发
刺激性
无
(2)能与水任意比互溶.
常用浓硝酸质量分数为69%。
质量分数为98%以上的硝酸为“发烟硝酸”。
(3)纯HNO3的沸点是83℃,密度为1.5027g/cm3。
[展示]一瓶硝酸
雾
思考与讨论
久置的硝酸为何会变黄?
4HNO3 4NO2↑+O2↑ +2H2O
△
或光照
1、不稳定性:
二、硝酸的化学性质
(HNO3浓度越高,越易分解)
溶液变黄:因为浓硝酸分解产生NO2溶于硝酸所致。
信息一:浓硝酸需放在棕色瓶中
信息二:NO2呈红棕色
保存?
棕色瓶、低温、避光保存。
什么样的物质需用棕色瓶保存?
见光易分解的物质:如浓HNO3 、氯水、AgBr、AgI 等。
2.酸的通性(HNO3=H++NO3-)
1.使指示剂变色;
2.与碱反应;
3.与某些金属氧化物反应;
4.与某些盐起反应
HNO3+NaOH=
2HNO3+CuO=
2HNO3 +CaCO3=
5.硝酸与某些金属反应,产生氢气吗?
Cu与浓HNO3反应:
现象:
结论:
铜丝溶解,溶液变绿,
有红棕色气体生成。
铜可与浓硝酸反应,并生成
Cu(NO3)2和NO2
Cu+4HNO3(浓) = Cu(NO3)2+2NO2 ↑+2H2O
强氧化性
和酸性
Cu与稀HNO3反应:
现象:
结论:
铜片溶解,溶液变蓝,有无色
气体生成,吸入O2变为红棕色。
铜可与稀硝酸反应,并生成
Cu(NO3)2和NO
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO ↑+4H2O
强氧化性
和酸性
3、强氧化性
硝酸与金属反应的规律:
1)金属与HNO3反应时,金属被氧化成高价硝酸盐:
R+HNO3→R(NO3)x+NOx+H2O
一般情况下:浓HNO3被还原为NO2 ,
稀HNO3被还原为NO 。
①与金属反应:HNO3可与绝大多数金属反应
(除Pt、Au外)
2)常温下,浓硝酸使铁、铝等金属钝化
3)硝酸浓度越高,氧化性越强.(浓HNO3>稀HNO3)
[练习] 浓硝酸与Ag的反应:
稀硝酸与Ag的反应:
大洋网讯 林女士带着结婚项链、耳环来到黄兴路步行街某金店清洗。只见老板李某当着林的面,把物品放入准备好的盆子里清洗,没料到一条14克的项链从液体中捞出来,竟成了细细的一团,链条细如发丝,丈夫听说结婚项链遭受“横祸”,便把它送到有关部门鉴定,一称只有2.81克,1条14克的项链经过清洗竟整整短缺11.19克!事后了解,金项链变“瘦”的原因真相大白:洗首饰店的老板用一种化学药水洗金子,金子与药水起化学反应,首饰表面部分溶解,店老板通过其它方式,把处于液态的金子重新复原,牟取暴利。
[扩展视野]
3体积浓盐酸与1体积浓硝酸的混合物叫做王水。它的氧化能力更强,可以溶解铂和金。
帮
你
记
忆
(3:1)
②与非金属反应:
热的浓HNO3与C的反应:
4HNO3(浓) + C = CO2 + 4NO2 + 2H2O
规律:浓硝酸与非金属反应(C、S、P),一般将
非金属氧化为最高价氧化物或最高价含氧酸;自
身被还原为NO2
强氧化性
③与低价化合物反应:
H2S、HI、HBr、 SO2、
Na2SO3、FeO等
[练习]下列各组离子因发生氧化还原反应而不能大量共存的是( )。 A.HCO3-、OH-、Na+、Cl- B.Fe2+、H+、NO3-、Cl- C.Cu2+、Na+、S2-、SO42- D.H+、K+、SO32-、S2-
BD
硝 酸
物理性质
化学性质
1.不稳定性
2. 强酸性
3.强氧化性
(1)与金属Cu
(2)与非金属C
(3)与低价化合物
小 结
注意:①稀硝酸遇石蕊变红(体现酸性),
②浓硝酸遇石蕊先变红(体现酸性),
加热后褪色(体现强氧化性)。
合作讨论
己知紫色石蕊试液滴入硝酸现象如下:
分别体现了浓硝酸和稀硝酸的什么性质?
浓硝酸:先变红,加热褪色
稀硝酸:变红,加热不褪色
1.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是( )
A.测定密度 B.放入硝酸中
C.放入盐酸中 D.观察外观
D
试一试
2.单质跟浓HNO3 混合出现的情况依次为:①反应生成相应的硝酸盐②反应生成最高价氧化物③单质呈钝态④不发生反应 符合上述情况的单质是: ( )
A.Cu P Zn Au B.Ag C Al Pt
C.Fe C Zn Hg D.C S Fe Au
B
试一试
3. 将铜粉放入稀H2SO4中,加热无明显现象发生,当加入下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该物质是: ( )
A. Fe2(SO4)3 B. Na2SO4
C. KNO3 D. FeSO4
C
想一想
4.工业上拟用Cu与适量硝酸制备Cu(NO3)2 ,
下面是三位同学提出的三个方案:
甲: 铜
浓硝酸
乙: 铜
稀硝酸
丙: 铜
空气
△
硝酸
请问:那一种方案最好 为什么
Cu(NO3)2
Cu(NO3)2
Cu(NO3)2
CuO
思考题
5.下列各项中表现硝酸的哪种性质?
1)98%的硝酸在空气中“发烟” ( )
2)浓硝酸需保存在棕色瓶中 ( )
3)金属与硝酸反应不产生氢气 ( )
A 强酸性 B 强氧化性
C 挥发性 D 不稳定性
6.下列关于硝酸的叙述正确的是 ( )
A 稀硝酸是弱酸,浓硝酸是强酸
B 铜与浓硝酸和稀硝酸都能反应生成
二氧化氮
C 浓硝酸和稀硝酸都是强氧化剂
D 稀硝酸与活泼金属反应主要放出氢气,
而浓硝酸则使金属钝化
C
D
B
C
随堂练习:
2 在石蕊试纸上滴上浓硝酸,会有什么现象?
先变红,后褪色
3 将浓HCl, 浓H2SO4,浓HNO3分别滴在三块 蓝色石蕊试纸上,会有什么现象?
浓HCl变红色
浓H2SO4先变红,后变黑
浓HNO3先变红,后褪色
问题: 1 、若把硝酸分解产生的气体收集起来,在倒置在水槽中,液体能否充满整个容器?
4NO2+ O2+ 2H2O== 4HNO3
4.有关硝酸化学性质的叙述中,正确的是 ( )
A.浓硝酸有强氧化性、稀硝酸有弱氧化性B.浓硝酸与铁常温下不反应
C.硝酸与Na2S反应制得H2S
D.浓硝酸常因分解产生NO2又溶解于硝酸而 呈黄色
课堂练习
D
