第一节 弱电解质的电离——影响弱电解质电离的因素 课件(20张PPT)
文档属性
| 名称 | 第一节 弱电解质的电离——影响弱电解质电离的因素 课件(20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-30 00:00:00 | ||
图片预览








文档简介
(共20张PPT)
课程名称:影响弱电解质电离的因素
版本:沪科课标版
(拓展型教材)
年级:高二级
【环节一】加深认识弱电解质电离平衡的实质
CH3COOH
CH3COO-
+H+
电离
分子化
任务一:根据化学平衡建立过程仿造画出电离平衡v-t图。
任务二:根据化学平衡常数仿写醋酸的电离平衡常数表达式并说出影响因素其意义。
t
v
V(电离)
V(结合)
V(电离)=
V(结合)
处于平衡状态
t1
K=
—————————
c
(CH3COO-
)
c
(H+)
c
(CH3COOH)
注:c
指平衡时各组分的浓度
影响K’因素:受温度影响,与溶液的浓度无关。
K’意义:在一定温度下,电离平衡常数越大,弱电解质的解离能力越强。
【环节二】认识外界因素对电离平衡的影响
回顾:影响化学平衡的因素有哪些?
T、C、P
√
√
问题:影响溶液中电离平衡的因素有哪些?
【任务一】以0.1mol/L醋酸为研究对象,探究温度对其电离平衡的影响。
:温度对其电离平衡的影响有何影响?
预测
:你的依据是什么?
依据
:设计简单实验验证?
验证
CH3COOH
CH3COO-
+H+
因为电离是吸热,升高温度,电离平衡向电离(正)方向移动。
ΔH>0
取2
mL
0.1mol/L
的醋酸溶液于试管中,
用pH试纸测其加热前后溶液pH
的变化。
现象:颜色变化不明显。
结论:方案不可行。
学生设计的实验方案
优化实施的实验方案
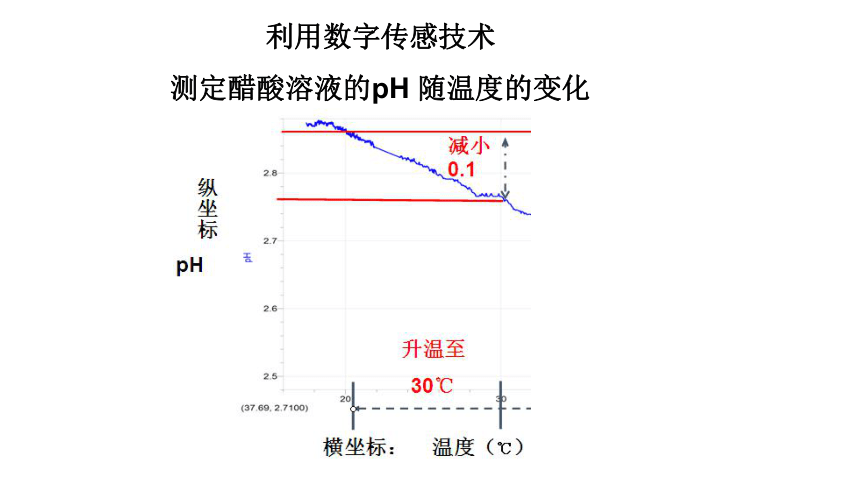
利用数字传感技术
测定醋酸溶液的pH
随温度的变化
:1、影响弱电解质电离平衡的外因——温度
升温促进电离(改变了K)
【任务一】以0.1mol/L醋酸为研究对象,探究温度对其电离平衡的影响。
:温度对其电离平衡的影响有何影响?
预测
:你的依据是什么?
依据
:设计实验验证?
验证
收获
CH3COOH
CH3COO-
+H+
因为醋酸电离是吸热,升高温度,电离平衡向电离(正)方向移动,所以,pH值变小。
ΔH>0
【任务二】
情景:在0.1mol/L
盐酸加少量
NaCl晶体pH值没有明显变化。
问题:在0.1mol/L
醋酸加少量CH3COONH4晶体pH是否有变化?
:
pH
(不变、变大、变小)
预测
:
你的依据是什么?(提示:提示:可运用勒夏特列原理定性分析,也可运用K和Qc定量分析。)
依据
加入前
加入瞬间
加入后
CH3COOH
CH3COO-
+H+
t1
加入前
0.1
b
b
K=
—————
b×b
0.1
t3
加入后
因为Qc>K,所以平衡向结合分子(逆)方向移动
pH值变大。
(原平衡)
t2
加入瞬间
0.1
2b
b
Qc=
—————
2b×b
0.1
(打破平衡)
(平衡移动)
加入CH3COONH4晶体
增大c
(CH3COO-
),电离平衡向结合分子(逆)方向移动,所以pH值变大。
定性
定量
【任务二】
情景:在0.1mol/L
盐酸加少量
NaCl晶体pH值没有明显变化。
问题:在0.1mol/L
醋酸加少量CH3COONH4晶体pH是否有变化?
CH3COOH
CH3COO-
+H+
:
pH
(不变、变大、变小)
预测
:
你的依据是什么?(提示:提示:可运用勒夏特列原理定性分析,也可运用K和Qc定量分析。)
依据
增大
c
(CH3COO-
),电离平衡向结合分子(逆)方向移动。所以,pH值变大。
运算表明
Qc>K
,平衡向结合分子(逆)方向移动。所以,pH值变大。
定性
定量
:设计实验探究验证你的预测?
验证
加少量CH3COONH4
晶体,振荡,测PH值
现象
实验
0.1mol/L
盐酸
0.1mol/L
醋酸
①原溶液pH值
1
②加入相应的盐后再测pH值
加少量
NaCl晶体
加少量
CH3COONH4晶体
pH值没有明显变化
pH值明显变大
【实验探究】在0.1mol/L
醋酸加少量CH3COONH4晶体pH是否有变化?
接近3
收获
(1)加“同离子”抑制电离。
:若往0.1mol/L醋酸中加少量NaOH晶体,pH值如何变化?
拓展
同离子
效应
CH3COOH
CH3COO-
+H+
t1
加入前
0.1
b
b
K=
—————
b×b
0.1
t3
加入后
因为Qc(原平衡)
t2
加入瞬间
0.1
b
0.5b
Qc=
—————
b×0.5b
0.1
(打破平衡)
(平衡移动)
加入NaOH晶体
减少
c
(H+
)
,电离平衡向电离(正)方向移动,所以,pH值变大。
定性
定量
收获
(2)加“反应离子”促进电离。
情景:已知pH=3盐酸稀释1000倍后pH=6
问题:那么pH=3醋酸稀释1000倍后pH=?
测量稀释后PH值
:
pH
6、c
(H+)
10-6mol/L
预测
:
你的依据是什么?(提示:运用勒夏特列原理定性分析或运用K和Qc定量分析。)
依据
【任务三】
CH3COOH
CH3COO-
+H+
K=
—————
10-3×10-3
a
Qc=
—————
10-6×10-6
a×10-3
=
————
10-6×10-3
a
t1
稀释前
a
10-3
10-3
(原平衡)
t2
稀释瞬间
a×10-3
10-6
10-6
(打破平衡)
t3
稀释后
因为
Qc<K
,所以平衡向电离(正)方向移动。
(平衡移动)
加水稀释
定量
情景:已知pH=3盐酸稀释1000倍后pH=6
问题:那么pH=3醋酸稀释1000倍后pH=?
测量稀释后PH值
:
pH
6、c
(H+)
10-6mol/L
预测
:
你的依据是什么?(提示:运用勒夏特列原理定性分析或运用K和Qc定量分析。)
依据
【任务三】
:设计实验探究验证你的预测?
验证
CH3COOH
CH3COO-
+H+
定量:因为
K>Qc
,所以平衡向电离(正)方向移动。
溶液
盐酸
醋酸
稀释前
溶液pH值
3
3
C(H+)
10-3mol/L
10-3mol/L
稀释后
溶液pH值
6
C(H+)
【实验探究】请预测pH=3醋酸稀释1000倍后,溶液pH值的变化?
10-6mol/L
小于6
大于10-6mol/L
(3)加水稀释促进电离。
收获
3、运用K定量分析比勒’定性分析适用范围更广。
小结:当加入的物质改变电离平衡中微粒的浓度时,
电离平衡将会发生移动。
:2、影响弱电解质电离平衡的外因——浓度
(1)加“同离子”抑制电离
(2)加“反应离子”促进电离
(3)加水稀释促进电离
收获
三、影响弱电解质电离平衡的外界因素
2、浓度:当加入的物质改变电离平衡中微粒的浓度时,电离平衡将会发生移动。
加“同离子”抑制电离。
加“反应离子”促进电离。
加水稀释促进电离。
1、温度:升温促进电离。
收获:弱电解质电离符合勒夏特列原理,但判断化学平衡时用K和Qc定量适用范围更广!
【练一练】学评P92学生活动3
加入物质
移动
方向
C(H+)
C(CH3COO-)
C(CH3COOH)
水
HCl(g)
NaOH(s)
CH3COONa(s)
加热
课程名称:影响弱电解质电离的因素
版本:沪科课标版
(拓展型教材)
年级:高二级
【环节一】加深认识弱电解质电离平衡的实质
CH3COOH
CH3COO-
+H+
电离
分子化
任务一:根据化学平衡建立过程仿造画出电离平衡v-t图。
任务二:根据化学平衡常数仿写醋酸的电离平衡常数表达式并说出影响因素其意义。
t
v
V(电离)
V(结合)
V(电离)=
V(结合)
处于平衡状态
t1
K=
—————————
c
(CH3COO-
)
c
(H+)
c
(CH3COOH)
注:c
指平衡时各组分的浓度
影响K’因素:受温度影响,与溶液的浓度无关。
K’意义:在一定温度下,电离平衡常数越大,弱电解质的解离能力越强。
【环节二】认识外界因素对电离平衡的影响
回顾:影响化学平衡的因素有哪些?
T、C、P
√
√
问题:影响溶液中电离平衡的因素有哪些?
【任务一】以0.1mol/L醋酸为研究对象,探究温度对其电离平衡的影响。
:温度对其电离平衡的影响有何影响?
预测
:你的依据是什么?
依据
:设计简单实验验证?
验证
CH3COOH
CH3COO-
+H+
因为电离是吸热,升高温度,电离平衡向电离(正)方向移动。
ΔH>0
取2
mL
0.1mol/L
的醋酸溶液于试管中,
用pH试纸测其加热前后溶液pH
的变化。
现象:颜色变化不明显。
结论:方案不可行。
学生设计的实验方案
优化实施的实验方案
利用数字传感技术
测定醋酸溶液的pH
随温度的变化
:1、影响弱电解质电离平衡的外因——温度
升温促进电离(改变了K)
【任务一】以0.1mol/L醋酸为研究对象,探究温度对其电离平衡的影响。
:温度对其电离平衡的影响有何影响?
预测
:你的依据是什么?
依据
:设计实验验证?
验证
收获
CH3COOH
CH3COO-
+H+
因为醋酸电离是吸热,升高温度,电离平衡向电离(正)方向移动,所以,pH值变小。
ΔH>0
【任务二】
情景:在0.1mol/L
盐酸加少量
NaCl晶体pH值没有明显变化。
问题:在0.1mol/L
醋酸加少量CH3COONH4晶体pH是否有变化?
:
pH
(不变、变大、变小)
预测
:
你的依据是什么?(提示:提示:可运用勒夏特列原理定性分析,也可运用K和Qc定量分析。)
依据
加入前
加入瞬间
加入后
CH3COOH
CH3COO-
+H+
t1
加入前
0.1
b
b
K=
—————
b×b
0.1
t3
加入后
因为Qc>K,所以平衡向结合分子(逆)方向移动
pH值变大。
(原平衡)
t2
加入瞬间
0.1
2b
b
Qc=
—————
2b×b
0.1
(打破平衡)
(平衡移动)
加入CH3COONH4晶体
增大c
(CH3COO-
),电离平衡向结合分子(逆)方向移动,所以pH值变大。
定性
定量
【任务二】
情景:在0.1mol/L
盐酸加少量
NaCl晶体pH值没有明显变化。
问题:在0.1mol/L
醋酸加少量CH3COONH4晶体pH是否有变化?
CH3COOH
CH3COO-
+H+
:
pH
(不变、变大、变小)
预测
:
你的依据是什么?(提示:提示:可运用勒夏特列原理定性分析,也可运用K和Qc定量分析。)
依据
增大
c
(CH3COO-
),电离平衡向结合分子(逆)方向移动。所以,pH值变大。
运算表明
Qc>K
,平衡向结合分子(逆)方向移动。所以,pH值变大。
定性
定量
:设计实验探究验证你的预测?
验证
加少量CH3COONH4
晶体,振荡,测PH值
现象
实验
0.1mol/L
盐酸
0.1mol/L
醋酸
①原溶液pH值
1
②加入相应的盐后再测pH值
加少量
NaCl晶体
加少量
CH3COONH4晶体
pH值没有明显变化
pH值明显变大
【实验探究】在0.1mol/L
醋酸加少量CH3COONH4晶体pH是否有变化?
接近3
收获
(1)加“同离子”抑制电离。
:若往0.1mol/L醋酸中加少量NaOH晶体,pH值如何变化?
拓展
同离子
效应
CH3COOH
CH3COO-
+H+
t1
加入前
0.1
b
b
K=
—————
b×b
0.1
t3
加入后
因为Qc
t2
加入瞬间
0.1
b
0.5b
Qc=
—————
b×0.5b
0.1
(打破平衡)
(平衡移动)
加入NaOH晶体
减少
c
(H+
)
,电离平衡向电离(正)方向移动,所以,pH值变大。
定性
定量
收获
(2)加“反应离子”促进电离。
情景:已知pH=3盐酸稀释1000倍后pH=6
问题:那么pH=3醋酸稀释1000倍后pH=?
测量稀释后PH值
:
pH
6、c
(H+)
10-6mol/L
预测
:
你的依据是什么?(提示:运用勒夏特列原理定性分析或运用K和Qc定量分析。)
依据
【任务三】
CH3COOH
CH3COO-
+H+
K=
—————
10-3×10-3
a
Qc=
—————
10-6×10-6
a×10-3
=
————
10-6×10-3
a
t1
稀释前
a
10-3
10-3
(原平衡)
t2
稀释瞬间
a×10-3
10-6
10-6
(打破平衡)
t3
稀释后
因为
Qc<K
,所以平衡向电离(正)方向移动。
(平衡移动)
加水稀释
定量
情景:已知pH=3盐酸稀释1000倍后pH=6
问题:那么pH=3醋酸稀释1000倍后pH=?
测量稀释后PH值
:
pH
6、c
(H+)
10-6mol/L
预测
:
你的依据是什么?(提示:运用勒夏特列原理定性分析或运用K和Qc定量分析。)
依据
【任务三】
:设计实验探究验证你的预测?
验证
CH3COOH
CH3COO-
+H+
定量:因为
K>Qc
,所以平衡向电离(正)方向移动。
溶液
盐酸
醋酸
稀释前
溶液pH值
3
3
C(H+)
10-3mol/L
10-3mol/L
稀释后
溶液pH值
6
C(H+)
【实验探究】请预测pH=3醋酸稀释1000倍后,溶液pH值的变化?
10-6mol/L
小于6
大于10-6mol/L
(3)加水稀释促进电离。
收获
3、运用K定量分析比勒’定性分析适用范围更广。
小结:当加入的物质改变电离平衡中微粒的浓度时,
电离平衡将会发生移动。
:2、影响弱电解质电离平衡的外因——浓度
(1)加“同离子”抑制电离
(2)加“反应离子”促进电离
(3)加水稀释促进电离
收获
三、影响弱电解质电离平衡的外界因素
2、浓度:当加入的物质改变电离平衡中微粒的浓度时,电离平衡将会发生移动。
加“同离子”抑制电离。
加“反应离子”促进电离。
加水稀释促进电离。
1、温度:升温促进电离。
收获:弱电解质电离符合勒夏特列原理,但判断化学平衡时用K和Qc定量适用范围更广!
【练一练】学评P92学生活动3
加入物质
移动
方向
C(H+)
C(CH3COO-)
C(CH3COOH)
水
HCl(g)
NaOH(s)
CH3COONa(s)
加热
