元素周期律1
图片预览







文档简介
(共58张PPT)
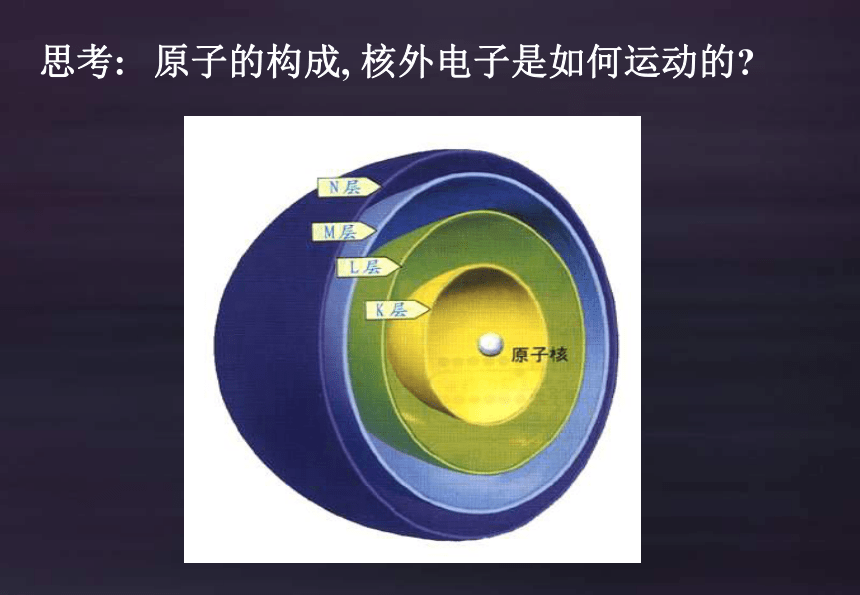
思考:
原子的构成, 核外电子是如何运动的
电子层的表示方法:
1 2 3 4 5 ……
K L M N O ……
离核由近到远,能量由低到高
一、原子核外电子排布:
1、电子按能量高低分层排布:
2、电子的排布规律:
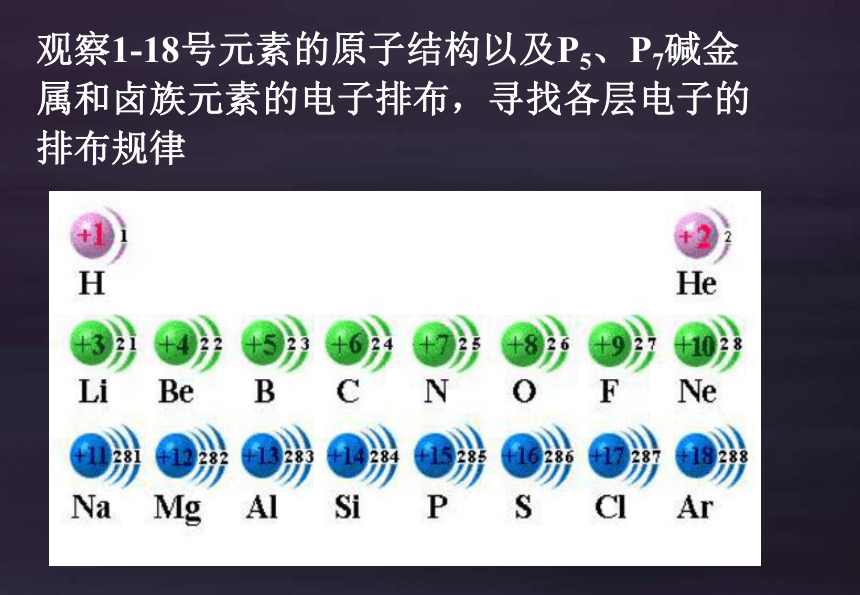
观察1-18号元素的原子结构以及P5、P7碱金属和卤族元素的电子排布,寻找各层电子的排布规律
电子层 K L M N …
电子层上最多
容纳的电子数
2×12 2×22 2×32 2×42 …
小结:
(1)各电子层最多容纳的电子数为2n2个。
2
8
18
32
(2)最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层不超过32个。
(3)核外电子优先占有能量较低的轨道,只有当能量较低的轨道排满后,再排能量比较高的轨道。
A. 元素原子最外层电子数为次外层电子数的3倍; B. 元素M层电子是L层电子的1/2; C. 元素原子的L层电子数与K层电子数之差是电 子层数的2.5倍. D. 元素原子次外层电子数是最外层电子数的1/4
试一试:写出符合下列条件的短周期元素,画出A, B, C, D的原子结构示意图
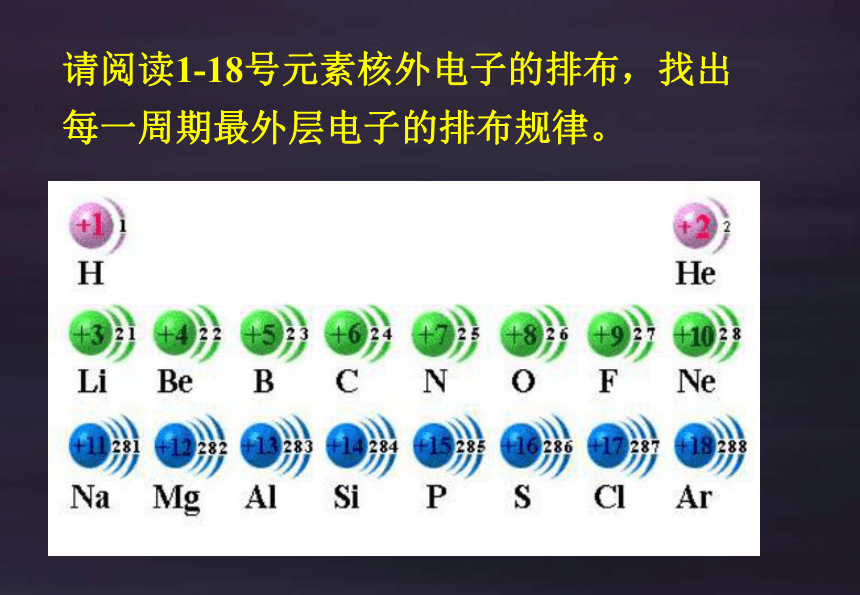
请阅读1-18号元素核外电子的排布,找出每一周期最外层电子的排布规律。
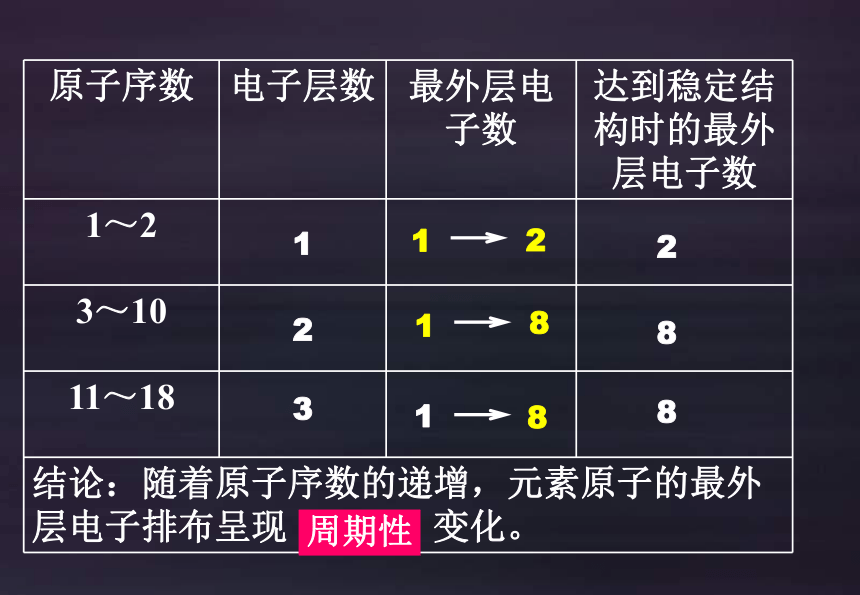
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2
3~10
11~18
结论:随着原子序数的递增,元素原子的最外层电子排布呈现 变化。
1
2
3
8
8
2
周期性
1
2
1
8
1
8
在元素周期表中找出原子半径最大的元素和原子半径最小的元素。
2. 当电子层数相同时,核内质子数越小, 半径越大, 如: Na>Mg; F- >Na+
小结微粒半径的比较方法:
1. 先比较电子层数,电子层数越多,半径越大, 如:S>C
3. 阴离子半径>其原子半径, 如: Cl->Cl
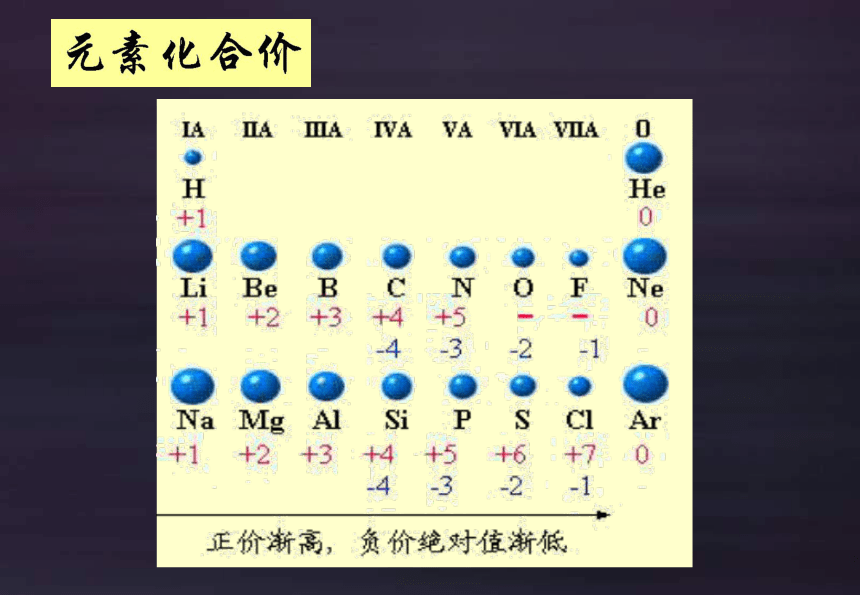
分析:元素的最高正价与最外层电子数的关系;元素的最高正价与负价之间的关系。
1. 在下列元素中,最高正化合价数值最大 的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4, 则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4
1. 在下列元素中,最高正化合价数值最大 的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4, 则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4
C
1. 在下列元素中,最高正化合价数值最大 的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4, 则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4
C
B
小结:随着原子序数的递增
小结:随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
小结:随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
小结:随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化
1. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 2. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y
B
1. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 2. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y
B
B
1. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 2. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y
3. X和Y两元素的阳离子具有相同的电子层结构, X元素的阳离子半径大于Y元素的阳离子半径; Z和Y两元素的原子核外电子层数相同, Z元素的原子半径小于Y元素的原子半径, X、Y、Z三种元素原子序数的关系是 A. X>Y>Z B. Y>X>Z C. Z>X>Y D. Z>Y>X
3. X和Y两元素的阳离子具有相同的电子层结构, X元素的阳离子半径大于Y元素的阳离子半径; Z和Y两元素的原子核外电子层数相同, Z元素的原子半径小于Y元素的原子半径, X、Y、Z三种元素原子序数的关系是 A. X>Y>Z B. Y>X>Z C. Z>X>Y D. Z>Y>X
D
+5
+5
1
+5
1
7
+5
1
7
S2->Y-
随着原子序数的递增
均呈现周期性变化
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
结构 性质
决定
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
金属性和非金属性
?
思考:
原子的构成, 核外电子是如何运动的
电子层的表示方法:
1 2 3 4 5 ……
K L M N O ……
离核由近到远,能量由低到高
一、原子核外电子排布:
1、电子按能量高低分层排布:
2、电子的排布规律:
观察1-18号元素的原子结构以及P5、P7碱金属和卤族元素的电子排布,寻找各层电子的排布规律
电子层 K L M N …
电子层上最多
容纳的电子数
2×12 2×22 2×32 2×42 …
小结:
(1)各电子层最多容纳的电子数为2n2个。
2
8
18
32
(2)最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层不超过32个。
(3)核外电子优先占有能量较低的轨道,只有当能量较低的轨道排满后,再排能量比较高的轨道。
A. 元素原子最外层电子数为次外层电子数的3倍; B. 元素M层电子是L层电子的1/2; C. 元素原子的L层电子数与K层电子数之差是电 子层数的2.5倍. D. 元素原子次外层电子数是最外层电子数的1/4
试一试:写出符合下列条件的短周期元素,画出A, B, C, D的原子结构示意图
请阅读1-18号元素核外电子的排布,找出每一周期最外层电子的排布规律。
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2
3~10
11~18
结论:随着原子序数的递增,元素原子的最外层电子排布呈现 变化。
1
2
3
8
8
2
周期性
1
2
1
8
1
8
在元素周期表中找出原子半径最大的元素和原子半径最小的元素。
2. 当电子层数相同时,核内质子数越小, 半径越大, 如: Na>Mg; F- >Na+
小结微粒半径的比较方法:
1. 先比较电子层数,电子层数越多,半径越大, 如:S>C
3. 阴离子半径>其原子半径, 如: Cl->Cl
分析:元素的最高正价与最外层电子数的关系;元素的最高正价与负价之间的关系。
1. 在下列元素中,最高正化合价数值最大 的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4, 则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4
1. 在下列元素中,最高正化合价数值最大 的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4, 则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4
C
1. 在下列元素中,最高正化合价数值最大 的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4, 则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4
C
B
小结:随着原子序数的递增
小结:随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
小结:随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
小结:随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化
1. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 2. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y
B
1. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 2. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y
B
B
1. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 2. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y
3. X和Y两元素的阳离子具有相同的电子层结构, X元素的阳离子半径大于Y元素的阳离子半径; Z和Y两元素的原子核外电子层数相同, Z元素的原子半径小于Y元素的原子半径, X、Y、Z三种元素原子序数的关系是 A. X>Y>Z B. Y>X>Z C. Z>X>Y D. Z>Y>X
3. X和Y两元素的阳离子具有相同的电子层结构, X元素的阳离子半径大于Y元素的阳离子半径; Z和Y两元素的原子核外电子层数相同, Z元素的原子半径小于Y元素的原子半径, X、Y、Z三种元素原子序数的关系是 A. X>Y>Z B. Y>X>Z C. Z>X>Y D. Z>Y>X
D
+5
+5
1
+5
1
7
+5
1
7
S2->Y-
随着原子序数的递增
均呈现周期性变化
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
结构 性质
决定
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
金属性和非金属性
?
