元素周期律2
图片预览









文档简介
(共65张PPT)
元素周期律
随着原子序数的递增
均呈现周期性变化
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
结构 性质
决定
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
金属性和非金属性
?
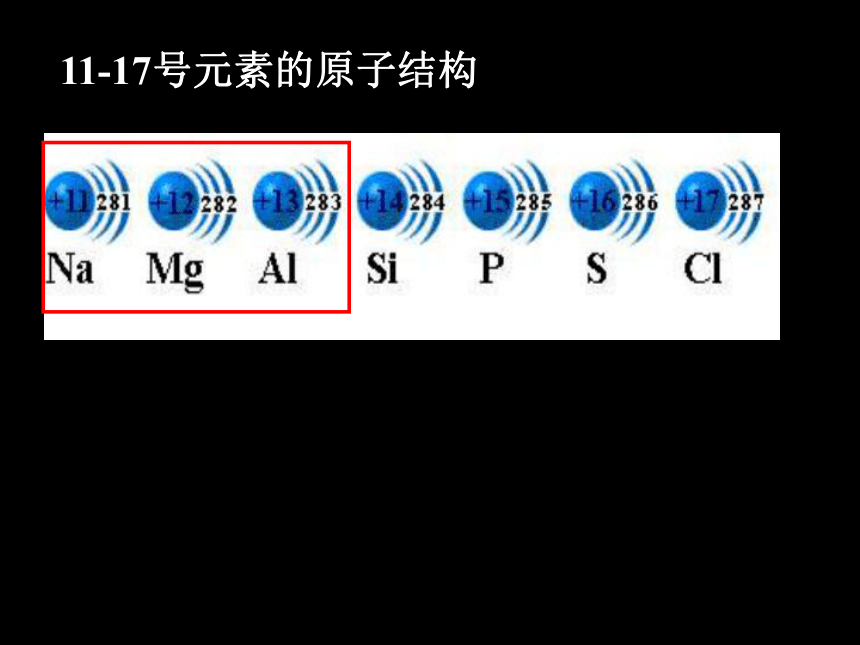
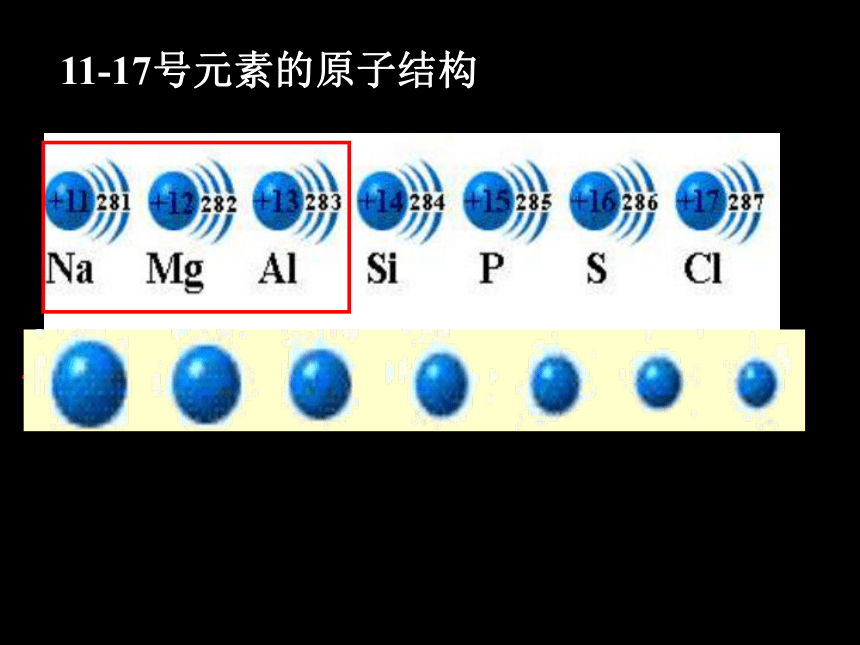
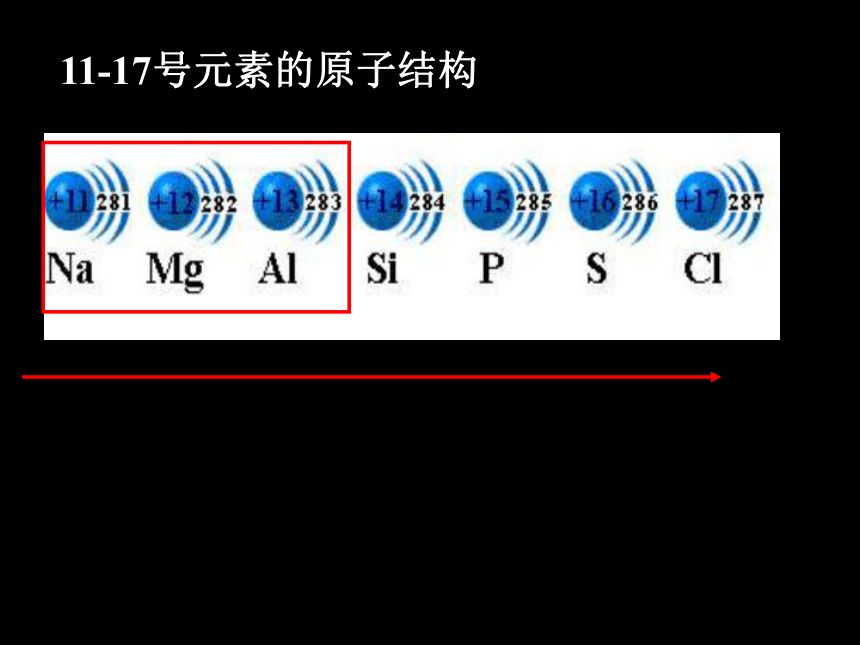
11-17号元素的原子结构
11-17号元素的原子结构
11-17号元素的原子结构
11-17号元素的原子结构
推测:金属性逐渐减弱,非金属性逐渐增强。
钠
铷
铯
Na、Mg、Al金属性强弱比较
实验1: Na、Mg分别与水反应
Na、Mg、Al金属性强弱比较
2滴
1
2
注意 (1)加水2-3ml, (2)加热沸腾后熄灭酒精灯,待停止沸腾后立刻观察实验现象。
现象比较
实验小结:
1)Na与水:
2)Mg与水:
现象比较
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
现象比较
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
现象比较
反应 方程式
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
现象比较
反应 方程式
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
现象比较
反应 方程式
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
>
现象比较
反应 方程式
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
结论:金属性Na Mg
Mg、Al金属性强弱比较
浓盐酸
铝
镁
浓盐酸
Mg、Al金属性强弱比较
注意: 加入盐酸2ml, 观察,并比较反应的剧烈程度。
现象比较
化学方程式
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
现象比较
化学方程式
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
现象比较
化学方程式
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
现象比较
化学方程式
结论:金属性Mg Al
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
现象比较
化学方程式
结论:金属性Mg Al
>
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
金属性Na>Mg
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
金属性Na>Mg
金属性Mg>Al
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
金属性Na>Mg
金属性Mg>Al
结论: 金属性Na>Mg>Al
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
结论: 金属性Na>Mg>Al
NaOH
Mg(OH)2
Al(OH)3
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
强碱
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
强碱
中强碱
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
两性氢氧化物
强碱
中强碱
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
两性氢氧化物
强碱
中强碱
>
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
两性氢氧化物
强碱
中强碱
>
>
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
两性氢氧化物
强碱
中强碱
>
>
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
金属性: Na Mg Al
>
>
阅读课本P16. 3:
分析非金属元素的性质,你能够得出什么结论?
同一周期的元素,有哪些相同?那些呈现递变性?
元素性质随着原子序数的递增而呈现周期性的变化。这一规律叫元素周期律。
1. 元素性质呈周期性变化的原因是:
A. 相对原子质量逐渐增大
B. 核电荷数逐渐增大
C. 核外电子排布呈周期性变化
D. 元素的化合价呈周期性变化
C
1. 元素性质呈周期性变化的原因是:
A. 相对原子质量逐渐增大
B. 核电荷数逐渐增大
C. 核外电子排布呈周期性变化
D. 元素的化合价呈周期性变化
1、下列元素的单质中, A. Na B. Mg C. Al D.K 最难和水反应产生氢气的是( ) 反应最剧烈的是( ) 最高价氧化物对应水化物碱性最强的是( )
C
1、下列元素的单质中, A. Na B. Mg C. Al D.K 最难和水反应产生氢气的是( ) 反应最剧烈的是( ) 最高价氧化物对应水化物碱性最强的是( )
C
D
1、下列元素的单质中, A. Na B. Mg C. Al D.K 最难和水反应产生氢气的是( ) 反应最剧烈的是( ) 最高价氧化物对应水化物碱性最强的是( )
C
D
D
1、下列元素的单质中, A. Na B. Mg C. Al D.K 最难和水反应产生氢气的是( ) 反应最剧烈的是( ) 最高价氧化物对应水化物碱性最强的是( )
2. 有三种金属a, b, c, 在相同条件下, b的最高价氧化物的水化物的碱性比a的最高价氧化物的水化物碱性强, a可以从c的盐溶液中置换出c。则这三种金属元素的金属性由强到弱的顺序是( ) A. a、b 、c B. b、a、c C. b、c、a D. c、b、a
B
2. 有三种金属a, b, c, 在相同条件下, b的最高价氧化物的水化物的碱性比a的最高价氧化物的水化物碱性强, a可以从c的盐溶液中置换出c。则这三种金属元素的金属性由强到弱的顺序是( ) A. a、b 、c B. b、a、c C. b、c、a D. c、b、a
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
Na
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
Na
Al
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
Na
Al
Cl
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
Na
Al
Cl
Cl
2. 某元素最高价氧化物对应的水化物的化学式为H2XO3,这种元素的气态氢化物的化学式为( ) A. HX B. H2X C. XH3 D. XH4
2. 某元素最高价氧化物对应的水化物的化学式为H2XO3,这种元素的气态氢化物的化学式为( ) A. HX B. H2X C. XH3 D. XH4
D
B
4. 电子层数相同的X、Y、Z三种元素,其最高价氧化物对应水化物的酸性强弱是HXO4>H2YO4>H3ZO4,则它们对应气态氢化物的稳定性由强到弱的是_______________(写化学式,下同);非金属性由强到弱的是_______________。
HX>H2Y>ZH3
4. 电子层数相同的X、Y、Z三种元素,其最高价氧化物对应水化物的酸性强弱是HXO4>H2YO4>H3ZO4,则它们对应气态氢化物的稳定性由强到弱的是_______________(写化学式,下同);非金属性由强到弱的是_______________。
HX>H2Y>ZH3
X>Y>Z
4. 电子层数相同的X、Y、Z三种元素,其最高价氧化物对应水化物的酸性强弱是HXO4>H2YO4>H3ZO4,则它们对应气态氢化物的稳定性由强到弱的是_______________(写化学式,下同);非金属性由强到弱的是_______________。
请总结同一主族和同一周期中,随着原子序数的递增,电子层数,最外层电子数,原子半径,化合价,元素金属性,非金属性的变化。
元素周期律
随着原子序数的递增
均呈现周期性变化
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
结构 性质
决定
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
原子半径
化合价
随着原子序数的递增
均呈现周期性变化
原子最外层电子排布
金属性和非金属性
?
11-17号元素的原子结构
11-17号元素的原子结构
11-17号元素的原子结构
11-17号元素的原子结构
推测:金属性逐渐减弱,非金属性逐渐增强。
钠
铷
铯
Na、Mg、Al金属性强弱比较
实验1: Na、Mg分别与水反应
Na、Mg、Al金属性强弱比较
2滴
1
2
注意 (1)加水2-3ml, (2)加热沸腾后熄灭酒精灯,待停止沸腾后立刻观察实验现象。
现象比较
实验小结:
1)Na与水:
2)Mg与水:
现象比较
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
现象比较
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
现象比较
反应 方程式
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
现象比较
反应 方程式
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
现象比较
反应 方程式
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
与冷水无明显现象,加热后反应较快
>
现象比较
反应 方程式
实验小结:
1)Na与水:
2)Mg与水:
与冷水剧烈反应
结论:金属性Na Mg
Mg、Al金属性强弱比较
浓盐酸
铝
镁
浓盐酸
Mg、Al金属性强弱比较
注意: 加入盐酸2ml, 观察,并比较反应的剧烈程度。
现象比较
化学方程式
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
现象比较
化学方程式
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
现象比较
化学方程式
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
现象比较
化学方程式
结论:金属性Mg Al
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
现象比较
化学方程式
结论:金属性Mg Al
>
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
金属性Na>Mg
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
金属性Na>Mg
金属性Mg>Al
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
金属性Na>Mg
金属性Mg>Al
结论: 金属性Na>Mg>Al
原子序数 11 12 13
元素符号 Na Mg Al
单质与水反应
单质与酸反应
氢氧化物
热水较快
剧烈反应
反应较快
冷水剧烈
结论: 金属性Na>Mg>Al
NaOH
Mg(OH)2
Al(OH)3
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
强碱
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
强碱
中强碱
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
两性氢氧化物
强碱
中强碱
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
两性氢氧化物
强碱
中强碱
>
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
两性氢氧化物
强碱
中强碱
>
>
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
NaOH
Mg(OH)2
Al(OH)3
两性氢氧化物
强碱
中强碱
>
>
NaOH、Mg(OH)2、Al(OH)3碱性强弱
碱性
金属性: Na Mg Al
>
>
阅读课本P16. 3:
分析非金属元素的性质,你能够得出什么结论?
同一周期的元素,有哪些相同?那些呈现递变性?
元素性质随着原子序数的递增而呈现周期性的变化。这一规律叫元素周期律。
1. 元素性质呈周期性变化的原因是:
A. 相对原子质量逐渐增大
B. 核电荷数逐渐增大
C. 核外电子排布呈周期性变化
D. 元素的化合价呈周期性变化
C
1. 元素性质呈周期性变化的原因是:
A. 相对原子质量逐渐增大
B. 核电荷数逐渐增大
C. 核外电子排布呈周期性变化
D. 元素的化合价呈周期性变化
1、下列元素的单质中, A. Na B. Mg C. Al D.K 最难和水反应产生氢气的是( ) 反应最剧烈的是( ) 最高价氧化物对应水化物碱性最强的是( )
C
1、下列元素的单质中, A. Na B. Mg C. Al D.K 最难和水反应产生氢气的是( ) 反应最剧烈的是( ) 最高价氧化物对应水化物碱性最强的是( )
C
D
1、下列元素的单质中, A. Na B. Mg C. Al D.K 最难和水反应产生氢气的是( ) 反应最剧烈的是( ) 最高价氧化物对应水化物碱性最强的是( )
C
D
D
1、下列元素的单质中, A. Na B. Mg C. Al D.K 最难和水反应产生氢气的是( ) 反应最剧烈的是( ) 最高价氧化物对应水化物碱性最强的是( )
2. 有三种金属a, b, c, 在相同条件下, b的最高价氧化物的水化物的碱性比a的最高价氧化物的水化物碱性强, a可以从c的盐溶液中置换出c。则这三种金属元素的金属性由强到弱的顺序是( ) A. a、b 、c B. b、a、c C. b、c、a D. c、b、a
B
2. 有三种金属a, b, c, 在相同条件下, b的最高价氧化物的水化物的碱性比a的最高价氧化物的水化物碱性强, a可以从c的盐溶液中置换出c。则这三种金属元素的金属性由强到弱的顺序是( ) A. a、b 、c B. b、a、c C. b、c、a D. c、b、a
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
Na
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
Na
Al
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
Na
Al
Cl
练习
1. 用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是_______; (2)最高价氧化物的水化物碱性最强的是______; (3)最高价氧化物的水化物呈两性的是________; (4)最高价氧化物的水化物酸性最强的是_______; (5)能形成气态氢化物且最稳定的是__________.
Na
Na
Al
Cl
Cl
2. 某元素最高价氧化物对应的水化物的化学式为H2XO3,这种元素的气态氢化物的化学式为( ) A. HX B. H2X C. XH3 D. XH4
2. 某元素最高价氧化物对应的水化物的化学式为H2XO3,这种元素的气态氢化物的化学式为( ) A. HX B. H2X C. XH3 D. XH4
D
B
4. 电子层数相同的X、Y、Z三种元素,其最高价氧化物对应水化物的酸性强弱是HXO4>H2YO4>H3ZO4,则它们对应气态氢化物的稳定性由强到弱的是_______________(写化学式,下同);非金属性由强到弱的是_______________。
HX>H2Y>ZH3
4. 电子层数相同的X、Y、Z三种元素,其最高价氧化物对应水化物的酸性强弱是HXO4>H2YO4>H3ZO4,则它们对应气态氢化物的稳定性由强到弱的是_______________(写化学式,下同);非金属性由强到弱的是_______________。
HX>H2Y>ZH3
X>Y>Z
4. 电子层数相同的X、Y、Z三种元素,其最高价氧化物对应水化物的酸性强弱是HXO4>H2YO4>H3ZO4,则它们对应气态氢化物的稳定性由强到弱的是_______________(写化学式,下同);非金属性由强到弱的是_______________。
请总结同一主族和同一周期中,随着原子序数的递增,电子层数,最外层电子数,原子半径,化合价,元素金属性,非金属性的变化。
