人教版九年级化学下册:12.2 化学元素与人体健康课件(共44张PPT)
文档属性
| 名称 | 人教版九年级化学下册:12.2 化学元素与人体健康课件(共44张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 550.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-12 00:00:00 | ||
图片预览








文档简介
(共44张PPT)
我要胃舒平
第三节
酸和碱的反应
酸和碱之间是否会发生化学反应?
如果发生化学反应,又会有什么特点?
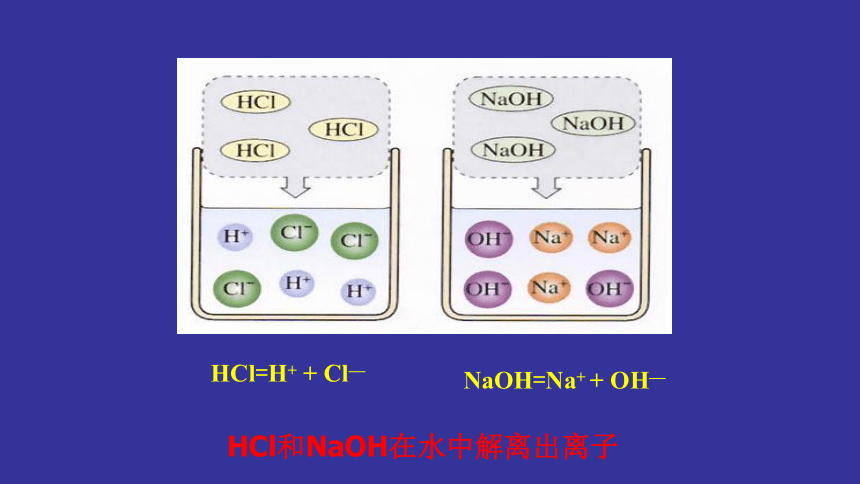
“红酒与白酒”
HCl=H+
+
Cl—
NaOH=Na+
+
OH—
HCl和NaOH在水中解离出离子
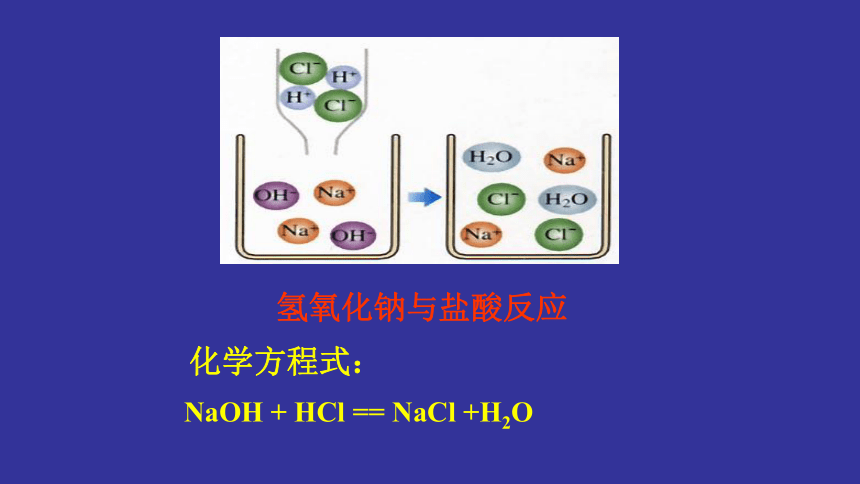
氢氧化钠与盐酸反应
化学方程式:
NaOH
+
HCl
==
NaCl
+H2O
碱:NaOH溶液、Ba(OH)2
溶液、Cu(OH)2
、石灰水;
酸:盐酸、稀硫酸、稀硝酸。
写出下列酸与碱的反应方程式,分析有无明显现象。
H2SO4+Ba(OH)2==
BaSO4↓+2H2O
H2SO4+Cu(OH)2==
CuSO4+2H2O
2HCl+Cu(OH)2==
CuCl2
+2H2O
2HNO3+Cu(OH)2==
Cu(NO3)2
+2H2O
HCl+NaOH==
NaCl
+H2O
2HNO3+
Ca(OH)2==
Ca(NO3)2
+2H2O
思考:
为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法会消除肿痛?
撒熟石灰改良酸性土壤
继续讨论:
1、胃舒平为什么能治疗胃酸过多的病人?
2、对于化工厂排放的碱性废水应怎样处理后才能排放?
1.
下列物质之间的反应属于中和反应的是
(
)
A.
2NaOH+CO2=Na2CO3+H2O
B.
CaCO3+2HCl=CaCl2+H2O+CO2↑
C.
Fe+2HCl=FeCl2+H2↑
D.
2NaOH+H2SO4=Na2SO4+2H2O
练习:
D
2、某锥形瓶中装有稀盐酸。向稀盐酸中逐滴加入NaOH溶液,并不断振荡。下列图中能正确表示锥形瓶中溶液pH变化情况的是
(
)
3、下列化合物中属于盐的是
(
)
A.
CO2
B.
Cu(OH)
2
C.
Na2CO3
D.
H2SO4
B
C
4、为了探究“NaOH+HCl”反应中能量的变化,能用NaOH固体代替NaOH溶液吗?
5、某公路上一装有硫酸的汽车翻了,怎么处理泼了一地的硫酸?
一、中和反应
1、酸和碱作用使各自的特性都消失,生成盐和水的反应叫做中和反应。
酸+碱→盐+水(放热)
2、盐:组成里含有金属离子和酸根离子的化合物.
3、中和反应属于复分解反应。
4、中和反应应用:医药、改良酸性土壤、处理工厂废水等。
酸、碱、盐、氧化物
由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应。
︸
AB+CD=AD+CB
二、复分解反应的条件
酸
碱
盐
金属氧化物
盐
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸+金属氧化物---盐+水
复分解反应包括:
酸碱盐之间是否一定能发生复分解反应呢?
观察下列实验药品,能否按酸、碱、盐进行分类
KNO3
Na2CO3
NaOH
H2SO4
CuSO4
比一比,你分的对吗?
酸
碱
盐
H2SO4
NaOH
KNO3
CuSO4
Na2CO3
找出哪两种物质间能发生复分解反应;
并请说出你判断它是否反应的依据是什么。
第1组
第2组
第3组
第4组
H2SO4
NaOH
Na2CO3
KNO3
CuSO4
H2SO4
NaOH
Na2CO3
KNO3
CuSO4
-
↑
-
-
-
-
-
-
↓
↓
√
√
√
√
H2SO4
+
KNO3
——
K2SO4
+
HNO3
×
H+、SO42-
K+、NO3-
H+、NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
H+、SO42-
Na+、CO3
2
-
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
H2SO4
+
Na2CO3——
Na2SO4+
+
H2O
——
CO2↑
√
(复分解反应的实质)
复分解反应发生的条件
反应
反应发生的条件
实例
酸+碱→盐+水
反应物中酸须可溶
酸+盐→新酸+新盐
反应物中酸须可溶,
生成物中须有沉淀或气体
碱+盐→新碱+新盐
反应物中二者均须可溶,生成物中至少有一种不溶
盐+盐→两种新盐
同上
复分解反应的一般条件
必须具备下列三个条件中的至少一个:有沉淀生成,有气体生成,有水生成。
练习:完成下列能发生反应的方程式
1.BaCl2+H2SO4=
2.Na2CO3+
HCl=
3.K2SO4+HCl—
4.FeCl3+
NaOH=
5.KCl+AgNO3=
6.K2SO4+NaNO3—
7.Fe(OH)3+
HNO3=
8.Ba(OH)2+
HCl=
BaSO4↓+2HCl
2
2NaCl+H2O+CO2↑
3
Fe(OH)3↓+3NaCl
AgCl↓+KNO3
3
Fe(NO3)3+3H2O
2
BaCl2+2H2O
三、盐
1、盐的定义:
由金属离子(或铵根离子)与酸根离子组成的化合物称为盐。
2、盐的分类:
根据金属离子分;
根据酸根离子分;
根据是否含有氧元素分;
根据盐的溶解性分等。
常见的盐的分类
分类
组成特点
盐类统称
类例
根据盐中酸根离子的相同分类
金属离子、Cl-
盐酸盐(氯化物)
金属离子、SO42-
硫酸盐
金属离子、NO3-
硝酸盐
根据盐中金属离子(包括NH4+)
的相同分类
K+、酸根
钾盐
Na+
、酸根
钠盐
NH4+
、酸根
铵盐
3、盐的物理性质:
绝大多数盐常温下为固体,溶解性各异(酸、碱、盐溶解性表)。
①钾钠铵硝盐全溶,盐酸除银和亚汞,
硫酸除去钡铅盐,碱溶钾钠钡,微溶有四种Ca(OH)2、CaSO4、Ag2
SO4、
MgCO3
②
钾钠铵盐水中溶,硝酸盐入水影无踪,
盐酸盐除去银亚汞,硫酸钡铅水不溶。
《酸碱盐溶解性表》的应用
一是为物质间能否发生复分解反应提供了依据;
二是为金属与盐发生反应提供了依据;
三是为离子是否能共存于同一液体中提供了依据。
4、盐的化学性质:
金属+盐溶液→新金属+新盐
盐+酸→新盐+新酸
盐+碱→新盐+新碱
盐+盐→两种新盐
事实再现
:
根据下列实验事实,能比较金属活动性强弱吗?依据是什么?
1、锌能与盐酸发生置换反应,而铜不能。
2、相同条件下,镁与盐酸反应比铁与盐酸反应剧烈。
3、铁能从硫酸铜溶液中置换出铜,而不能置换出硫酸锌中的锌。
四、金属活动性顺序及应用
1、有的金属能与酸发生置换反应,有的不能。能与酸发生置换反应生成氢气的金属比不能与酸发生置换反应的金属活动性强。
2、相同条件下,与酸反应剧烈的金属比反应不剧烈的金属活动性强。
3、一种金属A能把另一种金属B从其盐溶液中置换出来,则这种金属A比另一种金属B活动性强。
归纳:
根据以上事实,你能设计实验来证明铝、铁、铜三种金属的活动性顺序吗?请提出你的假设,并设计实验方案。
方案一药品
HCl
Al
Fe
Cu
方案二药品
Al2(SO4)3
Fe
CuSO4
方案三药品
Al
FeSO4
Cu
方案四药品 Al
Fe
FeSO4
CuSO4
活动与探究
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序
金属活动性由强逐渐减弱
钾
钙
钠
镁
铝
锌
铁锡铅(氢)铜汞银铂金
1、在金属活动性顺序中,金属的位置越靠前,其活动性越强。
2、在金属活动性顺序中,排在氢前的金属能与酸反应置换出氢气,氢后面的金属不能与酸发生置换反应。
3、在金属活动性顺序中,排在前面的金属(不含K、Ca、Na)可以将其后面的金属从其盐溶液中置换出来。
练习1:下列金属跟酸能发生置换反应而放出氢气的是:(
)
A、Fe和稀硫酸
B、Ag和稀盐酸
C、Zn和硝酸
D、Al和浓硫酸
A
练习2:等质量的镁、铁、锌三种金属分别与质量相同、质量分数也相同的稀硫酸充分反应后产生氢气的情况如下图所示:
O
反应时间t
氢气的质量
A
B
C
判断:
1、A是______,B是______,C是______。
2、反应不再发生时一定用完的物质是(
),
(1)镁
(2)铁
(3)锌
(4)H2SO4
镁
锌
铁
H2SO4
考考你
一、判断金属跟酸能否发生置换反应及其反应的快慢
1、排在氢前面的金属才能置换出酸中的氢。
2、酸通常指盐酸和稀硫酸,不能用浓硫酸和硝酸。
3、相同条件下,金属活动性越强,与酸反应越剧烈(即产生H2的速度越快)。
二、判断金属跟盐溶液能否发生置换反应
1、单质金属要排在盐中金属元素前面。
2、单质金属K、Ca、Na要除外。
3、反应物之一
——盐必须是可溶的,即是溶液。
4、铁参与酸、盐溶液中的反应,生成亚铁盐。
练习3:下列反应的化学方程式正确的是:
(
)
A、Cu+2AgCl=2Ag
+
CuCl2
B、Zn+2AgNO3=2Ag+Zn(NO3)2
C、2Na+CuSO4=Cu+Na2SO4
D、2Fe+3CuCl2=2FeCl3+3Cu
E、Fe+ZnSO4=Zn
+FeSO4
B
练习4:在
Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,充分反应后,
有少量金属析出,
则析出的金属中一定有(
)
A、Ag
B、Cu
C、Ag
、Cu
D、Ag
、Cu、Zn
A
三、判断金属跟混合盐溶液反应的次序(了解)
在金属活动性顺序表里,越排在后面的金属越先从它们的盐溶液里被置换出来。或者说:金属活动性相差越大,置换反应越容易发生。
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序
金属活动性由强逐渐减弱
钾
钙
钠
镁
铝
锌
铁锡铅(氢)铜汞银铂金
1、在金属活动性顺序中,金属的位置越靠前,其活动性越强。
2、在金属活动性顺序中,排在氢前的金属能与酸反应置换出氢气,氢后面的金属不能与酸发生置换反应。
3、在金属活动性顺序中,排在前面的金属(不含K、Ca、Na)可以将其后面的金属从其盐溶液中置换出来。
金属活动性顺序在溶液中的主要应用:
1、判断金属跟酸能否发生置换反应及其反应的快慢。
2、判断金属跟盐溶液能否发生置换反应。
3、判断金属跟混合盐溶液反应的次序。
练习1:不能由金属跟稀硫酸直接反应而制得的物质是:(
)
A、MgSO4
B、
CuSO4
C、
FeSO4
D、Al2(SO4)3
练习2:用相同质量的镁和铁分别和足量的稀硫酸反应,能够正确表示反应情况的图示是下列两图中的
图。A表示
的反应情况,B表示
的反应情况。
乙
铁
镁
氢气的质量
反应时间t
O
A
B
(甲)
氢气的质量
O
B
A
反应时间t
(乙)
B
练习3:
X、Y、Z三种金属都能生成二价易溶于水的硫酸盐,它们的活动性顺序是X<Y<Z,则下列化学方程式一定错误的是:
(
)
A、XSO4+Y=X+YSO4
B、Z+YSO4=Y+ZSO4
C、Z+XSO4=X+ZSO4
D、X+
YSO4=
Y
+
XSO4
D
练习5:有A、B、C三种金属,B可以和稀盐酸发生置换反应生成氢气,而A、C不能。但C可以从A的盐溶液中置换出A,则A、B、C三种金属可能是:(
)
A、铁、镁、锌
B、铜、锌、铁
C、铜、镁、铁
D、汞、铁、铜
练习4:把过量的铁粉放入硫酸铜和硫酸锌的混合溶液里,充分反应后过滤,滤纸上残留的物质是:(
)
A、铜
B、铜和铁
C、铜和锌
D、铜、锌、铁
B
D
练习6:要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列的一组物质是:(
)
A、Fe、Cu、MgCl2溶液
B、Fe、CuCl2溶液、MgCl2溶液
C、Mg、Cu、FeCl2溶液
D、Cu、MgCl2溶液、FeCl2溶液
B
C
练习6:要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列的一组物质是:(
)
A、Fe、Cu、MgCl2溶液
B、Fe、CuCl2溶液、MgCl2溶液
C、Mg、Cu、FeCl2溶液
D、Cu、MgCl2溶液、FeCl2溶液
B
C
练习7:在FeCl2
和CuCl2的混合溶液中加入镁粉,下面说法中错误的是:(
)
A、当镁粉无剩余时,溶液中若有Cu2+,则必定有Fe2+
B、当镁粉无剩余时,溶液中一定有Mg2+,可能有Cu2+和
Fe2+
C、当镁粉有剩余时,溶液中只有Fe2+,而无Mg2+和Cu2+
D、当镁粉有剩余时,溶液中只有Mg2+,而无Cu2+和Fe2+
C
物质的推断
物质的推断是根据所给定的一组物质的性质进行综合分析后,推断出被检验的是什么物质、那些物质可能存在,那些物质一定不存在。
推断题的解题思路:
原理
结构特征
反应特征
现象特征
推断
顺推法
逆推法
综合法
结论
验证
审题
推断辨析
明显条件
隐含条件
抓关键
(突破口)
例题:一包白色粉末可能由碳酸钠、硫酸钠和氯化钠中的2种或3种组成。经试验得知其中肯定含有碳酸钠和硫酸钠,为了确定是否含有氯化钠,某同学设计了以下实验。请按该同学的思路填写下表:
实验操作步骤
实验目的、现象及结论
①取少量白色固体粉末,配成水溶液,向其中加入足量的稀酸A,A为(
)
除去(
)
②继续加入足量的B,B为(
)溶液,过滤
除去硫酸钠
③向②的滤液中加入C,C为(
)溶液
若有(
)生成,证明原白色固体粉末中肯定含有氯化钠,反之不含氯化钠
硫酸
碳酸钠
硝酸钡
硝酸银
白色沉淀
物质的共存问题
当几种物质混合后,在给定的条件下如果能发生化学反应,我们说这些物质不能共存,若不能发生反应,则认为可以共存。
例题:有一未知溶液,含有三种溶质,四位同学分别做实验后,得出如下结论,其中你认为正确的是:
(
)
A.该溶液中有AgNO3、Na2CO3、NaCl
B.该溶液中有K2CO3、NaNO3、H2SO4
C.该溶液中有NaCl
、ZnSO4
、HNO3
D.该溶液中有CaCl2、Ba(OH)2
、HCl
C
物质的分离和提纯方法(除杂)
分离是将某种混合物的各成分分开;
提纯(即除杂)只要把杂质成分出去即可。
物理方法
①过滤法
②结晶法
③蒸馏法
④洗气法
化学方法
①逸出气体法
②产生沉淀法
③置换法
④加热法
⑤转换法
例题:下表为各物质中所含有的少量杂质及除去这些杂质应选用的试剂或操作方法。正确的一组为(
)。
序号
物质
杂质
除杂质应选用的试剂或操作方法
①
KNO3溶液
KOH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CuSO4
加入过量铁粉,并过滤
③
H2
CO2
通过盛有NaOH溶液(或KOH溶液)的洗气瓶,再通过盛有浓硫酸的洗气瓶
①
②
B.
②
③
C.
①
③
D.
①
②
③
B
我要胃舒平
第三节
酸和碱的反应
酸和碱之间是否会发生化学反应?
如果发生化学反应,又会有什么特点?
“红酒与白酒”
HCl=H+
+
Cl—
NaOH=Na+
+
OH—
HCl和NaOH在水中解离出离子
氢氧化钠与盐酸反应
化学方程式:
NaOH
+
HCl
==
NaCl
+H2O
碱:NaOH溶液、Ba(OH)2
溶液、Cu(OH)2
、石灰水;
酸:盐酸、稀硫酸、稀硝酸。
写出下列酸与碱的反应方程式,分析有无明显现象。
H2SO4+Ba(OH)2==
BaSO4↓+2H2O
H2SO4+Cu(OH)2==
CuSO4+2H2O
2HCl+Cu(OH)2==
CuCl2
+2H2O
2HNO3+Cu(OH)2==
Cu(NO3)2
+2H2O
HCl+NaOH==
NaCl
+H2O
2HNO3+
Ca(OH)2==
Ca(NO3)2
+2H2O
思考:
为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法会消除肿痛?
撒熟石灰改良酸性土壤
继续讨论:
1、胃舒平为什么能治疗胃酸过多的病人?
2、对于化工厂排放的碱性废水应怎样处理后才能排放?
1.
下列物质之间的反应属于中和反应的是
(
)
A.
2NaOH+CO2=Na2CO3+H2O
B.
CaCO3+2HCl=CaCl2+H2O+CO2↑
C.
Fe+2HCl=FeCl2+H2↑
D.
2NaOH+H2SO4=Na2SO4+2H2O
练习:
D
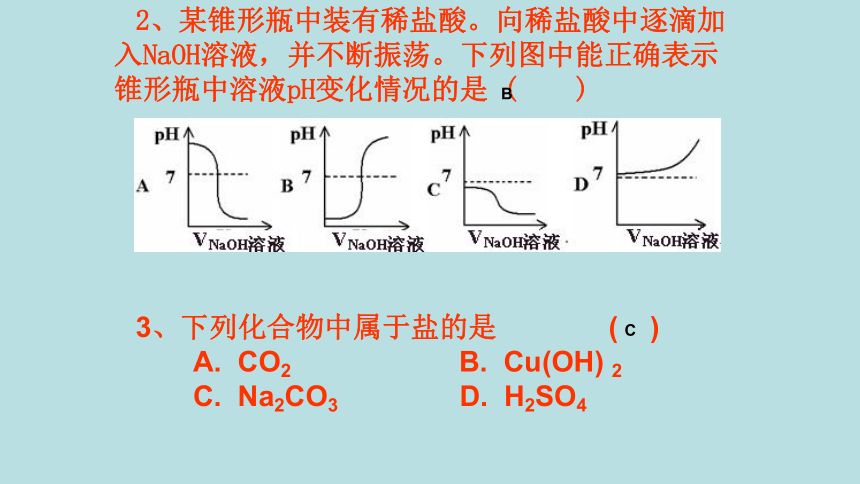
2、某锥形瓶中装有稀盐酸。向稀盐酸中逐滴加入NaOH溶液,并不断振荡。下列图中能正确表示锥形瓶中溶液pH变化情况的是
(
)
3、下列化合物中属于盐的是
(
)
A.
CO2
B.
Cu(OH)
2
C.
Na2CO3
D.
H2SO4
B
C
4、为了探究“NaOH+HCl”反应中能量的变化,能用NaOH固体代替NaOH溶液吗?
5、某公路上一装有硫酸的汽车翻了,怎么处理泼了一地的硫酸?
一、中和反应
1、酸和碱作用使各自的特性都消失,生成盐和水的反应叫做中和反应。
酸+碱→盐+水(放热)
2、盐:组成里含有金属离子和酸根离子的化合物.
3、中和反应属于复分解反应。
4、中和反应应用:医药、改良酸性土壤、处理工厂废水等。
酸、碱、盐、氧化物
由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应。
︸
AB+CD=AD+CB
二、复分解反应的条件
酸
碱
盐
金属氧化物
盐
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸+金属氧化物---盐+水
复分解反应包括:
酸碱盐之间是否一定能发生复分解反应呢?
观察下列实验药品,能否按酸、碱、盐进行分类
KNO3
Na2CO3
NaOH
H2SO4
CuSO4
比一比,你分的对吗?
酸
碱
盐
H2SO4
NaOH
KNO3
CuSO4
Na2CO3
找出哪两种物质间能发生复分解反应;
并请说出你判断它是否反应的依据是什么。
第1组
第2组
第3组
第4组
H2SO4
NaOH
Na2CO3
KNO3
CuSO4
H2SO4
NaOH
Na2CO3
KNO3
CuSO4
-
↑
-
-
-
-
-
-
↓
↓
√
√
√
√
H2SO4
+
KNO3
——
K2SO4
+
HNO3
×
H+、SO42-
K+、NO3-
H+、NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
H+、SO42-
Na+、CO3
2
-
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
H2SO4
+
Na2CO3——
Na2SO4+
+
H2O
——
CO2↑
√
(复分解反应的实质)
复分解反应发生的条件
反应
反应发生的条件
实例
酸+碱→盐+水
反应物中酸须可溶
酸+盐→新酸+新盐
反应物中酸须可溶,
生成物中须有沉淀或气体
碱+盐→新碱+新盐
反应物中二者均须可溶,生成物中至少有一种不溶
盐+盐→两种新盐
同上
复分解反应的一般条件
必须具备下列三个条件中的至少一个:有沉淀生成,有气体生成,有水生成。
练习:完成下列能发生反应的方程式
1.BaCl2+H2SO4=
2.Na2CO3+
HCl=
3.K2SO4+HCl—
4.FeCl3+
NaOH=
5.KCl+AgNO3=
6.K2SO4+NaNO3—
7.Fe(OH)3+
HNO3=
8.Ba(OH)2+
HCl=
BaSO4↓+2HCl
2
2NaCl+H2O+CO2↑
3
Fe(OH)3↓+3NaCl
AgCl↓+KNO3
3
Fe(NO3)3+3H2O
2
BaCl2+2H2O
三、盐
1、盐的定义:
由金属离子(或铵根离子)与酸根离子组成的化合物称为盐。
2、盐的分类:
根据金属离子分;
根据酸根离子分;
根据是否含有氧元素分;
根据盐的溶解性分等。
常见的盐的分类
分类
组成特点
盐类统称
类例
根据盐中酸根离子的相同分类
金属离子、Cl-
盐酸盐(氯化物)
金属离子、SO42-
硫酸盐
金属离子、NO3-
硝酸盐
根据盐中金属离子(包括NH4+)
的相同分类
K+、酸根
钾盐
Na+
、酸根
钠盐
NH4+
、酸根
铵盐
3、盐的物理性质:
绝大多数盐常温下为固体,溶解性各异(酸、碱、盐溶解性表)。
①钾钠铵硝盐全溶,盐酸除银和亚汞,
硫酸除去钡铅盐,碱溶钾钠钡,微溶有四种Ca(OH)2、CaSO4、Ag2
SO4、
MgCO3
②
钾钠铵盐水中溶,硝酸盐入水影无踪,
盐酸盐除去银亚汞,硫酸钡铅水不溶。
《酸碱盐溶解性表》的应用
一是为物质间能否发生复分解反应提供了依据;
二是为金属与盐发生反应提供了依据;
三是为离子是否能共存于同一液体中提供了依据。
4、盐的化学性质:
金属+盐溶液→新金属+新盐
盐+酸→新盐+新酸
盐+碱→新盐+新碱
盐+盐→两种新盐
事实再现
:
根据下列实验事实,能比较金属活动性强弱吗?依据是什么?
1、锌能与盐酸发生置换反应,而铜不能。
2、相同条件下,镁与盐酸反应比铁与盐酸反应剧烈。
3、铁能从硫酸铜溶液中置换出铜,而不能置换出硫酸锌中的锌。
四、金属活动性顺序及应用
1、有的金属能与酸发生置换反应,有的不能。能与酸发生置换反应生成氢气的金属比不能与酸发生置换反应的金属活动性强。
2、相同条件下,与酸反应剧烈的金属比反应不剧烈的金属活动性强。
3、一种金属A能把另一种金属B从其盐溶液中置换出来,则这种金属A比另一种金属B活动性强。
归纳:
根据以上事实,你能设计实验来证明铝、铁、铜三种金属的活动性顺序吗?请提出你的假设,并设计实验方案。
方案一药品
HCl
Al
Fe
Cu
方案二药品
Al2(SO4)3
Fe
CuSO4
方案三药品
Al
FeSO4
Cu
方案四药品 Al
Fe
FeSO4
CuSO4
活动与探究
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序
金属活动性由强逐渐减弱
钾
钙
钠
镁
铝
锌
铁锡铅(氢)铜汞银铂金
1、在金属活动性顺序中,金属的位置越靠前,其活动性越强。
2、在金属活动性顺序中,排在氢前的金属能与酸反应置换出氢气,氢后面的金属不能与酸发生置换反应。
3、在金属活动性顺序中,排在前面的金属(不含K、Ca、Na)可以将其后面的金属从其盐溶液中置换出来。
练习1:下列金属跟酸能发生置换反应而放出氢气的是:(
)
A、Fe和稀硫酸
B、Ag和稀盐酸
C、Zn和硝酸
D、Al和浓硫酸
A
练习2:等质量的镁、铁、锌三种金属分别与质量相同、质量分数也相同的稀硫酸充分反应后产生氢气的情况如下图所示:
O
反应时间t
氢气的质量
A
B
C
判断:
1、A是______,B是______,C是______。
2、反应不再发生时一定用完的物质是(
),
(1)镁
(2)铁
(3)锌
(4)H2SO4
镁
锌
铁
H2SO4
考考你
一、判断金属跟酸能否发生置换反应及其反应的快慢
1、排在氢前面的金属才能置换出酸中的氢。
2、酸通常指盐酸和稀硫酸,不能用浓硫酸和硝酸。
3、相同条件下,金属活动性越强,与酸反应越剧烈(即产生H2的速度越快)。
二、判断金属跟盐溶液能否发生置换反应
1、单质金属要排在盐中金属元素前面。
2、单质金属K、Ca、Na要除外。
3、反应物之一
——盐必须是可溶的,即是溶液。
4、铁参与酸、盐溶液中的反应,生成亚铁盐。
练习3:下列反应的化学方程式正确的是:
(
)
A、Cu+2AgCl=2Ag
+
CuCl2
B、Zn+2AgNO3=2Ag+Zn(NO3)2
C、2Na+CuSO4=Cu+Na2SO4
D、2Fe+3CuCl2=2FeCl3+3Cu
E、Fe+ZnSO4=Zn
+FeSO4
B
练习4:在
Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,充分反应后,
有少量金属析出,
则析出的金属中一定有(
)
A、Ag
B、Cu
C、Ag
、Cu
D、Ag
、Cu、Zn
A
三、判断金属跟混合盐溶液反应的次序(了解)
在金属活动性顺序表里,越排在后面的金属越先从它们的盐溶液里被置换出来。或者说:金属活动性相差越大,置换反应越容易发生。
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序
金属活动性由强逐渐减弱
钾
钙
钠
镁
铝
锌
铁锡铅(氢)铜汞银铂金
1、在金属活动性顺序中,金属的位置越靠前,其活动性越强。
2、在金属活动性顺序中,排在氢前的金属能与酸反应置换出氢气,氢后面的金属不能与酸发生置换反应。
3、在金属活动性顺序中,排在前面的金属(不含K、Ca、Na)可以将其后面的金属从其盐溶液中置换出来。
金属活动性顺序在溶液中的主要应用:
1、判断金属跟酸能否发生置换反应及其反应的快慢。
2、判断金属跟盐溶液能否发生置换反应。
3、判断金属跟混合盐溶液反应的次序。
练习1:不能由金属跟稀硫酸直接反应而制得的物质是:(
)
A、MgSO4
B、
CuSO4
C、
FeSO4
D、Al2(SO4)3
练习2:用相同质量的镁和铁分别和足量的稀硫酸反应,能够正确表示反应情况的图示是下列两图中的
图。A表示
的反应情况,B表示
的反应情况。
乙
铁
镁
氢气的质量
反应时间t
O
A
B
(甲)
氢气的质量
O
B
A
反应时间t
(乙)
B
练习3:
X、Y、Z三种金属都能生成二价易溶于水的硫酸盐,它们的活动性顺序是X<Y<Z,则下列化学方程式一定错误的是:
(
)
A、XSO4+Y=X+YSO4
B、Z+YSO4=Y+ZSO4
C、Z+XSO4=X+ZSO4
D、X+
YSO4=
Y
+
XSO4
D
练习5:有A、B、C三种金属,B可以和稀盐酸发生置换反应生成氢气,而A、C不能。但C可以从A的盐溶液中置换出A,则A、B、C三种金属可能是:(
)
A、铁、镁、锌
B、铜、锌、铁
C、铜、镁、铁
D、汞、铁、铜
练习4:把过量的铁粉放入硫酸铜和硫酸锌的混合溶液里,充分反应后过滤,滤纸上残留的物质是:(
)
A、铜
B、铜和铁
C、铜和锌
D、铜、锌、铁
B
D
练习6:要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列的一组物质是:(
)
A、Fe、Cu、MgCl2溶液
B、Fe、CuCl2溶液、MgCl2溶液
C、Mg、Cu、FeCl2溶液
D、Cu、MgCl2溶液、FeCl2溶液
B
C
练习6:要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列的一组物质是:(
)
A、Fe、Cu、MgCl2溶液
B、Fe、CuCl2溶液、MgCl2溶液
C、Mg、Cu、FeCl2溶液
D、Cu、MgCl2溶液、FeCl2溶液
B
C
练习7:在FeCl2
和CuCl2的混合溶液中加入镁粉,下面说法中错误的是:(
)
A、当镁粉无剩余时,溶液中若有Cu2+,则必定有Fe2+
B、当镁粉无剩余时,溶液中一定有Mg2+,可能有Cu2+和
Fe2+
C、当镁粉有剩余时,溶液中只有Fe2+,而无Mg2+和Cu2+
D、当镁粉有剩余时,溶液中只有Mg2+,而无Cu2+和Fe2+
C
物质的推断
物质的推断是根据所给定的一组物质的性质进行综合分析后,推断出被检验的是什么物质、那些物质可能存在,那些物质一定不存在。
推断题的解题思路:
原理
结构特征
反应特征
现象特征
推断
顺推法
逆推法
综合法
结论
验证
审题
推断辨析
明显条件
隐含条件
抓关键
(突破口)
例题:一包白色粉末可能由碳酸钠、硫酸钠和氯化钠中的2种或3种组成。经试验得知其中肯定含有碳酸钠和硫酸钠,为了确定是否含有氯化钠,某同学设计了以下实验。请按该同学的思路填写下表:
实验操作步骤
实验目的、现象及结论
①取少量白色固体粉末,配成水溶液,向其中加入足量的稀酸A,A为(
)
除去(
)
②继续加入足量的B,B为(
)溶液,过滤
除去硫酸钠
③向②的滤液中加入C,C为(
)溶液
若有(
)生成,证明原白色固体粉末中肯定含有氯化钠,反之不含氯化钠
硫酸
碳酸钠
硝酸钡
硝酸银
白色沉淀
物质的共存问题
当几种物质混合后,在给定的条件下如果能发生化学反应,我们说这些物质不能共存,若不能发生反应,则认为可以共存。
例题:有一未知溶液,含有三种溶质,四位同学分别做实验后,得出如下结论,其中你认为正确的是:
(
)
A.该溶液中有AgNO3、Na2CO3、NaCl
B.该溶液中有K2CO3、NaNO3、H2SO4
C.该溶液中有NaCl
、ZnSO4
、HNO3
D.该溶液中有CaCl2、Ba(OH)2
、HCl
C
物质的分离和提纯方法(除杂)
分离是将某种混合物的各成分分开;
提纯(即除杂)只要把杂质成分出去即可。
物理方法
①过滤法
②结晶法
③蒸馏法
④洗气法
化学方法
①逸出气体法
②产生沉淀法
③置换法
④加热法
⑤转换法
例题:下表为各物质中所含有的少量杂质及除去这些杂质应选用的试剂或操作方法。正确的一组为(
)。
序号
物质
杂质
除杂质应选用的试剂或操作方法
①
KNO3溶液
KOH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CuSO4
加入过量铁粉,并过滤
③
H2
CO2
通过盛有NaOH溶液(或KOH溶液)的洗气瓶,再通过盛有浓硫酸的洗气瓶
①
②
B.
②
③
C.
①
③
D.
①
②
③
B
同课章节目录
