高中化学苏教版必修二专题3 有机化合物的获得与应用第二单元 食品中的有机化合物 乙醇 课件(37张PPT)
文档属性
| 名称 | 高中化学苏教版必修二专题3 有机化合物的获得与应用第二单元 食品中的有机化合物 乙醇 课件(37张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 9.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-30 00:00:00 | ||
图片预览








文档简介
(共37张PPT)
第一课时
乙醇
第二单元
食品中的有机化合物
酒文化
3
甲骨文
篆书
酒文化
古往今来无数先例都证明酒是一种神奇而富有魅力的饮料,那么酒的主要成分是什么呢?
酒文化
一、乙醇的结构
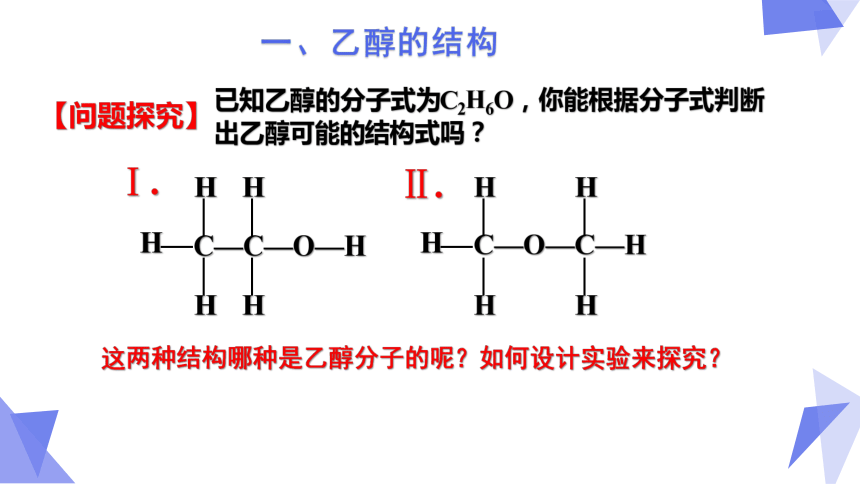
已知乙醇的分子式为C2H6O,你能根据分子式判断出乙醇可能的结构式吗?
C—C—O—H
H
H
H
H
H
C—O—C—H
H
H
H
H
H
Ⅰ.
Ⅱ.
这两种结构哪种是乙醇分子的呢?如何设计实验来探究?
【问题探究】
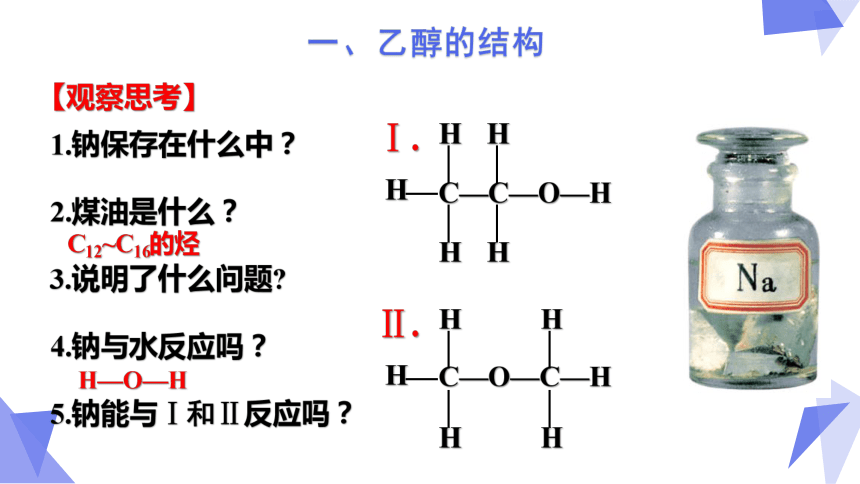
【观察思考】
1.钠保存在什么中?
2.煤油是什么?
3.说明了什么问题?
4.钠与水反应吗?
5.钠能与Ⅰ和Ⅱ反应吗?
C12~C16的烃
C—C—O—H
H
H
H
H
H
C—O—C—H
H
H
H
H
H
Ⅰ.
Ⅱ.
H—O—H
一、乙醇的结构
2.另取一小粒钠放入盛有水的烧杯中,观察现象。
【实验探究】
一、乙醇的结构
由现象可知,乙醇的结构应该是
。
Ⅰ
1.取一小粒钠放入盛有乙醇的烧杯中,观察现象。
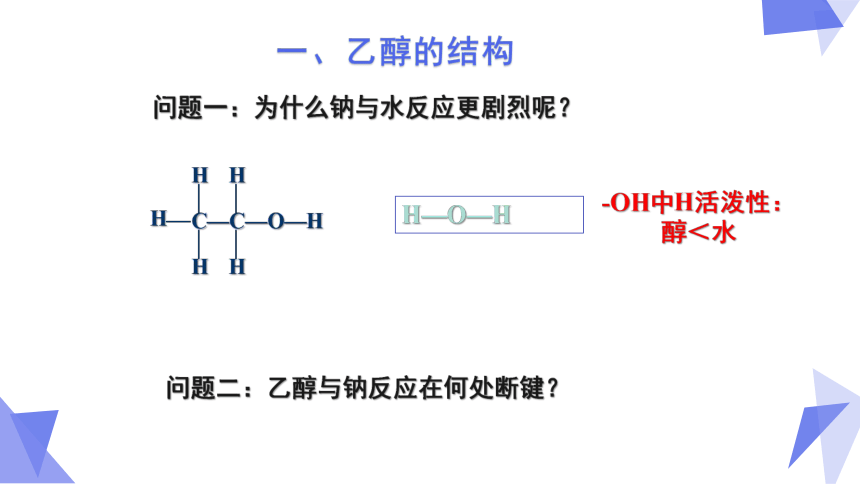
问题一:为什么钠与水反应更剧烈呢?
-OH中H活泼性:
醇<水
一、乙醇的结构
H—O—H
问题二:乙醇与钠反应在何处断键?
2
+2Na
2C2H5ONa+H2
乙醇与钠的反应:
2HO--H
+
2Na
2NaOH+H2
这两个反应各属于什么反应类型?
[问题探究]
水与钠的反应:
置换反应
置换反应、取代反应
一、乙醇的结构
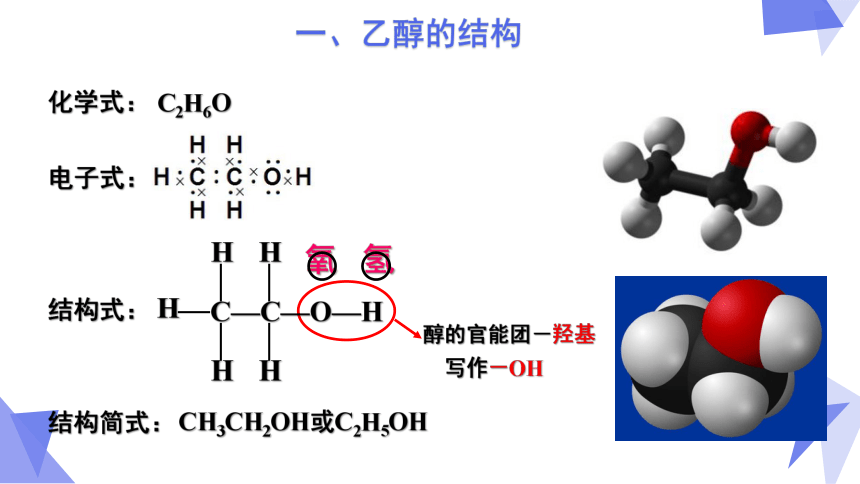
氢
氧
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH或C2H5OH
结构简式:
化学式:
C2H6O
电子式:
醇的官能团-羟基
写作-OH
一、乙醇的结构
二、乙醇的物理性质
体积分数:75%
无色、透明液体
与水以任意比例互溶
有特殊气味,易挥发
二、乙醇的物理性质
蒸馏酒
沸点78.5℃
药酒
优良的有机溶剂
应用生活
乙醛
酒量的秘密
(1)乙醇的催化氧化反应:
三、乙醇的化学性质
(1)乙醇的催化氧化反应:
[实验探究]
实验步骤
现象
①向一支试管中加入3~5mL无水乙醇。
②加热一端绕成螺旋状的铜丝至红热。
③将铜丝趁热插入乙醇中。
④反复操作几次,观察铜丝颜色和
液体气味的变化。
铜丝由红色变成黑色。
铜丝由黑色又变成红色,反复多次,可闻到刺激性气味。
三、乙醇的化学性质
黑色→红色:
红色→黑色:
△
Cu
+
H2O
+
脱去的两个氢与O结合成H2O
乙醛(刺激性气味)
醛基:-CHO
整个过程中,Cu起到了什么作用?
2C2H5OH+O2
2CH3CHO+2H2O
Cu
总反应:
【问题探究】
2Cu
+
O2
==
2CuO
△
三、乙醇的化学性质
19
19
银器、铜器表面有时会生成黑色的氧化物,可以把铜、银器具趁热蘸一下酒精,铜、银会光亮如初!
应用生活
你
来
解
决
2CO2
+3H2O
C2H5OH
+
3O2
点燃
现象:
(2)乙醇在空气中燃烧:
产生淡蓝色火焰,同时放出大量热。
(彻底氧化)
三、乙醇的化学性质
3.做消毒剂
(体积分数75%)
1.做燃料
2.制饮料
4.有机溶剂
5.化工原料
四、乙醇的用途
课堂演练
1、检验酒精中是否含有水,可采用的试剂是
(
)
A金属钠
B生石灰
C浓硫酸
D无水硫酸铜
2、金属钠可以保存在
(
)
A
煤油
B
水
C
乙醇
D
四氯化碳
3、目前市场上推出了使用乙醇汽油(在汽油中加入适量乙醇)的汽车,下列有关推广使用乙醇汽油的说法不正确的是
(
)
A.
用石油可以制得汽油
B.
用玉米、高粱发酵可以制得乙醇
C.
汽油是一种不可再生的能源
D.
乙醇汽油是一种新型化合物
D
A
D
课堂演练
4、a
g的铜丝灼烧变黑,立即放入下列物质中反应,铜丝变红且反应后铜丝质
量不变的是
(
)
A.稀H2SO4
B.C2H5OH
C.CuSO4溶液
D.CO气体
5、将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加的是
(
)
A.硝酸
B.无水乙醇
C.石灰水
D.盐酸
6、乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示。当乙醇和氧气发生催化氧化时,化学键断裂的位置是
(
)
A
2
3
B
2
4
C
1
3
D
3
4
B
C
B
酒量的秘密
在日常生活中我们都会有这样的疑问,
为什么有的人喝酒“千杯不醉”,而有的人喝一点酒后就面红耳赤,情绪激动甚至酩酊大醉?酒量的大小到底与什么有关呢?
人的酒量大小,与酒精在人体内的代谢产物和过程有很大关系。乙醇进入人体内,首先在乙醇脱氢酶的作用下氧化为乙醛,然后又在乙醛脱氢酶的作用下将乙醛氧化为乙酸,并进一步转化为CO2和H2O。如果人体内这两种脱氢酶的含量都很大的话,酒精的代谢速度就很快。但如果人体内这两种脱氢酶的含量不够大,例如缺少乙醛脱氢酶,饮酒后就会引起体内乙醛积累,导致血管扩张而脸红。
酒量的秘密
一、乙醛的物理性质
乙醛、苯、CCl4均为无色液体,如何用最简便的方法鉴别?
色态:
气味:
密度:
挥发性:
溶解性:
无色液体
有刺激性气味
比水小(0.783g/cm3)
易挥发(沸点是20.8oC)
能与水、乙醇、乙醚、氯仿等互溶
[问题探究]
-COH
二、乙醛的分子结构
分子式:
结构式:
结构简式:
官能团:
C2H4O
或CH3CHO
或-CHO
三、乙醛的化学性质
(1)与氧气的反应:
2
2
乙醛
乙酸
该反应属于加成反应吗?
[问题探究]
工业上利用此反应制取乙酸。
应用:
氧化反应与还原反应
有机物中一般不标记元素化合价,若标记则H为+1,O为-2,C取平均价,在CH3CHO,CH3COOH中C分别为-2和0价。因此由乙醛生成乙酸是氧化反应。但是,在有机化学中通常不用化合价升降来表示氧化还原反应,而是用氧氢的得失来表示。
氧化反应:
有机物去氢或得氧的反应。
还原反应:
有机物加氢或失氧的反应。
1CH3CHO+2Ag(NH3)2OH
----→
CH3COONH4+2Ag↓+3NH3+H2O
银镜反应
(2)与银氨溶液反应:
CH3CHO
+
2[Ag(NH3)2]+
+
2OH
-
水浴
银氨络离子
CH3COO-
+
NH4+
+
2Ag↓+
3NH3
+
H2O
实验后,银镜如何除去?
先加稀硝酸溶解银,再用水洗。
[问题探究]
水浴
三、乙醛的化学性质
1.试管要洁净;
2.要用水浴加热;
3.加热时不可振荡试管;
4.碱性环境
,氨水不能过量(防止生成易爆物质)。
实验成功的条件:
此反应用于醛基的检验,醛基数目的测定。
应用:
三、乙醛的化学性质
(3)与新制Cu(OH)2反应:
1CH3CHO+2Cu(OH)2+NaOH
CH3COONa+1Cu2O↓+3H2O
△
实验成功的条件:
1.碱性环境
2.新制Cu(OH)2
3.加热
砖红色
此反应也用于醛基的检验和测定。
应用:医疗上可以利用此反应原理检验病人是否患有糖尿病。
三、乙醛的化学性质
福尔马林:质量分数为35%~40%的甲醛水溶液。
(1)物性:
四、特殊的醛—甲醛(蚁醛)
无色、有强烈刺激性气味的气体,易溶于水;
d.特殊性:两个醛基
b.结构式:
c.结构简式:HCHO
a.分子式:CH2O
(2)结构:
(含氧衍生物中,唯一常温下呈气态的物质)
1HCHO+4[Ag(NH3)2]OH------→
(NH4)2CO3+4Ag↓+6NH3+2H2O
(水浴)
1HCHO+4Cu(OH)2
--→
CO2↑+2Cu2O↓
+
5H2O
△
发生氧化反应时的定量关系:
四、特殊的醛—甲醛(蚁醛)
C
O
H
H
1.我国具有悠久的酿酒历史,某白酒标签上标有53°字样,它表示( )
A.该酒是在53
℃的条件下酿制的
B.该酒的着火点为53
℃
C.100
mL该酒中含有53
mL酒精
D.100
g该酒中含有53
g酒精
练习
C
2.可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1
mol乙醇燃烧生成3
mol水
B.1
mol乙醇可以生成1
mol乙醛
C.1
mol乙醇跟足量的金属Na作用得到0.5
mol
H2
D.乙醇可以制酒精饮料
练习
C
3.某化学反应过程如图所示。由图得出的判断,错误的是(
)
A.生成物是乙醛
B.乙醇发生了还原反应
C.铜是此反应的催化剂
D.反应中有红黑颜色交替变化的现象
练习
B
第一课时
乙醇
第二单元
食品中的有机化合物
酒文化
3
甲骨文
篆书
酒文化
古往今来无数先例都证明酒是一种神奇而富有魅力的饮料,那么酒的主要成分是什么呢?
酒文化
一、乙醇的结构
已知乙醇的分子式为C2H6O,你能根据分子式判断出乙醇可能的结构式吗?
C—C—O—H
H
H
H
H
H
C—O—C—H
H
H
H
H
H
Ⅰ.
Ⅱ.
这两种结构哪种是乙醇分子的呢?如何设计实验来探究?
【问题探究】
【观察思考】
1.钠保存在什么中?
2.煤油是什么?
3.说明了什么问题?
4.钠与水反应吗?
5.钠能与Ⅰ和Ⅱ反应吗?
C12~C16的烃
C—C—O—H
H
H
H
H
H
C—O—C—H
H
H
H
H
H
Ⅰ.
Ⅱ.
H—O—H
一、乙醇的结构
2.另取一小粒钠放入盛有水的烧杯中,观察现象。
【实验探究】
一、乙醇的结构
由现象可知,乙醇的结构应该是
。
Ⅰ
1.取一小粒钠放入盛有乙醇的烧杯中,观察现象。
问题一:为什么钠与水反应更剧烈呢?
-OH中H活泼性:
醇<水
一、乙醇的结构
H—O—H
问题二:乙醇与钠反应在何处断键?
2
+2Na
2C2H5ONa+H2
乙醇与钠的反应:
2HO--H
+
2Na
2NaOH+H2
这两个反应各属于什么反应类型?
[问题探究]
水与钠的反应:
置换反应
置换反应、取代反应
一、乙醇的结构
氢
氧
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH或C2H5OH
结构简式:
化学式:
C2H6O
电子式:
醇的官能团-羟基
写作-OH
一、乙醇的结构
二、乙醇的物理性质
体积分数:75%
无色、透明液体
与水以任意比例互溶
有特殊气味,易挥发
二、乙醇的物理性质
蒸馏酒
沸点78.5℃
药酒
优良的有机溶剂
应用生活
乙醛
酒量的秘密
(1)乙醇的催化氧化反应:
三、乙醇的化学性质
(1)乙醇的催化氧化反应:
[实验探究]
实验步骤
现象
①向一支试管中加入3~5mL无水乙醇。
②加热一端绕成螺旋状的铜丝至红热。
③将铜丝趁热插入乙醇中。
④反复操作几次,观察铜丝颜色和
液体气味的变化。
铜丝由红色变成黑色。
铜丝由黑色又变成红色,反复多次,可闻到刺激性气味。
三、乙醇的化学性质
黑色→红色:
红色→黑色:
△
Cu
+
H2O
+
脱去的两个氢与O结合成H2O
乙醛(刺激性气味)
醛基:-CHO
整个过程中,Cu起到了什么作用?
2C2H5OH+O2
2CH3CHO+2H2O
Cu
总反应:
【问题探究】
2Cu
+
O2
==
2CuO
△
三、乙醇的化学性质
19
19
银器、铜器表面有时会生成黑色的氧化物,可以把铜、银器具趁热蘸一下酒精,铜、银会光亮如初!
应用生活
你
来
解
决
2CO2
+3H2O
C2H5OH
+
3O2
点燃
现象:
(2)乙醇在空气中燃烧:
产生淡蓝色火焰,同时放出大量热。
(彻底氧化)
三、乙醇的化学性质
3.做消毒剂
(体积分数75%)
1.做燃料
2.制饮料
4.有机溶剂
5.化工原料
四、乙醇的用途
课堂演练
1、检验酒精中是否含有水,可采用的试剂是
(
)
A金属钠
B生石灰
C浓硫酸
D无水硫酸铜
2、金属钠可以保存在
(
)
A
煤油
B
水
C
乙醇
D
四氯化碳
3、目前市场上推出了使用乙醇汽油(在汽油中加入适量乙醇)的汽车,下列有关推广使用乙醇汽油的说法不正确的是
(
)
A.
用石油可以制得汽油
B.
用玉米、高粱发酵可以制得乙醇
C.
汽油是一种不可再生的能源
D.
乙醇汽油是一种新型化合物
D
A
D
课堂演练
4、a
g的铜丝灼烧变黑,立即放入下列物质中反应,铜丝变红且反应后铜丝质
量不变的是
(
)
A.稀H2SO4
B.C2H5OH
C.CuSO4溶液
D.CO气体
5、将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加的是
(
)
A.硝酸
B.无水乙醇
C.石灰水
D.盐酸
6、乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示。当乙醇和氧气发生催化氧化时,化学键断裂的位置是
(
)
A
2
3
B
2
4
C
1
3
D
3
4
B
C
B
酒量的秘密
在日常生活中我们都会有这样的疑问,
为什么有的人喝酒“千杯不醉”,而有的人喝一点酒后就面红耳赤,情绪激动甚至酩酊大醉?酒量的大小到底与什么有关呢?
人的酒量大小,与酒精在人体内的代谢产物和过程有很大关系。乙醇进入人体内,首先在乙醇脱氢酶的作用下氧化为乙醛,然后又在乙醛脱氢酶的作用下将乙醛氧化为乙酸,并进一步转化为CO2和H2O。如果人体内这两种脱氢酶的含量都很大的话,酒精的代谢速度就很快。但如果人体内这两种脱氢酶的含量不够大,例如缺少乙醛脱氢酶,饮酒后就会引起体内乙醛积累,导致血管扩张而脸红。
酒量的秘密
一、乙醛的物理性质
乙醛、苯、CCl4均为无色液体,如何用最简便的方法鉴别?
色态:
气味:
密度:
挥发性:
溶解性:
无色液体
有刺激性气味
比水小(0.783g/cm3)
易挥发(沸点是20.8oC)
能与水、乙醇、乙醚、氯仿等互溶
[问题探究]
-COH
二、乙醛的分子结构
分子式:
结构式:
结构简式:
官能团:
C2H4O
或CH3CHO
或-CHO
三、乙醛的化学性质
(1)与氧气的反应:
2
2
乙醛
乙酸
该反应属于加成反应吗?
[问题探究]
工业上利用此反应制取乙酸。
应用:
氧化反应与还原反应
有机物中一般不标记元素化合价,若标记则H为+1,O为-2,C取平均价,在CH3CHO,CH3COOH中C分别为-2和0价。因此由乙醛生成乙酸是氧化反应。但是,在有机化学中通常不用化合价升降来表示氧化还原反应,而是用氧氢的得失来表示。
氧化反应:
有机物去氢或得氧的反应。
还原反应:
有机物加氢或失氧的反应。
1CH3CHO+2Ag(NH3)2OH
----→
CH3COONH4+2Ag↓+3NH3+H2O
银镜反应
(2)与银氨溶液反应:
CH3CHO
+
2[Ag(NH3)2]+
+
2OH
-
水浴
银氨络离子
CH3COO-
+
NH4+
+
2Ag↓+
3NH3
+
H2O
实验后,银镜如何除去?
先加稀硝酸溶解银,再用水洗。
[问题探究]
水浴
三、乙醛的化学性质
1.试管要洁净;
2.要用水浴加热;
3.加热时不可振荡试管;
4.碱性环境
,氨水不能过量(防止生成易爆物质)。
实验成功的条件:
此反应用于醛基的检验,醛基数目的测定。
应用:
三、乙醛的化学性质
(3)与新制Cu(OH)2反应:
1CH3CHO+2Cu(OH)2+NaOH
CH3COONa+1Cu2O↓+3H2O
△
实验成功的条件:
1.碱性环境
2.新制Cu(OH)2
3.加热
砖红色
此反应也用于醛基的检验和测定。
应用:医疗上可以利用此反应原理检验病人是否患有糖尿病。
三、乙醛的化学性质
福尔马林:质量分数为35%~40%的甲醛水溶液。
(1)物性:
四、特殊的醛—甲醛(蚁醛)
无色、有强烈刺激性气味的气体,易溶于水;
d.特殊性:两个醛基
b.结构式:
c.结构简式:HCHO
a.分子式:CH2O
(2)结构:
(含氧衍生物中,唯一常温下呈气态的物质)
1HCHO+4[Ag(NH3)2]OH------→
(NH4)2CO3+4Ag↓+6NH3+2H2O
(水浴)
1HCHO+4Cu(OH)2
--→
CO2↑+2Cu2O↓
+
5H2O
△
发生氧化反应时的定量关系:
四、特殊的醛—甲醛(蚁醛)
C
O
H
H
1.我国具有悠久的酿酒历史,某白酒标签上标有53°字样,它表示( )
A.该酒是在53
℃的条件下酿制的
B.该酒的着火点为53
℃
C.100
mL该酒中含有53
mL酒精
D.100
g该酒中含有53
g酒精
练习
C
2.可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1
mol乙醇燃烧生成3
mol水
B.1
mol乙醇可以生成1
mol乙醛
C.1
mol乙醇跟足量的金属Na作用得到0.5
mol
H2
D.乙醇可以制酒精饮料
练习
C
3.某化学反应过程如图所示。由图得出的判断,错误的是(
)
A.生成物是乙醛
B.乙醇发生了还原反应
C.铜是此反应的催化剂
D.反应中有红黑颜色交替变化的现象
练习
B
