2020届成都艺术高级中学高三下第十一周周考化学试题及答案
文档属性
| 名称 | 2020届成都艺术高级中学高三下第十一周周考化学试题及答案 |  | |
| 格式 | zip | ||
| 文件大小 | 329.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-01 21:47:38 | ||
图片预览



文档简介
2020届成都艺术高级中学高三下第十一周周考化学试题及答案
(考试时间:45分钟
满分:100分)
一、选择题:本题共8小题,每小题6分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与技术、生活密切相关。下列说法正确的是( )
A.氯气与烧碱溶液或石灰乳反应,都能得到含氯消毒剂
B.煤粉碎后更易燃烧,是因为粉碎增强了煤的还原性
C.鸡蛋煮熟后,蛋白质水解成了氨基酸
D.双氧水具有强氧化性,可用于蔗糖脱色
答案 A
解析 A.氯气与烧碱溶液或石灰乳反应,都能得到含氯消毒剂,分别是次氯酸钠和次氯酸钙,A正确;B.煤粉碎后更易燃烧,是因为粉碎增大了反应物的接触面积,还原性不变,B错误;C.鸡蛋煮熟后,蛋白质发生了变性,C错误;D.双氧水具有强氧化性,不能用于蔗糖脱色,D错误。
2.下表中根据实验操作和实验现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
某溶液W进行焰色反应实验
焰色为黄色
W一定是钠盐溶液
B
蘸有浓氨水的玻璃棒靠近溶液X
有白烟产生
X可能是浓盐酸
C
溶液Y中加入盐酸酸化的Ba(NO3)2溶液
有白色沉淀
Y中一定含有SO
D
将SO2气体通入紫色石蕊溶液中
紫色石蕊先变红,后褪色
SO2有漂白性
答案 B
解析 溶液W进行焰色反应实验,焰色为黄色,W中一定含有钠元素,W可能是氢氧化钠溶液,不一定是钠盐溶液,故A项错误;浓氨水可挥发出氨,氨与浓盐酸挥发出的氯化氢反应生成白烟氯化铵,故B项正确;加入盐酸酸化的Ba(NO3)2溶液,生成的沉淀可能是氯化银或硫酸钡,Y中可能含有Ag+、SO或SO,故C项错误;将SO2气体通入紫色石蕊溶液中,紫色石蕊变红,不褪色,故D项错误。
3.用CuS、Cu2S处理酸性废水中的Cr2O,发生反应如下:
反应Ⅰ:CuS+Cr2O+H+―→Cu2++SO+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O+H+―→Cu2++SO+Cr3++H2O(未配平)
下列有关说法正确的是( )
A.反应Ⅰ和Ⅱ中Cu2+、SO都是氧化产物
B.处理1
mol
Cr2O时反应Ⅰ、Ⅱ中消耗H+的物质的量相等
C.反应Ⅱ中还原剂、氧化剂的物质的量之比为3∶5
D.反应Ⅰ、Ⅱ中每处理1
mol
Cr2O,转移电子数不相等
答案 C
解析 反应Ⅰ:3CuS+4Cr2O+32H+===3Cu2++3SO+8Cr3++16H2O,反应Ⅱ:3Cu2S+5Cr2O+46H+===6Cu2++3SO+10Cr3++23H2O。A项,反应I中铜的化合价未变化,错误;B项,处理1
mol
Cr2O时,反应Ⅰ消耗8
mol
H+,反应Ⅱ消耗9.2
mol
H+,错误;C项,反应Ⅱ中硫化亚铜是还原剂,重铬酸根离子是氧化剂,正确;D项,反应Ⅰ、Ⅱ中每处理1
mol重铬酸根离子,均转移6
mol电子,错误。
4.下列有关有机物结构和性质的说法正确的是( )
A.丁与苯的结构相似,可由苯的性质推测丁的性质
B.乙的一氯代物有4种
C.丙在一定条件下能发生的反应类型有取代、加成、氧化、消去反应
D.甲中所有原子可能处于同一平面
答案 D
解析
A项,苯可以发生加成反应,丁不能发生加成反应,所以不能根据苯的性质推测丁的性质,A错误;B项,乙的一氯代物有2种,B错误;C项,丙不能发生消去反应,C错误;D项,甲可看作乙烯分子中的一个H原子被醛基取代的产物,乙烯、甲醛分子均是平面结构,所有原子可能共平面,D正确;
5.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族,B、C、D、E同周期,B的核外电子数为C的,D的最外层电子数为C、E之和的一半。下列说法正确的是( )
A.A、B能形成离子化合物,且A离子半径小于B离子半径
B.A、D能形成离子化合物DA5,与水反应可产生两种气体
C.C、D的简单氢化物中只有D溶于水,其水溶液呈酸性
D.E形成的两种氢化物中所有化学键种类完全相同
答案 B
解析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族,B、C、D、E同周期,B的核外电子数为C的,C的原子序数一定为偶数,可知B为第二周期元素,B为Li时,A为H,C为C,D的最外层电子数为C、E之和的一半,即5=(4+6)×,则D为N元素,E为O元素。由上述分析可知,A为H,B为Li,C为C,D为N,E为O。A与B形成的离子化合物为LiH,具有相同电子层结构的离子中,原子序数大的离子半径小,则A离子半径大于B离子半径,故A错误;A、D能形成离子化合物DA5,为NH4H,与水反应可产生两种气体为氨气与氢气,故B正确;C、D的简单氢化物中只有D溶于水,D的氢化物为氨气,其水溶液呈碱性,故C错误;E形成的两种氢化物分别为水、过氧化氢,水中只含极性键,过氧化氢含非极性键和极性键,故D错误。
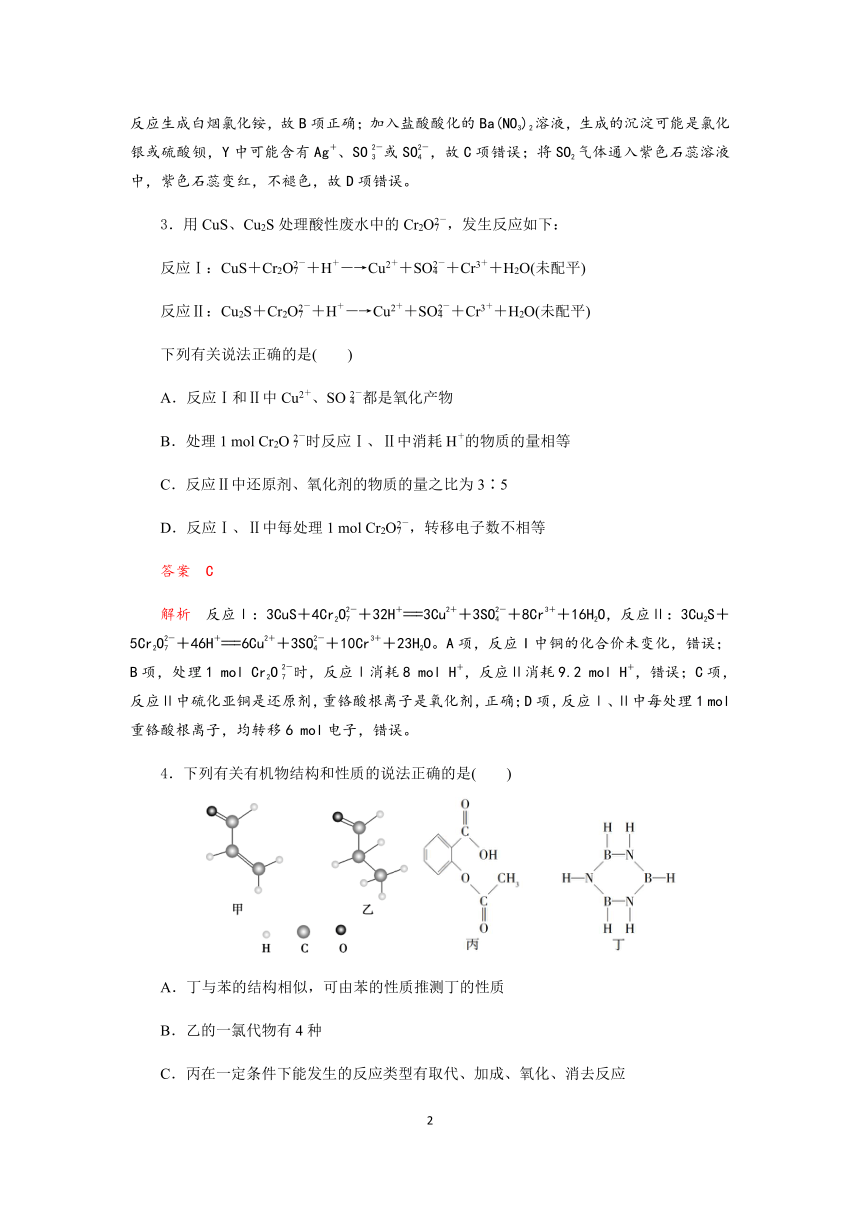
6.研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是
A.整个过程中O3作催化剂
B.反应III的方程式为O2+O=O3
C.光化学烟雾中含甲醛、乙醛等刺激性物质
D.反应I、反应Ⅱ均属于氧化还原反应
答案 A
解析 A.催化剂:反应前后质量和性质不发生改变,根据过程,O3只参与反应,没有O3的生成,因此O3不是催化剂,故A说法错误;B.根据过程,反应III:O和O2参与反应,生成O3,即反应方程式为O2+O=O3,故B说法正确;C.根据反应过程,反应Ⅱ生成甲醛和乙醛,因此光化学烟雾中含有甲醛和乙醛等刺激性物质,故C说法正确;D.反应I:O3+3NO=3NO2,存在化合价的变化,属于氧化还原反应,反应Ⅱ丙烯与O3发生反应生成甲醛和乙醛,发生氧化还原反应,故D说法正确。
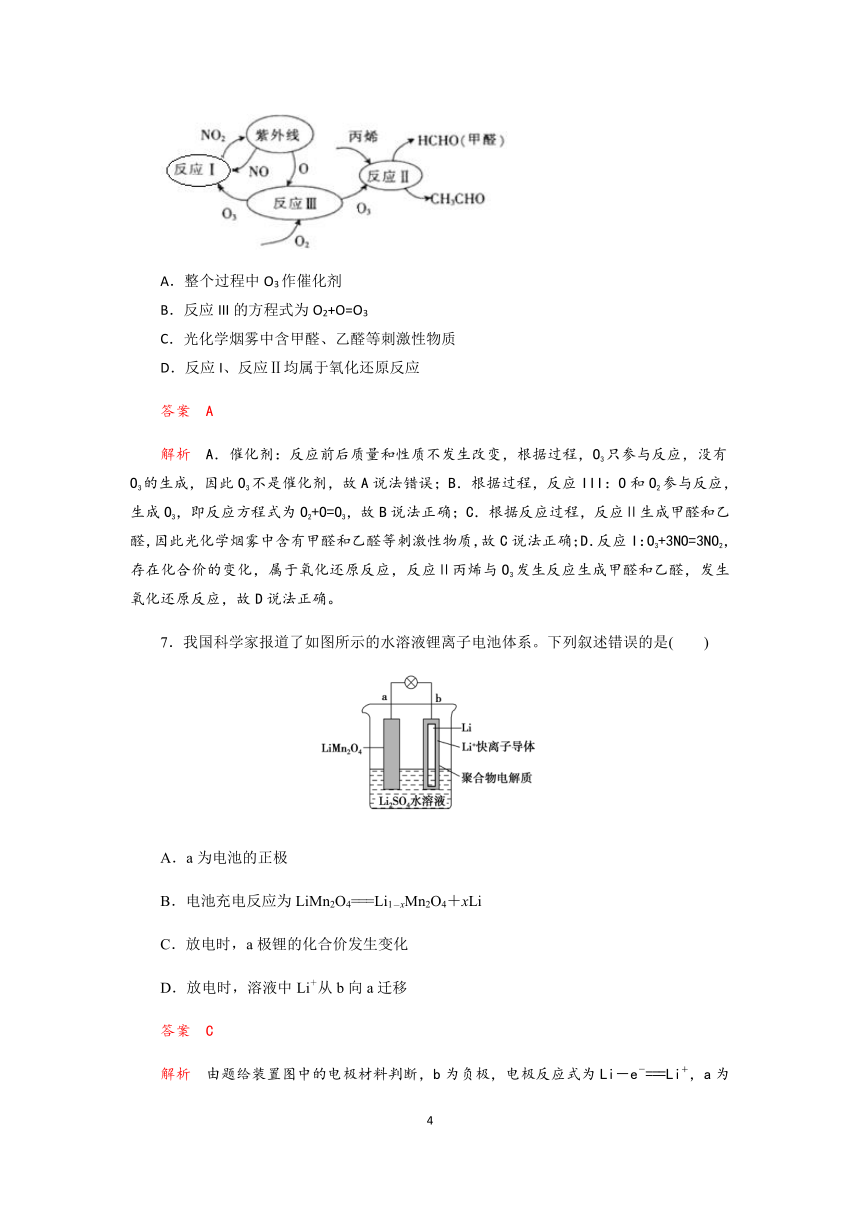
7.我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
答案 C
解析 由题给装置图中的电极材料判断,b为负极,电极反应式为Li-e-===Li+,a为正极,电极反应式为Li1-xMn2O4+xLi++xe-===LiMn2O4,原电池总反应为Li1-xMn2O4+xLi===LiMn2O4。A项,由以上分析,a为电池的正极,正确;B项,原电池充电时为电解池,其充电反应与放电反应相反,故充电反应为LiMn2O4===Li1-xMn2O4+xLi,正确;C项,放电时,a极Mn的化合价降低,发生还原反应,而锂的化合价不变化,错误;D项,放电时,溶液中Li+由负极移向正极(a极),正确。
8.常温下,用0.10
mol/L的NaOH溶液滴定0.10
mol/L的HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是( )
A.Ka(HA)的数量级为10-5
B.N点,c(Na+)-c(A-)=
C.P→Q过程中,水的电离程度逐渐增大
D.当滴定至溶液呈中性时,c(A-)>c(HA)
答案 B
解析 A项,根据图a可知,中和百分数为50%时溶液的pH=4.74,此时溶液为等物质的量浓度的NaA和HA的混合溶液,由于A-的水解和HA的电离都是微弱的,可以认为c(A-)≈c(HA),Ka(HA)==c(H+)=10-4.74,Ka(HA)的数量级为10-5,正确;B项,N点,根据电荷守恒有c(Na+)+c(H+)=c(A-)+c(OH-),即c(Na+)-c(A-)=c(OH-)-c(H+)=-1×10-8.72,错误;C项,P→Q过程中,随着氢氧化钠溶液的滴入,酸不断消耗,溶液的酸性逐渐减弱,水的电离程度逐渐增大,正确;D项,根据图b可知,当lg=0时,溶液呈酸性,则当滴定至溶液呈中性时,溶液中c(A-)>c(HA),正确。
二、非选择题:本题包括3个小题,共52分。
9.(16分)连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4在潮湿空气中被氧化,生成的两种常见酸式盐是_____________(填化学式)。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
①工业上常将锌块进行预处理得到锌粉?水悬浊液,其目的是___________________。
②步骤Ⅰ中发生反应的化学方程式为________________________________________。
③步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是_____________________,“后续处理”最终要加入少量Na2CO3固体,其原因是_________________________________。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2使之发生反应,有CO2气体放出,总反应的离子方程式是________________________________________________________________________。
(4)有人设计了如图方法同时制备连二亚硫酸钠和过二硫酸钠(Na2S2O8)。电解过程中,阴极室生成Na2S2O4,a极的电极反应式为________________,通过阳离子交换膜的离子主要是Na+,其迁移方向是________________________(填“由左侧向右侧移动”或“由右侧向左侧移动”)。
解析
(1)根据硫的含氧酸有亚硫酸和硫酸,再根据氧化还原反应的化学合价升降法可知,Na2S2O4在潮湿空气中被氧化生成的两种常见酸式盐为NaHSO3和NaHSO4。
(2)①将锌块进行预处理得到锌粉?水悬浊液,目的是增大锌粒的表面积,加快化学反应速率。②步骤Ⅰ中Zn与SO2反应生成ZnS2O4,化学方程式为Zn+2SO2===ZnS2O4。③根据Na2S2O4易溶于水,难溶于乙醇可知,步骤Ⅲ中得到的Na2S2O4固体用乙醇洗涤,可以减少Na2S2O4的溶解损失,且易于干燥。根据Na2S2O4在碱性介质中较稳定,在空气中易被氧化可知,“后续处理”最终要加入少量Na2CO3固体,其原因是Na2CO3为碱性物质,“保险粉”在碱性介质中较稳定。(3)根据HCOONa→CO2,C从+2价升为+4价,失2e-,SO2→S2O,硫从+4价降为+3价,1个SO2得1个e-,根据得失电子守恒可知,HCOO-和SO2的化学计量数之比为1∶2,再根据电荷守恒和原子守恒配平离子方程式为HCOO-+OH-+2SO2===S2O+CO2+H2O。(4)a极为阳极,SO发生氧化反应转化为S2O,电极反应式为2SO-2e-===S2O。电解时阳离子向阴极移动,故Na+由左侧向右侧移动。
答案
(1)NaHSO3和NaHSO4
(2)①增大锌粒的表面积,加快化学反应速率 ②Zn+2SO2===ZnS2O4 ③减少Na2S2O4的溶解损失,易于干燥 Na2CO3为碱性物质,“保险粉”在碱性介质中较稳定
(3)HCOO-+OH-+2SO2===S2O+CO2+H2O
(4)2SO-2e-===S2O 由左侧向右侧移动
10.(18分)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5
℃,沸点为11.0
℃,极易溶于水,不与水反应。温度过高,二氧化氯的水溶液可能爆炸。某研究性学习小组拟用如图所示装置制取并收集ClO2(加热和夹持装置均省略)。
(1)在圆底烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,在60~80
℃之间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为________________________________________________________________________。
(2)A装置中使用温度计的目的是____________________________。
反应开始后,可以观察到圆底烧瓶内的现象是_______________________________。
(3)B装置的作用是____________________________________________。
(4)D装置中的NaOH溶液吸收尾气中的ClO2,生成物质的量之比为1∶1的两种盐,一种为NaClO2,另一种为________。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10
mL,稀释成100
mL试样,量取V1
mL试样加入锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用c
mol·L-1
Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2
mL。
已知:2ClO2+8H++10I-===5I2+2Cl-+4H2O
2Na2S2O3+I2===Na2S4O6+2NaI
指示剂X为________________。原ClO2溶液的浓度为____________g·L-1(用含字母的代数式表示)。
(6)有同学认为KClO3在酸性条件下与草酸反应会生成KCl。请设计实验验证A装置反应后的溶液中是否存在Cl-,简要写出所需试剂、实验操作、现象和结论(已知AgClO3可溶于水):____________________________________________________________。
解析
(1)根据题干信息可知,生成的硫酸盐是硫酸钾,根据原子守恒、得失电子守恒配平化学方程式:2KClO3+H2C2O4+H2SO4K2SO4+2ClO2↑+2H2O+2CO2↑。(2)温度过高,二氧化氯的水溶液可能爆炸,且该反应在60~80
℃之间进行,因此A装置中温度计的作用是控制温度,防止温度过高引起爆炸。ClO2是黄绿色气体,因此反应开始后,可观察到烧瓶内的现象是溶液中有气泡逸出,产生黄绿色气体。(3)ClO2的熔点为-59.5
℃,沸点为11.0
℃,因此B装置的作用是冷凝并收集ClO2。(4)ClO2中Cl为+4价,NaClO2中Cl为+3价,此反应是氧化还原反应。设另一种盐中Cl的化合价为x,生成两种盐的物质的量之比为1∶1,根据得失电子守恒可知,1×1=1×(x-4),解得x=+5,因此另一种盐为NaClO3。(5)因为淀粉遇碘单质变蓝,因此选用的指示剂为淀粉。根据两个化学方程式建立关系式:2ClO2~5I2~10Na2S2O3,因此原ClO2溶液的浓度为
g·L-1=
g·L-1。(6)由于氯酸钾与草酸反应的酸性环境是硫酸提供的,因此检验Cl-时,应先除去SO,具体操作是取少量A装置反应后的溶液于试管中,加入足量硝酸钡溶液,充分反应后静置,取上层清液于另一试管中,加入硝酸酸化的硝酸银溶液,观察是否有白色沉淀产生。若有,则存在Cl-;若无,则不存在Cl-。
答案
(1)2KClO3+H2C2O4+H2SO4K2SO4+2ClO2↑+2H2O+2CO2↑
(2)控制温度,避免温度过高引起爆炸 溶液中有气泡逸出,产生黄绿色气体
(3)冷凝并收集ClO2 (4)NaClO3
(5)淀粉
(6)取少量A装置反应后的溶液于试管中,加入足量Ba(NO3)2溶液,充分反应后静置,取上层清液于另一试管中,加入硝酸酸化的硝酸银溶液,观察是否有白色沉淀产生。若有,则存在Cl-;若无,则不存在Cl-
11.(18分)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH1=+180.5
kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH2=-393.5
kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH3=-221
kJ·mol-1
若某反应的平衡常数表达式为K=,则此反应的热化学方程式为________________________________________________________________________。
(2)N2O5在一定条件下可发生分解反应:2N2O5(g)4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min
0
1
2
3
4
5
c(N2O5)/(mol·L-1)
1.00
0.71
0.50
0.35
0.25
0.17
①反应开始时体系压强为p0,第2
min时体系压强为p1,则p1∶p0=________。2~5
min内用NO2表示的该反应的平均反应速率为________________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________________(填字母)。
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200
℃、400
℃、600
℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是________。
②M点对应的H2的转化率是________。
(5)工业生产中产生的SO2废气可用如图方法获得H2SO4。写出电解的阳极反应式:________________________________________________________________________。
解析
(1)若某反应的平衡常数表达式为K=,则其化学方程式为2NO(g)+2CO(g)===N2(g)+2CO2(g),将题中3个已知热化学方程式依次编号为①②③,根据盖斯定律,由②×2-①-③,可得:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=(-393.5
kJ·mol-1)×2-(+180.5
kJ·mol-1)-(-221
kJ·mol-1)=-746.5
kJ·mol-1。(2)①根据题表中数据及三段式法有:
2N2O5(g)4NO2(g)+O2(g)
开始/(mol·L-1)
1.00
0
0
转化/(mol·L-1)
0.50
1.00
0.25
2
min时/(mol·L-1)0.50
1.00
0.25
该反应在恒温恒容条件下发生,反应前后气体的压强之比等于物质的量之比,也等于物质的量浓度之比,所以p1∶p0=(0.50+1.00+0.25)∶1.00=7∶4。2~5
min内,v(N2O5)==0.11
mol·L-1·min-1,v(NO2)=2v(N2O5)=0.22
mol·L-1·min-1。②反应过程中NO2和O2的浓度比始终保持不变,a项不能说明反应已经达到化学平衡状态;该反应在反应前后气体分子数不相等,反应过程中容器内压强为变量,容器内压强不再变化可以说明反应已经达到化学平衡状态,b项符合题意;v正(NO2)=2v逆(N2O5)时,正、逆反应速率相等,而2v正(NO2)=v逆(N2O5)时,正、逆反应速率不相等,c项不能说明反应已经达到化学平衡状态;反应物和生成物全为气体,气体总质量不变,而容器恒容,故反应过程中气体密度始终不变,d项不能说明反应已经达到化学平衡状态。(3)Kp=,v正=k正·p(NO2)·p(CO),v逆=k逆·p(NO)·p(CO2),平衡时正、逆反应速率相等,即k正·p(NO2)·p(CO)=k逆·p(NO)·p(CO2),则=,故Kp=。(4)①合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,NH3的产率降低,NH3的物质的量分数减小,曲线a、b、c中,在相同条件下曲线a对应NH3的物质的量分数最高,其反应温度最低,所以曲线a对应的温度为200
℃。②M点NH3的物质的量分数为60%,设NH3为0.6a
mol,则N2、H2共为0.4a
mol,因为反应器中按n(N2)∶n(H2)=1∶3投料,故M点时H2为0.3a
mol,结合N2(g)+3H2(g)2NH3(g)可知,转化的H2的物质的量为0.9a
mol,所以M点对应H2的转化率为×100%=75%。(5)由题图可知,在电解池的阳极发生Mn2+转化为MnO2的反应,电极反应式为Mn2++2H2O-2e-===MnO2↓+4H+。
答案
(1)2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5
kJ·mol-1
(2)①7∶4 0.22
mol·L-1·min-1 ②b
(3)
(4)①200
℃ ②75%
(5)Mn2++2H2O-2e-===MnO2↓+4H+
(考试时间:45分钟
满分:100分)
一、选择题:本题共8小题,每小题6分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与技术、生活密切相关。下列说法正确的是( )
A.氯气与烧碱溶液或石灰乳反应,都能得到含氯消毒剂
B.煤粉碎后更易燃烧,是因为粉碎增强了煤的还原性
C.鸡蛋煮熟后,蛋白质水解成了氨基酸
D.双氧水具有强氧化性,可用于蔗糖脱色
答案 A
解析 A.氯气与烧碱溶液或石灰乳反应,都能得到含氯消毒剂,分别是次氯酸钠和次氯酸钙,A正确;B.煤粉碎后更易燃烧,是因为粉碎增大了反应物的接触面积,还原性不变,B错误;C.鸡蛋煮熟后,蛋白质发生了变性,C错误;D.双氧水具有强氧化性,不能用于蔗糖脱色,D错误。
2.下表中根据实验操作和实验现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
某溶液W进行焰色反应实验
焰色为黄色
W一定是钠盐溶液
B
蘸有浓氨水的玻璃棒靠近溶液X
有白烟产生
X可能是浓盐酸
C
溶液Y中加入盐酸酸化的Ba(NO3)2溶液
有白色沉淀
Y中一定含有SO
D
将SO2气体通入紫色石蕊溶液中
紫色石蕊先变红,后褪色
SO2有漂白性
答案 B
解析 溶液W进行焰色反应实验,焰色为黄色,W中一定含有钠元素,W可能是氢氧化钠溶液,不一定是钠盐溶液,故A项错误;浓氨水可挥发出氨,氨与浓盐酸挥发出的氯化氢反应生成白烟氯化铵,故B项正确;加入盐酸酸化的Ba(NO3)2溶液,生成的沉淀可能是氯化银或硫酸钡,Y中可能含有Ag+、SO或SO,故C项错误;将SO2气体通入紫色石蕊溶液中,紫色石蕊变红,不褪色,故D项错误。
3.用CuS、Cu2S处理酸性废水中的Cr2O,发生反应如下:
反应Ⅰ:CuS+Cr2O+H+―→Cu2++SO+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O+H+―→Cu2++SO+Cr3++H2O(未配平)
下列有关说法正确的是( )
A.反应Ⅰ和Ⅱ中Cu2+、SO都是氧化产物
B.处理1
mol
Cr2O时反应Ⅰ、Ⅱ中消耗H+的物质的量相等
C.反应Ⅱ中还原剂、氧化剂的物质的量之比为3∶5
D.反应Ⅰ、Ⅱ中每处理1
mol
Cr2O,转移电子数不相等
答案 C
解析 反应Ⅰ:3CuS+4Cr2O+32H+===3Cu2++3SO+8Cr3++16H2O,反应Ⅱ:3Cu2S+5Cr2O+46H+===6Cu2++3SO+10Cr3++23H2O。A项,反应I中铜的化合价未变化,错误;B项,处理1
mol
Cr2O时,反应Ⅰ消耗8
mol
H+,反应Ⅱ消耗9.2
mol
H+,错误;C项,反应Ⅱ中硫化亚铜是还原剂,重铬酸根离子是氧化剂,正确;D项,反应Ⅰ、Ⅱ中每处理1
mol重铬酸根离子,均转移6
mol电子,错误。
4.下列有关有机物结构和性质的说法正确的是( )
A.丁与苯的结构相似,可由苯的性质推测丁的性质
B.乙的一氯代物有4种
C.丙在一定条件下能发生的反应类型有取代、加成、氧化、消去反应
D.甲中所有原子可能处于同一平面
答案 D
解析
A项,苯可以发生加成反应,丁不能发生加成反应,所以不能根据苯的性质推测丁的性质,A错误;B项,乙的一氯代物有2种,B错误;C项,丙不能发生消去反应,C错误;D项,甲可看作乙烯分子中的一个H原子被醛基取代的产物,乙烯、甲醛分子均是平面结构,所有原子可能共平面,D正确;
5.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族,B、C、D、E同周期,B的核外电子数为C的,D的最外层电子数为C、E之和的一半。下列说法正确的是( )
A.A、B能形成离子化合物,且A离子半径小于B离子半径
B.A、D能形成离子化合物DA5,与水反应可产生两种气体
C.C、D的简单氢化物中只有D溶于水,其水溶液呈酸性
D.E形成的两种氢化物中所有化学键种类完全相同
答案 B
解析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族,B、C、D、E同周期,B的核外电子数为C的,C的原子序数一定为偶数,可知B为第二周期元素,B为Li时,A为H,C为C,D的最外层电子数为C、E之和的一半,即5=(4+6)×,则D为N元素,E为O元素。由上述分析可知,A为H,B为Li,C为C,D为N,E为O。A与B形成的离子化合物为LiH,具有相同电子层结构的离子中,原子序数大的离子半径小,则A离子半径大于B离子半径,故A错误;A、D能形成离子化合物DA5,为NH4H,与水反应可产生两种气体为氨气与氢气,故B正确;C、D的简单氢化物中只有D溶于水,D的氢化物为氨气,其水溶液呈碱性,故C错误;E形成的两种氢化物分别为水、过氧化氢,水中只含极性键,过氧化氢含非极性键和极性键,故D错误。
6.研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是
A.整个过程中O3作催化剂
B.反应III的方程式为O2+O=O3
C.光化学烟雾中含甲醛、乙醛等刺激性物质
D.反应I、反应Ⅱ均属于氧化还原反应
答案 A
解析 A.催化剂:反应前后质量和性质不发生改变,根据过程,O3只参与反应,没有O3的生成,因此O3不是催化剂,故A说法错误;B.根据过程,反应III:O和O2参与反应,生成O3,即反应方程式为O2+O=O3,故B说法正确;C.根据反应过程,反应Ⅱ生成甲醛和乙醛,因此光化学烟雾中含有甲醛和乙醛等刺激性物质,故C说法正确;D.反应I:O3+3NO=3NO2,存在化合价的变化,属于氧化还原反应,反应Ⅱ丙烯与O3发生反应生成甲醛和乙醛,发生氧化还原反应,故D说法正确。
7.我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
答案 C
解析 由题给装置图中的电极材料判断,b为负极,电极反应式为Li-e-===Li+,a为正极,电极反应式为Li1-xMn2O4+xLi++xe-===LiMn2O4,原电池总反应为Li1-xMn2O4+xLi===LiMn2O4。A项,由以上分析,a为电池的正极,正确;B项,原电池充电时为电解池,其充电反应与放电反应相反,故充电反应为LiMn2O4===Li1-xMn2O4+xLi,正确;C项,放电时,a极Mn的化合价降低,发生还原反应,而锂的化合价不变化,错误;D项,放电时,溶液中Li+由负极移向正极(a极),正确。
8.常温下,用0.10
mol/L的NaOH溶液滴定0.10
mol/L的HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是( )
A.Ka(HA)的数量级为10-5
B.N点,c(Na+)-c(A-)=
C.P→Q过程中,水的电离程度逐渐增大
D.当滴定至溶液呈中性时,c(A-)>c(HA)
答案 B
解析 A项,根据图a可知,中和百分数为50%时溶液的pH=4.74,此时溶液为等物质的量浓度的NaA和HA的混合溶液,由于A-的水解和HA的电离都是微弱的,可以认为c(A-)≈c(HA),Ka(HA)==c(H+)=10-4.74,Ka(HA)的数量级为10-5,正确;B项,N点,根据电荷守恒有c(Na+)+c(H+)=c(A-)+c(OH-),即c(Na+)-c(A-)=c(OH-)-c(H+)=-1×10-8.72,错误;C项,P→Q过程中,随着氢氧化钠溶液的滴入,酸不断消耗,溶液的酸性逐渐减弱,水的电离程度逐渐增大,正确;D项,根据图b可知,当lg=0时,溶液呈酸性,则当滴定至溶液呈中性时,溶液中c(A-)>c(HA),正确。
二、非选择题:本题包括3个小题,共52分。
9.(16分)连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4在潮湿空气中被氧化,生成的两种常见酸式盐是_____________(填化学式)。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
①工业上常将锌块进行预处理得到锌粉?水悬浊液,其目的是___________________。
②步骤Ⅰ中发生反应的化学方程式为________________________________________。
③步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是_____________________,“后续处理”最终要加入少量Na2CO3固体,其原因是_________________________________。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2使之发生反应,有CO2气体放出,总反应的离子方程式是________________________________________________________________________。
(4)有人设计了如图方法同时制备连二亚硫酸钠和过二硫酸钠(Na2S2O8)。电解过程中,阴极室生成Na2S2O4,a极的电极反应式为________________,通过阳离子交换膜的离子主要是Na+,其迁移方向是________________________(填“由左侧向右侧移动”或“由右侧向左侧移动”)。
解析
(1)根据硫的含氧酸有亚硫酸和硫酸,再根据氧化还原反应的化学合价升降法可知,Na2S2O4在潮湿空气中被氧化生成的两种常见酸式盐为NaHSO3和NaHSO4。
(2)①将锌块进行预处理得到锌粉?水悬浊液,目的是增大锌粒的表面积,加快化学反应速率。②步骤Ⅰ中Zn与SO2反应生成ZnS2O4,化学方程式为Zn+2SO2===ZnS2O4。③根据Na2S2O4易溶于水,难溶于乙醇可知,步骤Ⅲ中得到的Na2S2O4固体用乙醇洗涤,可以减少Na2S2O4的溶解损失,且易于干燥。根据Na2S2O4在碱性介质中较稳定,在空气中易被氧化可知,“后续处理”最终要加入少量Na2CO3固体,其原因是Na2CO3为碱性物质,“保险粉”在碱性介质中较稳定。(3)根据HCOONa→CO2,C从+2价升为+4价,失2e-,SO2→S2O,硫从+4价降为+3价,1个SO2得1个e-,根据得失电子守恒可知,HCOO-和SO2的化学计量数之比为1∶2,再根据电荷守恒和原子守恒配平离子方程式为HCOO-+OH-+2SO2===S2O+CO2+H2O。(4)a极为阳极,SO发生氧化反应转化为S2O,电极反应式为2SO-2e-===S2O。电解时阳离子向阴极移动,故Na+由左侧向右侧移动。
答案
(1)NaHSO3和NaHSO4
(2)①增大锌粒的表面积,加快化学反应速率 ②Zn+2SO2===ZnS2O4 ③减少Na2S2O4的溶解损失,易于干燥 Na2CO3为碱性物质,“保险粉”在碱性介质中较稳定
(3)HCOO-+OH-+2SO2===S2O+CO2+H2O
(4)2SO-2e-===S2O 由左侧向右侧移动
10.(18分)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5
℃,沸点为11.0
℃,极易溶于水,不与水反应。温度过高,二氧化氯的水溶液可能爆炸。某研究性学习小组拟用如图所示装置制取并收集ClO2(加热和夹持装置均省略)。
(1)在圆底烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,在60~80
℃之间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为________________________________________________________________________。
(2)A装置中使用温度计的目的是____________________________。
反应开始后,可以观察到圆底烧瓶内的现象是_______________________________。
(3)B装置的作用是____________________________________________。
(4)D装置中的NaOH溶液吸收尾气中的ClO2,生成物质的量之比为1∶1的两种盐,一种为NaClO2,另一种为________。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10
mL,稀释成100
mL试样,量取V1
mL试样加入锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用c
mol·L-1
Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2
mL。
已知:2ClO2+8H++10I-===5I2+2Cl-+4H2O
2Na2S2O3+I2===Na2S4O6+2NaI
指示剂X为________________。原ClO2溶液的浓度为____________g·L-1(用含字母的代数式表示)。
(6)有同学认为KClO3在酸性条件下与草酸反应会生成KCl。请设计实验验证A装置反应后的溶液中是否存在Cl-,简要写出所需试剂、实验操作、现象和结论(已知AgClO3可溶于水):____________________________________________________________。
解析
(1)根据题干信息可知,生成的硫酸盐是硫酸钾,根据原子守恒、得失电子守恒配平化学方程式:2KClO3+H2C2O4+H2SO4K2SO4+2ClO2↑+2H2O+2CO2↑。(2)温度过高,二氧化氯的水溶液可能爆炸,且该反应在60~80
℃之间进行,因此A装置中温度计的作用是控制温度,防止温度过高引起爆炸。ClO2是黄绿色气体,因此反应开始后,可观察到烧瓶内的现象是溶液中有气泡逸出,产生黄绿色气体。(3)ClO2的熔点为-59.5
℃,沸点为11.0
℃,因此B装置的作用是冷凝并收集ClO2。(4)ClO2中Cl为+4价,NaClO2中Cl为+3价,此反应是氧化还原反应。设另一种盐中Cl的化合价为x,生成两种盐的物质的量之比为1∶1,根据得失电子守恒可知,1×1=1×(x-4),解得x=+5,因此另一种盐为NaClO3。(5)因为淀粉遇碘单质变蓝,因此选用的指示剂为淀粉。根据两个化学方程式建立关系式:2ClO2~5I2~10Na2S2O3,因此原ClO2溶液的浓度为
g·L-1=
g·L-1。(6)由于氯酸钾与草酸反应的酸性环境是硫酸提供的,因此检验Cl-时,应先除去SO,具体操作是取少量A装置反应后的溶液于试管中,加入足量硝酸钡溶液,充分反应后静置,取上层清液于另一试管中,加入硝酸酸化的硝酸银溶液,观察是否有白色沉淀产生。若有,则存在Cl-;若无,则不存在Cl-。
答案
(1)2KClO3+H2C2O4+H2SO4K2SO4+2ClO2↑+2H2O+2CO2↑
(2)控制温度,避免温度过高引起爆炸 溶液中有气泡逸出,产生黄绿色气体
(3)冷凝并收集ClO2 (4)NaClO3
(5)淀粉
(6)取少量A装置反应后的溶液于试管中,加入足量Ba(NO3)2溶液,充分反应后静置,取上层清液于另一试管中,加入硝酸酸化的硝酸银溶液,观察是否有白色沉淀产生。若有,则存在Cl-;若无,则不存在Cl-
11.(18分)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH1=+180.5
kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH2=-393.5
kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH3=-221
kJ·mol-1
若某反应的平衡常数表达式为K=,则此反应的热化学方程式为________________________________________________________________________。
(2)N2O5在一定条件下可发生分解反应:2N2O5(g)4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min
0
1
2
3
4
5
c(N2O5)/(mol·L-1)
1.00
0.71
0.50
0.35
0.25
0.17
①反应开始时体系压强为p0,第2
min时体系压强为p1,则p1∶p0=________。2~5
min内用NO2表示的该反应的平均反应速率为________________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________________(填字母)。
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200
℃、400
℃、600
℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是________。
②M点对应的H2的转化率是________。
(5)工业生产中产生的SO2废气可用如图方法获得H2SO4。写出电解的阳极反应式:________________________________________________________________________。
解析
(1)若某反应的平衡常数表达式为K=,则其化学方程式为2NO(g)+2CO(g)===N2(g)+2CO2(g),将题中3个已知热化学方程式依次编号为①②③,根据盖斯定律,由②×2-①-③,可得:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=(-393.5
kJ·mol-1)×2-(+180.5
kJ·mol-1)-(-221
kJ·mol-1)=-746.5
kJ·mol-1。(2)①根据题表中数据及三段式法有:
2N2O5(g)4NO2(g)+O2(g)
开始/(mol·L-1)
1.00
0
0
转化/(mol·L-1)
0.50
1.00
0.25
2
min时/(mol·L-1)0.50
1.00
0.25
该反应在恒温恒容条件下发生,反应前后气体的压强之比等于物质的量之比,也等于物质的量浓度之比,所以p1∶p0=(0.50+1.00+0.25)∶1.00=7∶4。2~5
min内,v(N2O5)==0.11
mol·L-1·min-1,v(NO2)=2v(N2O5)=0.22
mol·L-1·min-1。②反应过程中NO2和O2的浓度比始终保持不变,a项不能说明反应已经达到化学平衡状态;该反应在反应前后气体分子数不相等,反应过程中容器内压强为变量,容器内压强不再变化可以说明反应已经达到化学平衡状态,b项符合题意;v正(NO2)=2v逆(N2O5)时,正、逆反应速率相等,而2v正(NO2)=v逆(N2O5)时,正、逆反应速率不相等,c项不能说明反应已经达到化学平衡状态;反应物和生成物全为气体,气体总质量不变,而容器恒容,故反应过程中气体密度始终不变,d项不能说明反应已经达到化学平衡状态。(3)Kp=,v正=k正·p(NO2)·p(CO),v逆=k逆·p(NO)·p(CO2),平衡时正、逆反应速率相等,即k正·p(NO2)·p(CO)=k逆·p(NO)·p(CO2),则=,故Kp=。(4)①合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,NH3的产率降低,NH3的物质的量分数减小,曲线a、b、c中,在相同条件下曲线a对应NH3的物质的量分数最高,其反应温度最低,所以曲线a对应的温度为200
℃。②M点NH3的物质的量分数为60%,设NH3为0.6a
mol,则N2、H2共为0.4a
mol,因为反应器中按n(N2)∶n(H2)=1∶3投料,故M点时H2为0.3a
mol,结合N2(g)+3H2(g)2NH3(g)可知,转化的H2的物质的量为0.9a
mol,所以M点对应H2的转化率为×100%=75%。(5)由题图可知,在电解池的阳极发生Mn2+转化为MnO2的反应,电极反应式为Mn2++2H2O-2e-===MnO2↓+4H+。
答案
(1)2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5
kJ·mol-1
(2)①7∶4 0.22
mol·L-1·min-1 ②b
(3)
(4)①200
℃ ②75%
(5)Mn2++2H2O-2e-===MnO2↓+4H+
同课章节目录
