苏教版高中化学2必修二1.2.3分子间作用力 课件(共19张PPT)
文档属性
| 名称 | 苏教版高中化学2必修二1.2.3分子间作用力 课件(共19张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-01 22:33:02 | ||
图片预览





文档简介
(共19张PPT)
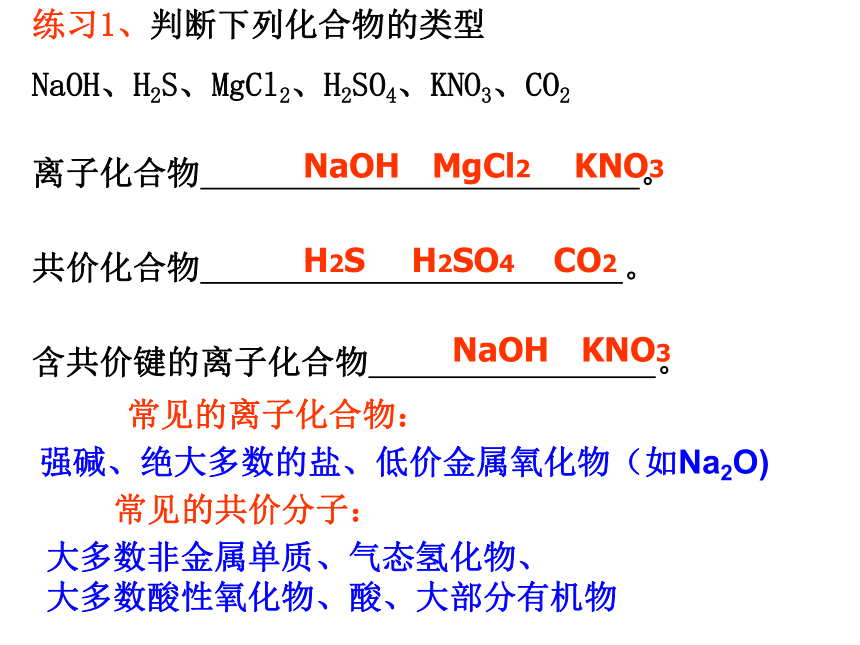
练习1、判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
。
共价化合物
。
含共价键的离子化合物
。
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
常见的离子化合物:
强碱、绝大多数的盐、低价金属氧化物(如Na2O)
常见的共价分子:
大多数非金属单质、气态氢化物、
大多数酸性氧化物、酸、大部分有机物
苏教版高中化学必修二
1.2.3
分子间作用力和氢键
思考:冰熔化、气化现象是什么变化?
化学键破坏了吗?
为什么要吸收热量?
化学键
(强烈)
分子间作用力(较弱)
汽化
破坏分子间作用力
化学键
(强烈)
电解
一、分子间作用力
(1)存在:分子之间
1.概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力。
(2)强弱:比化学键弱
分子间作用力(较弱)
化学键
(强烈)
原子或离子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
125--836KJ/mol
2--20KJ/mol
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么?
1.为什么NaCl在熔化状态或水溶液中具有导电性,而液
态氯化氢却不具有导电性。
破坏了离子键,形成自由移动的阴阳离子
原子间以共价键结合,分子间存在分子间作用力
作用微粒
作用力强弱
大小范围
化学键
分子间作用力(范德华力)
分子间的作用力强弱(范德华力)
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
一、分子间作用力
(1)存在:分子之间
1.概念:分子间存在的将分子聚集在一起的作用力称
为分子间作用力,又称为范德华力。
(2)强弱:比化学键弱
(3)主要影响物质的物理性质(熔沸点和溶解度)
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
1、将干冰气化,破坏了CO2分子晶体的
.
2、将CO2气体溶于水,破坏了CO2分子的
.
分子间作用力
共价键
4.请预测的熔沸点高低
(1)HF、HCl、HBr、HI
(2)H2O、
H2S
、H2Se、
H2Te
(3)NH3、PH3、AsH3、SbH3
事实真的是这样吗?
3、下列物质变化时,需克服的作用力不属于化学键的是(
)
A
、HCl溶于水
B
、
I2升华
C
、
H2O电解
D、
烧碱熔化
B
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
H2O
H2S
H2Se
H2Te
HF
HCl
HBr
HI
沸点如何变化?
违反常规?
二、氢键
1.氢键是一种特殊的分子间作用力,不是化学键
2.强弱:比化学键弱而比分子间作用力强
氢键
化学键
介于化学键与分子间作用力
二、氢键
3.氢键的表示方法:X—H…Y
X、Y可以相同,也可以不同(主要F、O、N)。
虚线:氢键
实线:共价键
4、氢键对物质性质的影响
⑴分子间氢键的存在使物质的熔沸点相对较高
(如HF、H2O、NH3)
(3)解释一些反常现象:
如水结成冰时,为什么体积会膨胀,密度减小,浮在水面上?
(2)氢键的形成使某些物质在水中的溶解度增大
(如极易NH3溶于水)
在固态水(冰)中,水分子间大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
相邻的原子间强
烈的相互作用
把分子聚集在一起的作用力
分子内原子间
分子之间
较
强
与化学键相比弱的多
主要影响化学性质
主要影响物理性质(如熔沸点)
三、化学键与分子间作用力的比较
某些物质的
分子间
分子之间
介于化学键与
分子间作用力
主要影响物理性质(如熔沸点)
化学键
氢键
分子间作用力
概念
作用范围
作用力强弱
影响的性质
1、下列各组物质汽化或熔化时,所克服的粒子间的作用(力)属同种类型的是(
)
A、碘和干冰的升华
B、二氧化硅和生石灰的熔化
C、氯化钠和铁的熔化
D、冰融化、干冰的升华
2、下列过程中离子键被破坏的是(
)
A、NaCl晶体溶于水
B、钠和硫受热熔化
C、碘和干冰升华
D、Na2SO4晶体受热熔化
【课堂练习】
AD
AD
3、干冰升华时,克服的作用力为______,在这个变化过程中分子间的距离_____,碳、氧原子之间的共价键_____,物质的化学性质____。
分子间作用力
变大
不变
不变
4、下列关于氢键的说法正确的是( )
A、每一个水分子内含有两个氢键
B、冰、液态水中都存在氢键
C、分子间形成的氢键使物质的熔沸点升高
D、H2O是一种稳定的化合物,这是由于氢键所致
BC
例5、氢原子能与许多元素化合形成化合物。下图中,●代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键(如H2O表示为
①写出A、B两种分子的结构式并推测A的立体结构。
三角锥形
②C、D与A具有相似的分子结构,且A、C、D三种分子的中心原子属于同族非金属,试推测由A、C、D构成的三种纯净物中沸点最高的是哪一种?为什么?
A最高
A分子之间存在氢键,C、D分子间不存在氢键
练习1、判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
。
共价化合物
。
含共价键的离子化合物
。
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
常见的离子化合物:
强碱、绝大多数的盐、低价金属氧化物(如Na2O)
常见的共价分子:
大多数非金属单质、气态氢化物、
大多数酸性氧化物、酸、大部分有机物
苏教版高中化学必修二
1.2.3
分子间作用力和氢键
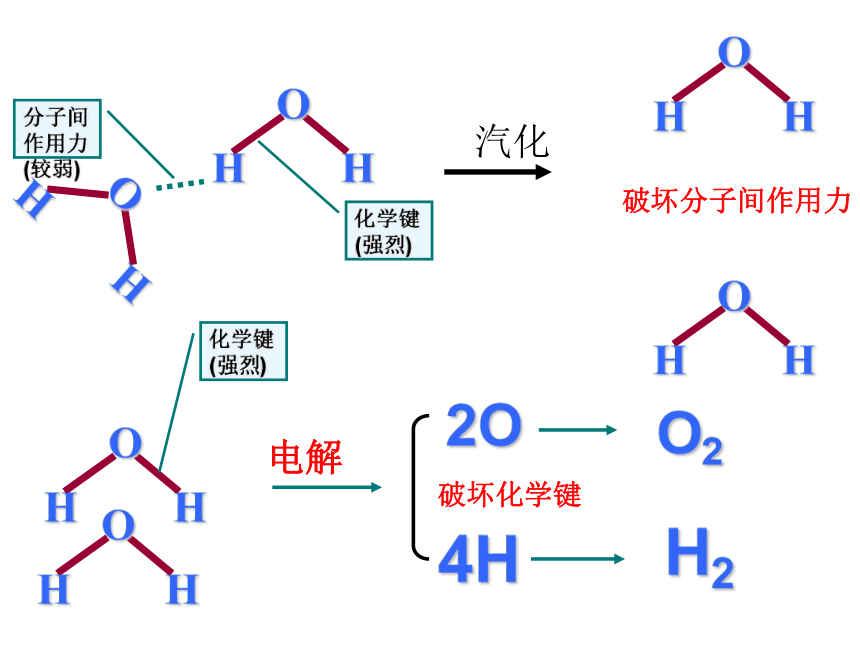
思考:冰熔化、气化现象是什么变化?
化学键破坏了吗?
为什么要吸收热量?
化学键
(强烈)
分子间作用力(较弱)
汽化
破坏分子间作用力
化学键
(强烈)
电解
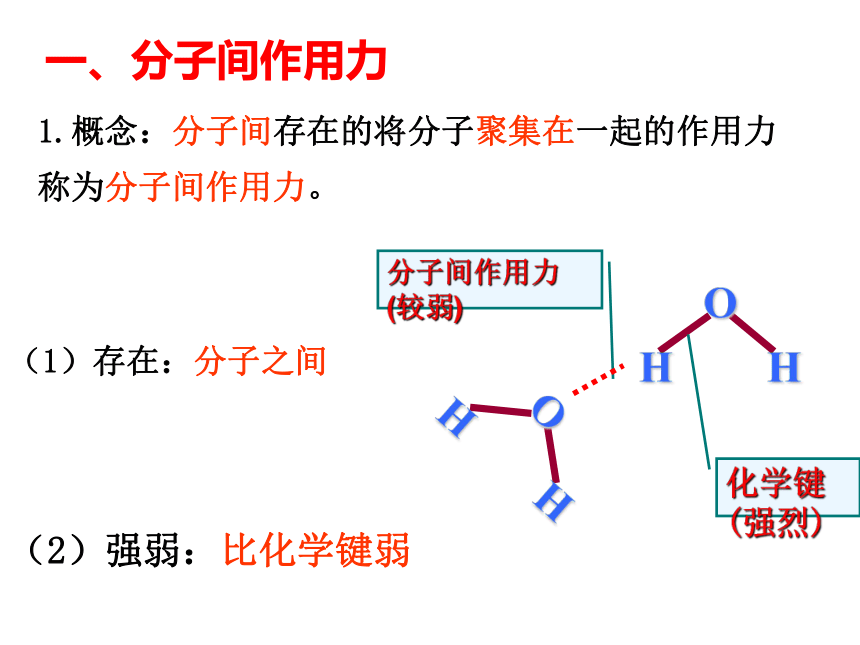
一、分子间作用力
(1)存在:分子之间
1.概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力。
(2)强弱:比化学键弱
分子间作用力(较弱)
化学键
(强烈)
原子或离子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
125--836KJ/mol
2--20KJ/mol
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么?
1.为什么NaCl在熔化状态或水溶液中具有导电性,而液
态氯化氢却不具有导电性。
破坏了离子键,形成自由移动的阴阳离子
原子间以共价键结合,分子间存在分子间作用力
作用微粒
作用力强弱
大小范围
化学键
分子间作用力(范德华力)
分子间的作用力强弱(范德华力)
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
一、分子间作用力
(1)存在:分子之间
1.概念:分子间存在的将分子聚集在一起的作用力称
为分子间作用力,又称为范德华力。
(2)强弱:比化学键弱
(3)主要影响物质的物理性质(熔沸点和溶解度)
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
1、将干冰气化,破坏了CO2分子晶体的
.
2、将CO2气体溶于水,破坏了CO2分子的
.
分子间作用力
共价键
4.请预测的熔沸点高低
(1)HF、HCl、HBr、HI
(2)H2O、
H2S
、H2Se、
H2Te
(3)NH3、PH3、AsH3、SbH3
事实真的是这样吗?
3、下列物质变化时,需克服的作用力不属于化学键的是(
)
A
、HCl溶于水
B
、
I2升华
C
、
H2O电解
D、
烧碱熔化
B
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
H2O
H2S
H2Se
H2Te
HF
HCl
HBr
HI
沸点如何变化?
违反常规?
二、氢键
1.氢键是一种特殊的分子间作用力,不是化学键
2.强弱:比化学键弱而比分子间作用力强
氢键
化学键
介于化学键与分子间作用力
二、氢键
3.氢键的表示方法:X—H…Y
X、Y可以相同,也可以不同(主要F、O、N)。
虚线:氢键
实线:共价键
4、氢键对物质性质的影响
⑴分子间氢键的存在使物质的熔沸点相对较高
(如HF、H2O、NH3)
(3)解释一些反常现象:
如水结成冰时,为什么体积会膨胀,密度减小,浮在水面上?
(2)氢键的形成使某些物质在水中的溶解度增大
(如极易NH3溶于水)
在固态水(冰)中,水分子间大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
相邻的原子间强
烈的相互作用
把分子聚集在一起的作用力
分子内原子间
分子之间
较
强
与化学键相比弱的多
主要影响化学性质
主要影响物理性质(如熔沸点)
三、化学键与分子间作用力的比较
某些物质的
分子间
分子之间
介于化学键与
分子间作用力
主要影响物理性质(如熔沸点)
化学键
氢键
分子间作用力
概念
作用范围
作用力强弱
影响的性质
1、下列各组物质汽化或熔化时,所克服的粒子间的作用(力)属同种类型的是(
)
A、碘和干冰的升华
B、二氧化硅和生石灰的熔化
C、氯化钠和铁的熔化
D、冰融化、干冰的升华
2、下列过程中离子键被破坏的是(
)
A、NaCl晶体溶于水
B、钠和硫受热熔化
C、碘和干冰升华
D、Na2SO4晶体受热熔化
【课堂练习】
AD
AD
3、干冰升华时,克服的作用力为______,在这个变化过程中分子间的距离_____,碳、氧原子之间的共价键_____,物质的化学性质____。
分子间作用力
变大
不变
不变
4、下列关于氢键的说法正确的是( )
A、每一个水分子内含有两个氢键
B、冰、液态水中都存在氢键
C、分子间形成的氢键使物质的熔沸点升高
D、H2O是一种稳定的化合物,这是由于氢键所致
BC
例5、氢原子能与许多元素化合形成化合物。下图中,●代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键(如H2O表示为
①写出A、B两种分子的结构式并推测A的立体结构。
三角锥形
②C、D与A具有相似的分子结构,且A、C、D三种分子的中心原子属于同族非金属,试推测由A、C、D构成的三种纯净物中沸点最高的是哪一种?为什么?
A最高
A分子之间存在氢键,C、D分子间不存在氢键
